相关试卷
-
1、用Cu2S、FeS处理酸性废水中的Cr2O , 发生的反应如下:
反应①:Cu2S+Cr2O+H+=Cu2+++Cr3++H2O(未配平)
反应②: FeS+Cr2O+H+=Fe3+++Cr3++H2O(未配平)
下列判断错误的是
A、处理等物质的量的Cr2O时,反应①和②中消耗H+的物质的量相等 B、用相同物质的量的Cu2S和FeS处理Cr2O时,Cu2S消耗更多Cr2O C、反应①中还原剂与氧化剂的物质的量之比为3∶5 D、用FeS处理废水不仅可以除去Cr2O , 还可吸附悬浮杂质 -
2、化学与人类社会可持续发展息息相关。下列说法不正确的是A、蛋白质是人类必需的营养物质,从动物皮、骨中提取的明胶可用作食品增稠剂 B、向蛋白质溶液加入浓硝酸立刻有黄色沉淀生成,该反应常用于蛋白质的分析检测 C、表面活性剂烷基磺酸根离子可将油渍等污垢包裹在胶束内腔,起到去污作用 D、甜味剂三氯蔗糖的甜度是蔗糖的600倍,可供糖尿病患者食用
-
3、下列说法不正确的是
 A、图①装置可用于探究卤族元素性质的递变 B、图②操作可排出盛有[Ag(NH3)2]OH滴定管尖嘴内的气泡 C、图③装置可验证无外力下气体可通过分子的扩散自发地混合均匀 D、图④装置可用于精密测量雨水的酸度
A、图①装置可用于探究卤族元素性质的递变 B、图②操作可排出盛有[Ag(NH3)2]OH滴定管尖嘴内的气泡 C、图③装置可验证无外力下气体可通过分子的扩散自发地混合均匀 D、图④装置可用于精密测量雨水的酸度 -
4、下列说法不正确的是A、羰基硫(COS)的电子式:
 B、白磷的结构式:
B、白磷的结构式: C、乙炔分子中π键示意图:
C、乙炔分子中π键示意图: D、乙醛的核磁共振氢谱:
D、乙醛的核磁共振氢谱:
-
5、下列说法不正确的是A、欲除去废水中的Cu2+、Hg2+离子,工业废水处理过程中可用Na2S作沉淀剂 B、非遗文化“打铁花”,铁水被击打化作无数火树银花点亮夜空照,此过程涉及到焰色试验 C、波尔多液(胆矾与石灰乳混合制得)作为一种常见的农药,防治虫害时涉及到蛋白质的变性 D、纤维素硝酸酯(又称硝酸纤维),极易燃烧,可用于生产火药、塑料和涂料等
-
6、下列物质的组成不正确的是A、3-甲基戊烷:CH3CH2CH(CH3)CH2CH3 B、铜蓝:CuS C、石炭酸:C6H5COOH D、加热到150℃的石膏:2CaSO4·H2O
-
7、某研究小组按下列路线合成药物中间体对乙酰氨基沙洛尔。
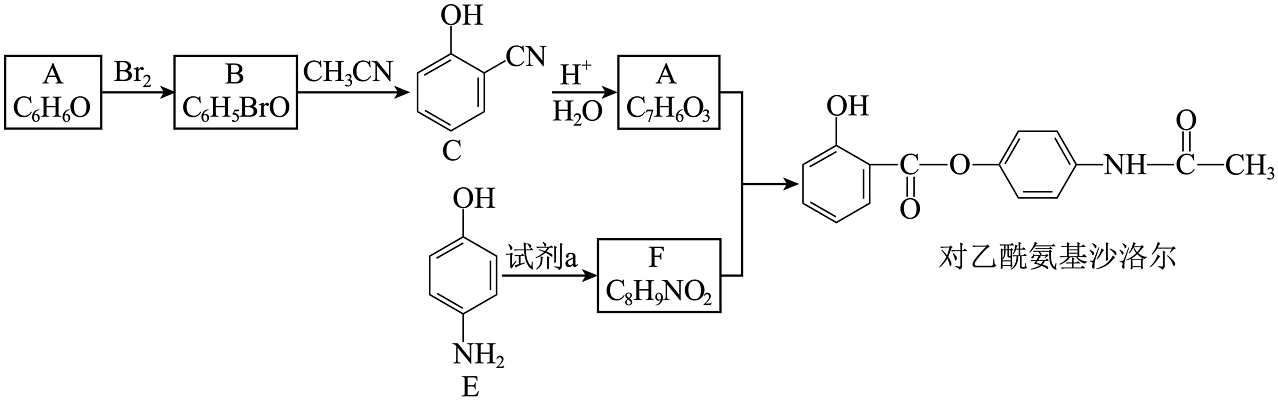
已知:①

 ;
;②;
③酚羟基易被氧化。
请回答:
(1)、化合物C的官能团名称是。(2)、化合物F的结构简式是。(3)、下列说法不正确的是___________。A、A→B的反应类型为取代反应 B、化合物E既能与盐酸反应,又能与碳酸氢钠溶液反应 C、试剂a可以是 D、对乙酰氨基沙洛尔的分子式是(4)、写出B→C的反应方程式。(5)、设计以A为原料合成E的路线(用流程图表示,无机试剂任选)。(6)、写出同时符合下列条件的化合物F的同分异构体的结构简式。①分子中只含一个环,且含苯环;
②谱IR谱检测表明:分子中共有3种不同化学环境的氢原子,无-OH基团。
-
8、磷酸二氢锂作为锂电池正极新型材料磷酸铁锂的原料,还能用于有机反应的催化剂。某研究小组制备 , 设计如下流程:

已知:在20℃时溶解度为126g,且随温度变化不大,难溶于醇。: , ;: , , 。
请回答:
(1)、第②步中反应完全的现象是。(2)、第③步中煮沸的目的是。(3)、第④步调pH适合的物质是(填化学式)。(4)、请给出方法l的操作顺序(从下列选项选择合适操作并按序排列):活性炭脱色→(___________)→(___________)→(___________)→(___________)→干燥。
a.趁热过滤 b.蒸发至溶液出现晶膜,停止加热 c.冷却 d.减压过滤
e.蒸发至溶液中出现大量晶体,停止加热 f.乙醇洗涤 g.冷水洗涤
(5)、方法2包括醇盐析、过滤、洗涤、干燥等步骤。根据以下图表判断,下列说法不正确的是___________。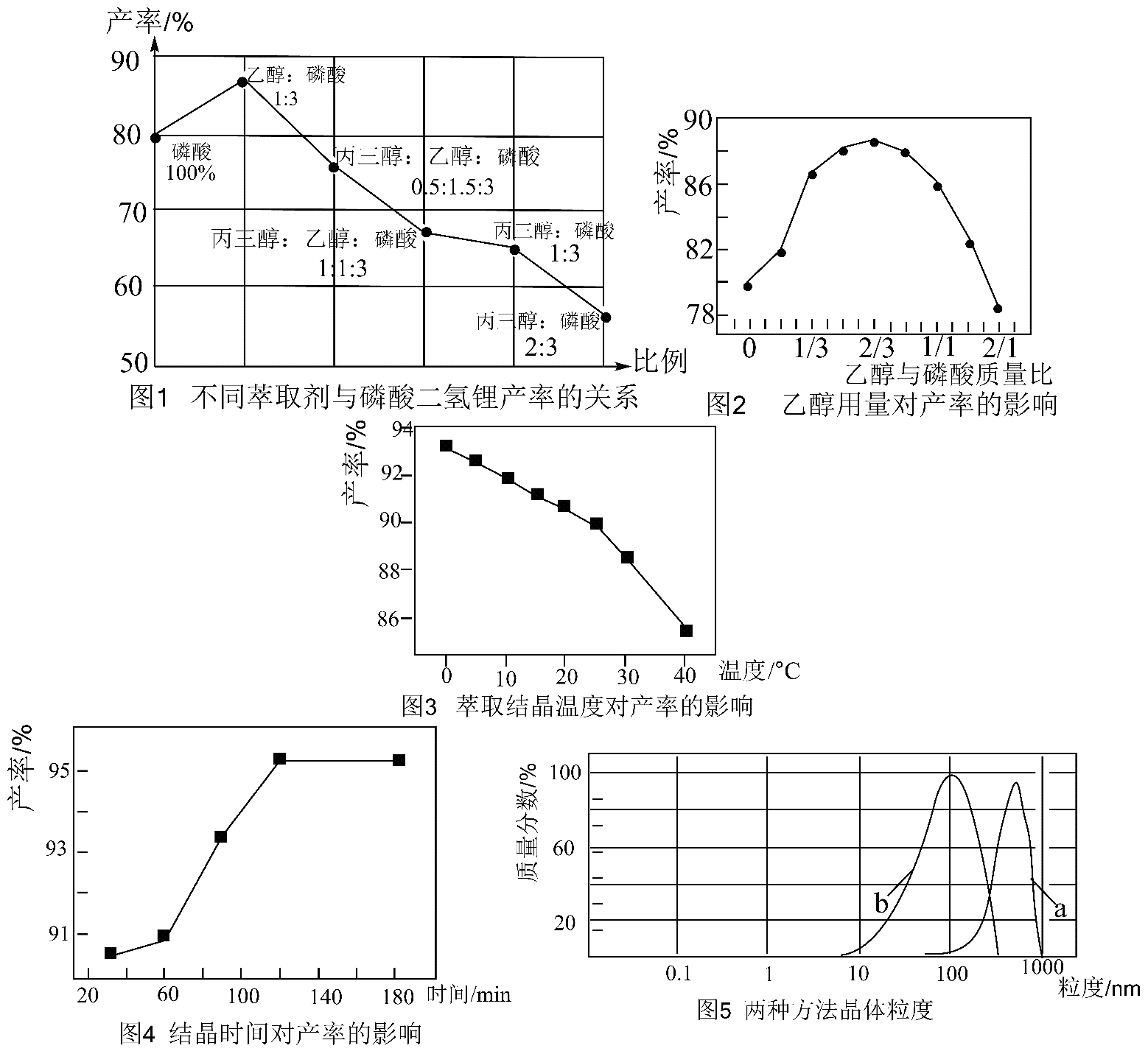 A、由图1可知,丙三醇的加入会使磷酸二氢锂的产率下降,加入量越多,产率越低,原因是丙三醇粘度很大,严重影响产物的过滤 B、由图2至图4可知,最佳控制条件是乙醇与磷酸质量比为2∶3,结晶温度0℃,结晶时间120min C、图5可知,方法1(a曲线)蒸发浓缩结晶时易得到大颗粒晶体,原因是水溶液中溶解度随温度变化较小,形成的晶核较少,晶体长大过程缓慢 D、图5可知,方法2(b曲线)乙醇盐析方法得到的晶体可用滤纸过滤(6)、若按的比例,将98.0%的高纯碳酸锂50.0g加入到磷酸溶液中,应用方法2得到104.0g , 则的产率为(保留三位有效数字)。
A、由图1可知,丙三醇的加入会使磷酸二氢锂的产率下降,加入量越多,产率越低,原因是丙三醇粘度很大,严重影响产物的过滤 B、由图2至图4可知,最佳控制条件是乙醇与磷酸质量比为2∶3,结晶温度0℃,结晶时间120min C、图5可知,方法1(a曲线)蒸发浓缩结晶时易得到大颗粒晶体,原因是水溶液中溶解度随温度变化较小,形成的晶核较少,晶体长大过程缓慢 D、图5可知,方法2(b曲线)乙醇盐析方法得到的晶体可用滤纸过滤(6)、若按的比例,将98.0%的高纯碳酸锂50.0g加入到磷酸溶液中,应用方法2得到104.0g , 则的产率为(保留三位有效数字)。 -
9、以煤为原料,经由甲醇可制取甲醚,也可以制取烯烃并可以此取代传统的以石油为原料制取烯烃的路线。(1)、已知:在25℃和101kPa条件下,甲醇的燃烧热为-726.5 , 乙烯的燃烧热为-1411 , (为活化能,R、C为常数,k为平衡常数)。则:
①脱水生成的热化学方程式是 , 该反应自发进行的条件是(填“较低”、“较高”或“任意”)温度。
②甲醇脱水生成乙烯的温度与平衡常数的实验数据图如图1所示,该反应的正反应的活化能为。
 (2)、以煤为原料气化产生的原料气可以用来合成和 , 合成气平衡转化率随氢碳比 ()的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成、、等,一定条件下,测得各烃的质量分数、转化率随温度变化情况如图3所示。
(2)、以煤为原料气化产生的原料气可以用来合成和 , 合成气平衡转化率随氢碳比 ()的变化如图2所示:甲醇制取烃的过程中,会发生多种反应,可以生成、、等,一定条件下,测得各烃的质量分数、转化率随温度变化情况如图3所示。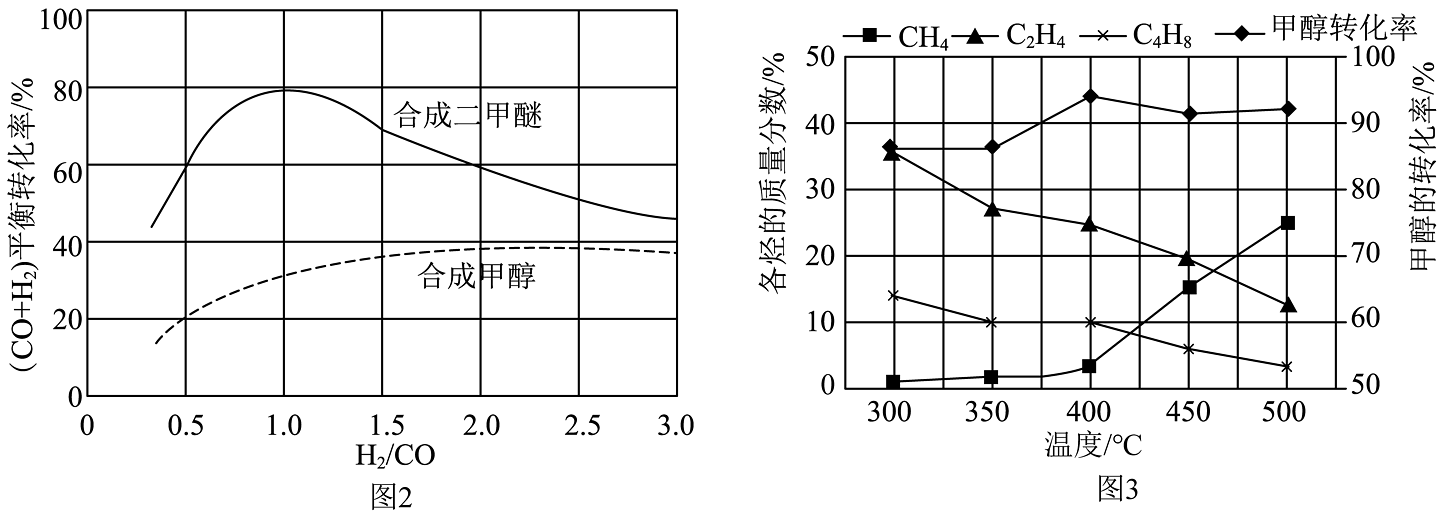
①下列叙述不正确的是。
A.合成的最佳氢碳比为1.0
B.甲醇制取烃的过程中,相同条件下,温度越高越有利于的生成
C.甲醇制取乙烯的过程中,一般控制在350℃~400℃比较合适
D.甲醇制取烃的过程中,的平衡转化率随温度升高先增大后减少
②原料气合成、过程有如下反应发生:
反应Ⅰ
反应Ⅱ
反应Ⅲ
图2中原料气合成的转化率高于的原因。
③在350℃,1MPa下,甲醇制取乙烯的转化率随时间的变化曲线如图4所示(为该条件下的平衡时刻)。画出在相同条件下,向容器中添加氮气作稀释剂时甲醇的转化率随时间的变化曲线。

-
10、工业上以原料气(、及少量CO、的混合气)、原料A、水为原料按如下流程制取B、C。
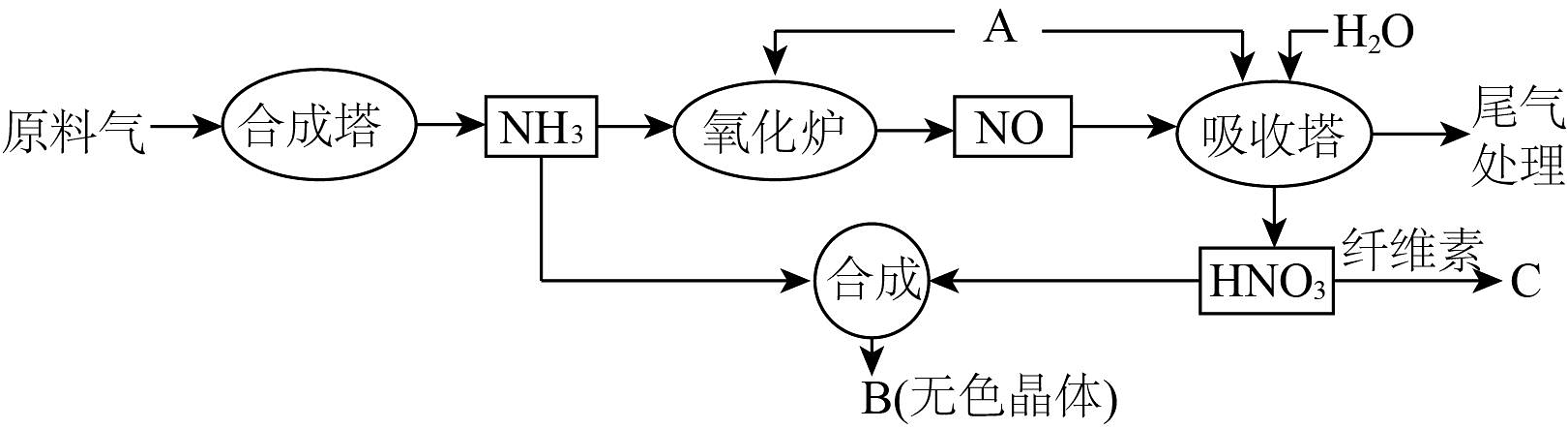
请回答:
(1)、写出氧化炉中生成NO的反应方程式。(2)、关于该流程中的下列说法正确的是___________。A、原料A是空气 B、尾气中的可以用纯碱溶液处理 C、化合物C是一种无机酸酯 D、制备的工业浓硝酸通常略显黄色是由于含有(3)、液氮有类似于水的性质,能发生自耦电离、氨解反应。已知: , 写出在液氨中的氨解反应方程式。(4)、设计实验验证无色晶体B是。写出实验过程中涉及阴离子检验的主要的离子反应方程式。 -
11、钛及其合金因有比重轻、强度高、耐腐蚀、耐高温等优异性能,广泛用于航天、航空、航海设施、医药等领域。请回答:(1)、基态钛原子的价层电子排布式是。(2)、Ti-Fe合金、硼氮甲基环戊烷(
 ,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。 A、吸、放氢过程都发生了化学变化 B、铁元素位于第四周期、第ⅧB族 C、硼氮甲基环戊烷组成元素中的第一电离能:N>B D、硼氮甲基环戊烷组成元素中的C、N原子的杂化方式都是(3)、分子结构与相同。
,间三氮三硼环在结构上与苯极为相似)都可作储氢材料。下列说法正确的是___________。 A、吸、放氢过程都发生了化学变化 B、铁元素位于第四周期、第ⅧB族 C、硼氮甲基环戊烷组成元素中的第一电离能:N>B D、硼氮甲基环戊烷组成元素中的C、N原子的杂化方式都是(3)、分子结构与相同。①能形成 , 则H-N-H的键角:(填“大于”“小于”或“等于”)。
②遇水难水解,而极易水解,原因是。
(4)、某硅钛化合物具有非常理想的导电性,可作电极材料。其晶胞如图,则化学式为。
-
12、下列方案设计、现象和结论都正确的是
选项
实验方案
现象
结论
A
向电石中滴加适量饱和氯化钠溶液,将产生的气体通入酸性高锰酸钾溶液中
酸性高锰酸钾溶液褪色
乙炔分子中含有不饱和的碳碳三键,能发生氧化反应
B
将足量的通入溶液中,再通入
一开始没有沉淀,后出现白色沉淀
有酸性,白色沉淀为
C
用pH试纸分别测定同浓度和NaClO溶液的pH
测得溶液pH大
水解程度小于
D
向2mL 0.1mol/L 溶液中滴加2~4滴2moL/L NaOH溶液,振荡,继续滴加4滴0.1mol/L 溶液,静置
先有白色沉淀生成,后有红褐色沉淀生成
溶解度:
A、A B、B C、C D、D -
13、常温下,某研究小组设计如下流程探究粗盐中的硫酸钠杂质的转化:

已知:溶液混合时体积变化忽略不计, , 。下列说法不正确的是
A、在A中有白色沉淀生成 B、在B溶液中: C、A→B的过程中全部转化为 D、B→C的过程中全部溶解,沉淀消失 -
14、某2L密闭容器中投入NO、O2分别为2mol、1mol,只发生反应:2NO+O22NO2 , 在不同温度下、相同时间(t min)内NO的转化率如下表所示。则下列说法正确的是
温度/℃
5
30
70
80
转化率/%
10
80
80
50
A、该反应是吸热反应 B、若温度为50℃,NO的转化率>80%, C、30℃、70℃温度下,t min时的生成速率相等 D、80℃温度下,该反应的平衡常数为2 -
15、根据HX的水溶液能量循环图:

下列说法不正确的是
A、由于氢键的存在, B、相同条件下,1mol HF(g)的熵=1mol HCl(g)的熵 C、相同条件下, D、相同条件的HX(aq)中,HI(aq)酸性最强,可推测HI电离的最小 -
16、下列说法不正确的是
 A、图①装置也能产生喷泉,用于演示喷泉实验图 B、图②装置可配制100mL 0.5mol/L的盐酸 C、图③装置可模拟苯处理苯酚废水 D、图④装置可用于中和反应反应热的测定
A、图①装置也能产生喷泉,用于演示喷泉实验图 B、图②装置可配制100mL 0.5mol/L的盐酸 C、图③装置可模拟苯处理苯酚废水 D、图④装置可用于中和反应反应热的测定 -
17、有科学家研究用姜黄素(姜黄中的物质)和金纳米粒子结合制造出新型纳米复合材料作为电极A的材料,得到更安全、更高效的乙醇燃料电池。下列说法不正确的是
 A、石墨电极为正极,发生还原反应 B、电极A的电极反应: C、加入可使电池持续大电流放电 D、放电时,阳离子向电极A移动
A、石墨电极为正极,发生还原反应 B、电极A的电极反应: C、加入可使电池持续大电流放电 D、放电时,阳离子向电极A移动 -
18、5-氟靛红结构如图所示,下列说法不正确的是
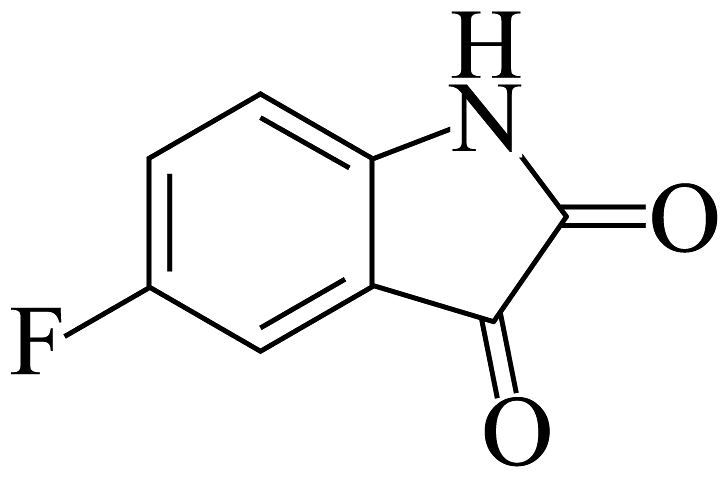 A、分子中存在3种官能团 B、分子中所有原子共平面 C、1mol该物质与足量HCl溶液反应,最多可消耗1mol HCl D、1mol该物质与足量NaOH溶液反应,最多可消耗3mol NaOH
A、分子中存在3种官能团 B、分子中所有原子共平面 C、1mol该物质与足量HCl溶液反应,最多可消耗1mol HCl D、1mol该物质与足量NaOH溶液反应,最多可消耗3mol NaOH -
19、下列说法不正确的是A、服用补铁剂(含)时,搭配维生素C(又称“抗坏血酸”)效果更好 B、利用溴水、碳酸氢钠溶液可鉴别苯、乙醇、乙酸、甲酸溶液和苯酚溶液 C、淀粉和纤维素属于天然高分子化合物,都能为人体提供能量 D、少量的硫酸钠稀溶液能促进鸡蛋清的溶解
-
20、下列反应的离子方程式正确的是A、铜片插入稀硫酸: B、氢硫酸中滴加双氧水: C、向氯化铝溶液中加入过量氢氧化钠溶液: D、过量通入硫酸铜稀溶液: