相关试卷
-
1、某课题小组拟选择如图所示部分装置制备并收集二氧化氯来探究其漂白性(装置不可重复使用)。
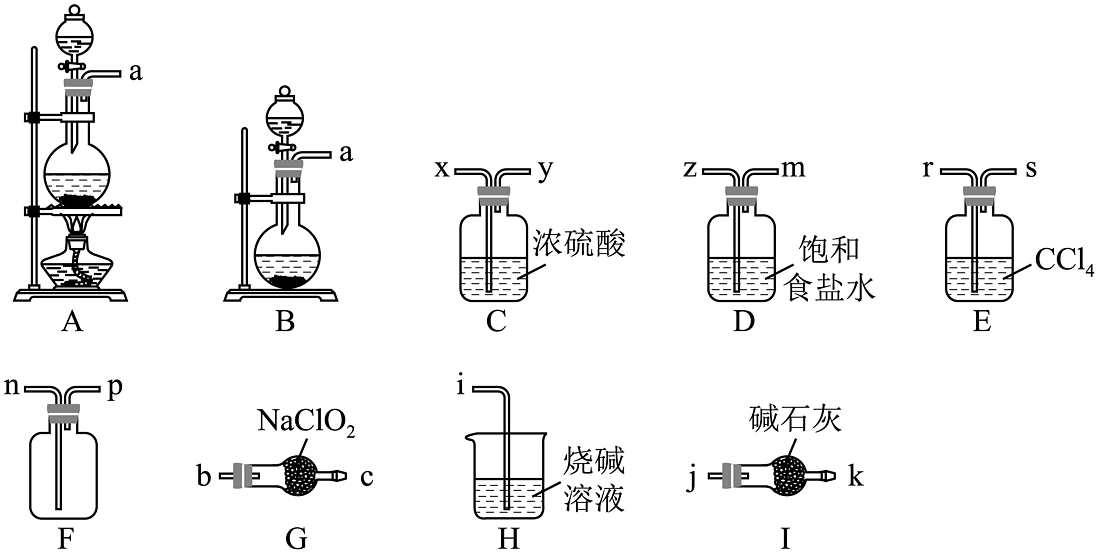
已知:①常温下,亚氯酸钠(NaClO2)与氯气反应的生成物之一为二氧化氯;②常温常压下,ClO2是一种易溶于水而难溶于有机溶剂的气体
②Cl2是一种易溶于有机溶剂而难溶于水的气体
回答下列问题:
(1)、制备干燥、纯净的氯气。气体发生装置是(填字母),反应的离子方程式为。(2)、制备二氧化氯。导管口连接顺序为a→→n→p→j。本实验选择装置I而不选择装置H的原因是。(3)、写出装置G中发生反应的化学方程式为。(4)、装置E的作用是 , 装置D的作用是。(5)、二氧化氯还会与H2O2和NaOH的混合溶液反应,其产物之一是NaClO2 , 写出该反应的化学方程式。 -
2、
Ⅰ.“价—类二维图”是一种体现“元素观”“分类观”“转化观”指导下实现元素化合物知识结构化的工具,它的核心是元素,方法是分类,内涵是转化。如图为钠及其化合物的“价—类二维图”,请回答下列问题:
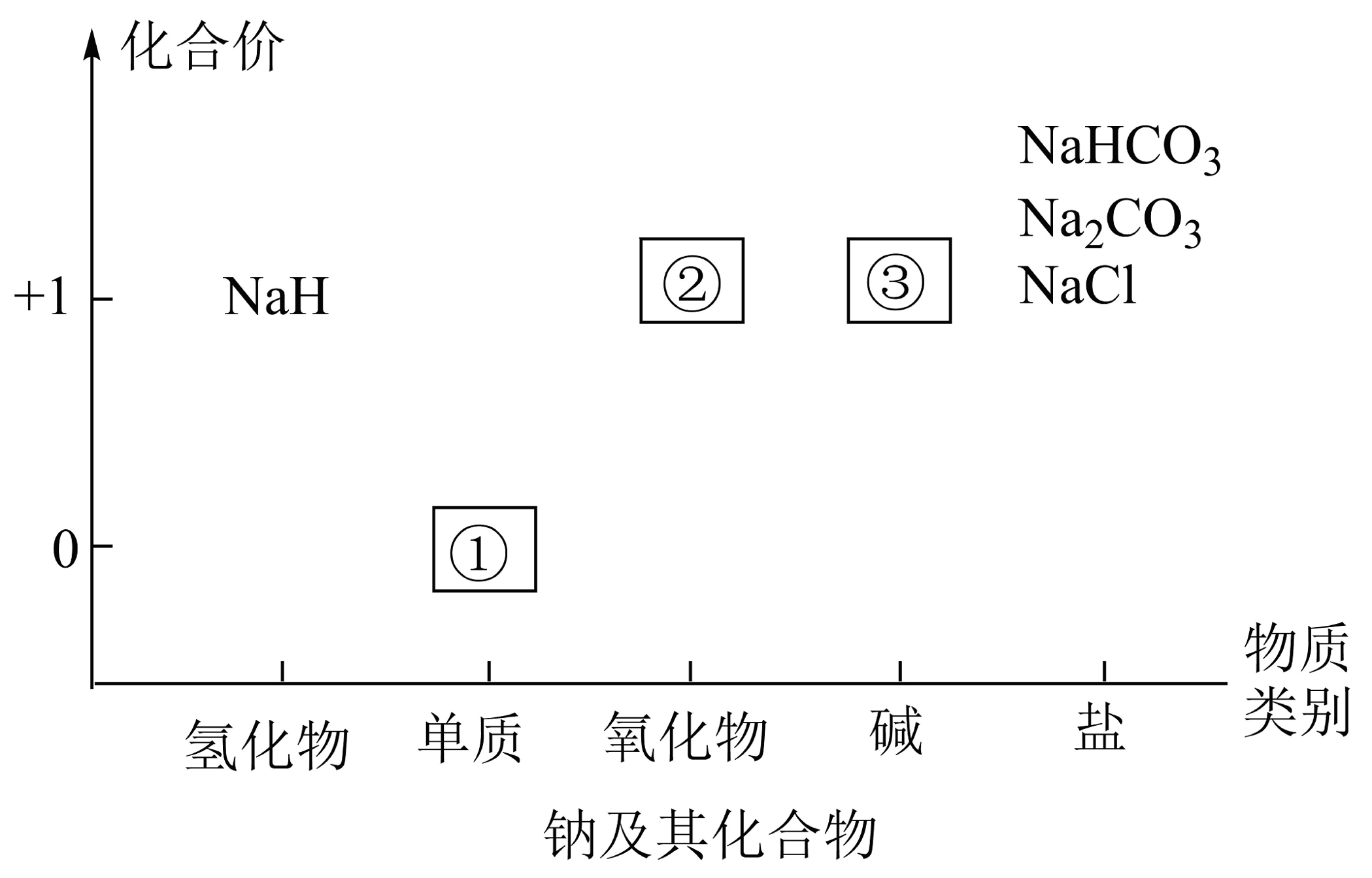
(1)①在空气中燃烧产物的阴阳离子个数比为。
(2)与水反应的化学方程式为 , NaH作剂。1molNaH参与反应,转移的电子数为
(3)写出③与NaHCO3反应的离子方程式。
Ⅱ.实验室工作人员用晶体配制溶液。
(4)选择仪器:所必需的玻璃仪器除烧杯、玻璃棒外,还有。
(5)计算,称量:需用天平称量克固体。溶解:恢复到室温,转移、洗涤、定容。定容的操作是:继续向容量瓶中加入蒸馏水,直到液面离刻度线时改用胶头滴管加水至溶液凹液面最低处与刻度线相切,盖好瓶塞,反复上下颠倒,摇匀。
(6)下列操作会使标准液浓度偏低的是。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未经干燥即用来配制溶液
C.定容时,俯视刻度线
D.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
E.碳酸钠晶体不纯,其中混有氯化钠
-
3、现有八种物质:①Ba(OH)2;②熔融KCl;③KHSO4;④乙醇;⑤液态氯化氢;⑥澄清石灰水;⑦CO2;⑧Zn;⑨FeCl2溶液,回答下列问题:(1)、上述物质中属于电解质的是(填序号,下同),属于非电解质的是 , 属于盐的是。(2)、写出物质③溶于水的电离方程式。(3)、写出过量③加入①中发生反应的离子方程式。(4)、检验⑨中的阳离子。
-
4、不同条件下,当KMnO4与KI按照反应①②的化学计量比恰好反应,结果如下。
反应序号
起始酸碱性
KI
KMnO4
还原产物
氧化产物
物质的量/mol
物质的量/mol
①
酸性
0.001
n
Mn2+
I2
②
中性
0.001
10 n
MnO2
IO
已知:MnO的氧化性随酸性减弱而减弱。下列说法正确的是
A、反应①,n(Mn2+)∶n(I2)=1∶5 B、对比反应①和②,x=5 C、反应①方程式:10I-+2MnO+16H+=2Mn2++5I2+8H2O D、随反应进行,体系碱性变化:①增强,②不变 -
5、三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是A、当它们的温度和压强均相同时,三种气体的密度: B、当它们的温度和密度都相同时,三种气体的压强: C、当它们的质量和温度、压强均相同时,三种气体的体积: D、当它们的压强和温度均相同时,三种气体的质量:
-
6、体积为VmL,密度为的ρg/cm3含有相对分子质量为M的某种物质的溶液,其中溶质为mg,其物质的量浓度为cmol/L,溶质的质量分数为w%,则下列表示正确的是A、 B、 C、c= D、
-
7、如图为铁元素的价类二维图,“”表示物质间的转化关系。下列说法正确的是
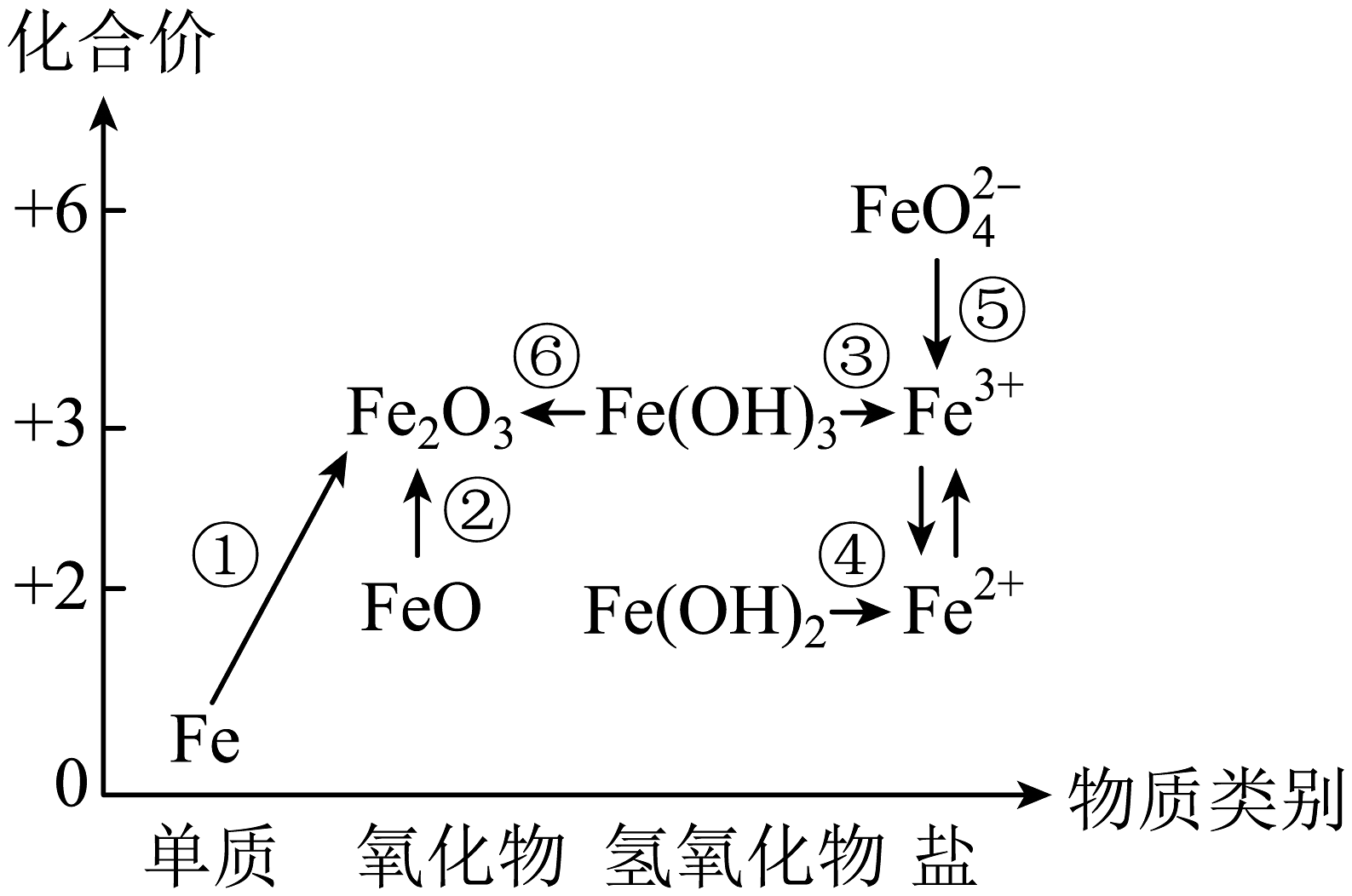 A、铁与水蒸气在高温条件下反应可实现转化① B、FeO在空气中受热可实现转化② C、溶解于足量稀硝酸可实现转化④ D、高铁酸盐(FeO)具有强氧化性,可用于杀灭水中细菌
A、铁与水蒸气在高温条件下反应可实现转化① B、FeO在空气中受热可实现转化② C、溶解于足量稀硝酸可实现转化④ D、高铁酸盐(FeO)具有强氧化性,可用于杀灭水中细菌 -
8、下列各离子组在指定的溶液中能够大量共存的是A、无色透明溶液中:、、、 B、使紫色石蕊溶液呈红色的溶液中:、、、 C、使酚酞试液呈红色的溶液中:、、、 D、溶液加入铝片可以产生:、、、
-
9、我国C919大型客机使用了第三代铝锂合金,具有密度低、强度高、耐腐蚀等特点。下列说法正确的是A、铝锂合金硬度比纯铝小 B、铝锂合金熔点比纯铝高 C、铝为惰性金属,比较耐腐蚀 D、铝有较好的导电性和导热性
-
10、关于和性质的说法不正确的是A、热稳定性: B、在水中的溶解性: C、与盐酸反应生成氢气的速率: D、可用澄清石灰水鉴别这两种物质
-
11、下列关于氯气的叙述不正确的是A、氯气是一种黄绿色、有刺激性气味的气体 B、钠在氯气中燃烧发出黄色火焰,产生大量白烟 C、纯净的氢气能在氯气中安静地燃烧,发出淡蓝色火焰 D、大量氯气泄漏时,迅速离开现场并尽量往高处去
-
12、土豆丝放入水中浸泡,水变浑浊并产生白色沉淀,其主要成分是有机物A,A遇碘会变蓝。以A为原料获得有机物E的转化关系如下图,已知E是有香味的无色油状液体。
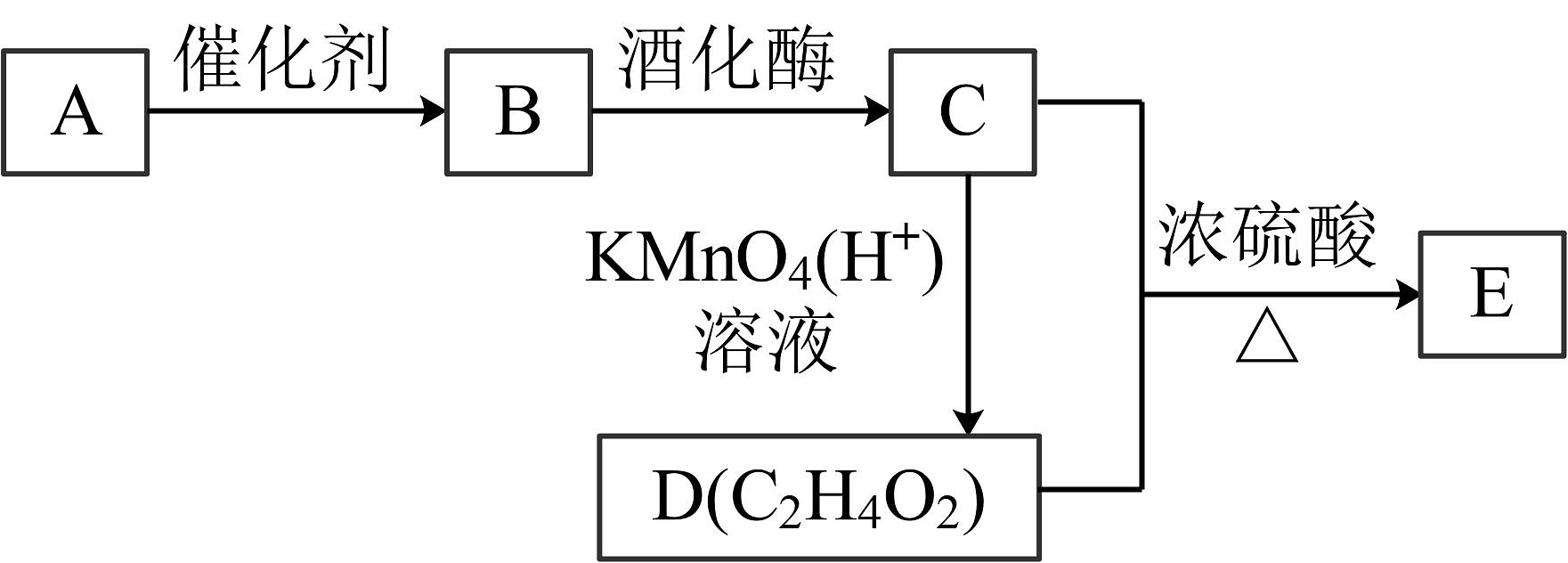
请回答:
(1)、有机物A的名称是。(2)、有机物B的分子式是。(3)、有机物C与D反应生成E的化学方反应程式是;有机物B到C的化学反应方程式是。(4)、下列说法正确的是___________。A、仅用Na2CO3溶液无法鉴别有机物C、D和E B、有机物A的分子式为C6H10O5 C、有机物B能发生银镜反应 D、工业上可以利用乙烯与水的加成反应制取有机物C -
13、回答下列问题。(1)、请根据下列信息判断氢气燃烧生成水蒸气时热量变化。

生成1mol水蒸气释放的能量kJ。
(2)、2SO2(g)+O2(g)2SO3(g),是工业制硫酸的主要反应之一、某条件下,在2L恒容容器中投入2molSO2和1molO2 , 如图是反应体系中部分物质的物质的量随时间的变化曲线。
①0到10min内,v(O2)=。
②下列情况能说明该反应达到化学平衡状态的是(填字母)。
A.n(SO2)=n(SO3)
B.v正(SO2)=v逆(SO2)
C.O2的含量保持不变
D.SO2、O2、SO3的浓度之比为2∶1∶2
③在密闭容器里,通入amolSO2(g)、bmolO2(g)、cmolSO3(g),发生上述反应,当改变某种条件时,反应速率会减小的是(填字母)。
A.降低温度 B.加入催化剂 C.增大容器体积 D.恒容下充入He
(3)、NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨Ⅰ电极上生成酸性氧化物Y,其电极反应式为。
-
14、
海洋是巨大的资源宝库,从海洋中获取部分资源的流程图如下:

回答下列问题:
Ⅰ.海水提溴
溴被称为“海洋元素”,空气吹出法从海水中提取溴单质的流程如下图所示:
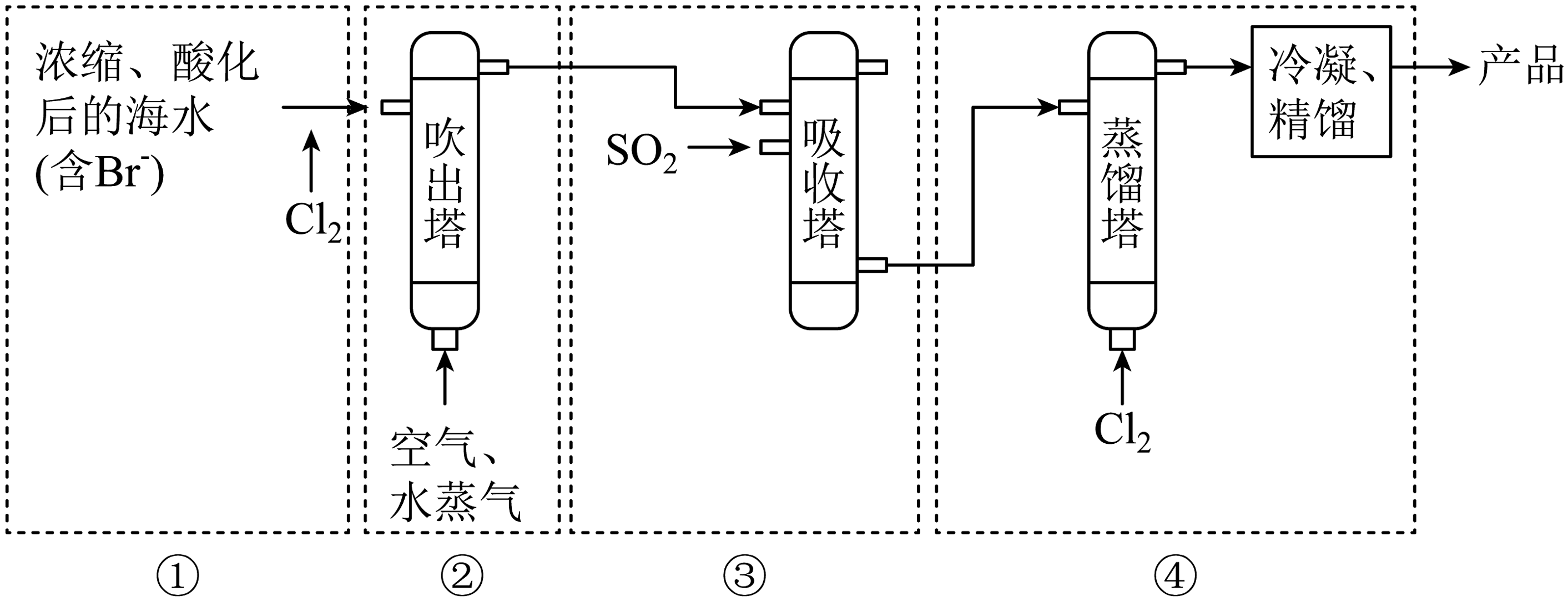
(1)过程③中SO2所起的作用为(用离子方程式表示)。
(2)步骤①已经获得Br2 , 步骤②③④的目的是。
Ⅱ.海水提镁
(3)该工业生产过程中,为了使MgCl2转化为Mg(OH)2 , 应加入的试剂为(填化学式)。
(4)写出冶炼金属Mg的化学方程式。
Ⅲ.海水提碘
(5)用氨碱工业获得的Cl2制备I2的一种方法如下图所示:

在“氧化”步骤中,当>1.5,单质碘的收率会降低,原因是。
-
15、对下列实验操作、现象及解释或结论均正确的是
选项
操作
现象
解释(或结论)
A
稀盐酸滴加到石灰石中,产生的气体通过盛有饱和溶液的洗气瓶后再通入到溶液中
石灰石表面产生气泡,
溶液中出现白色沉淀
非金属性:
B
将某无色晶体溶解于稀盐酸中酸化,所得澄清溶液中再滴加溶液
澄清溶液中出现白色沉淀
原无色晶体中含有
C
某无色溶液中滴加浓NaOH溶液,加热,湿润的红色石蕊试纸靠近试管口
湿润的红色石蕊试纸变蓝
原无色溶液不一定是铵盐溶液
D
溶液中滴加几滴淀粉试剂,再滴加几滴溶液
溶液出现蓝色
氧化性:
A、A B、B C、C D、D -
16、以下情况中,可以证明可逆反应达到平衡状态的有几个
Ⅰ. N2(g)+3H2(g) 2NH3(g)
①v正 (N2)= 2v逆(NH3);
②1个N ≡N键断裂的同时,有6个N-H键断裂
Ⅱ.2SO2(g)+O2(g)2SO3(g)
③恒温恒容时,气体的压强不再改变;
④恒温恒压时,气体的密度不再改变
Ⅲ. C(s)+H2O(g) CO(g)+H2(g)
⑤恒温恒容时,气体的密度不再改变;
⑥恒温恒容时,气体的平均相对分子质量不再改变
Ⅳ.NH2COONH4(s) 2NH3(g)+CO2(g)
⑦恒温恒容时,气体的平均相对分子质量不再改变;
⑧恒温恒压时,CO2的体积分数不再改变
Ⅴ.
⑨c(HI): c(H2):c(I2)=2:1:1;
⑩恒容绝热时,压强不再改变
A、6 B、7 C、8 D、9 -
17、有7种物质:①乙烷 ②环己烷(
 ) ③丙块 ④2-丁烯 ⑤环己烯(
) ③丙块 ④2-丁烯 ⑤环己烯( ) ⑥二氧化硫⑦聚乙烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有几种 A、2 B、3 C、4 D、5
) ⑥二氧化硫⑦聚乙烯,既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的有几种 A、2 B、3 C、4 D、5 -
18、以黄铁矿(主要成分为FeS2 , 其中硫的化合价为-1价)生产硫酸的工艺流程如图,下列说法不正确的是
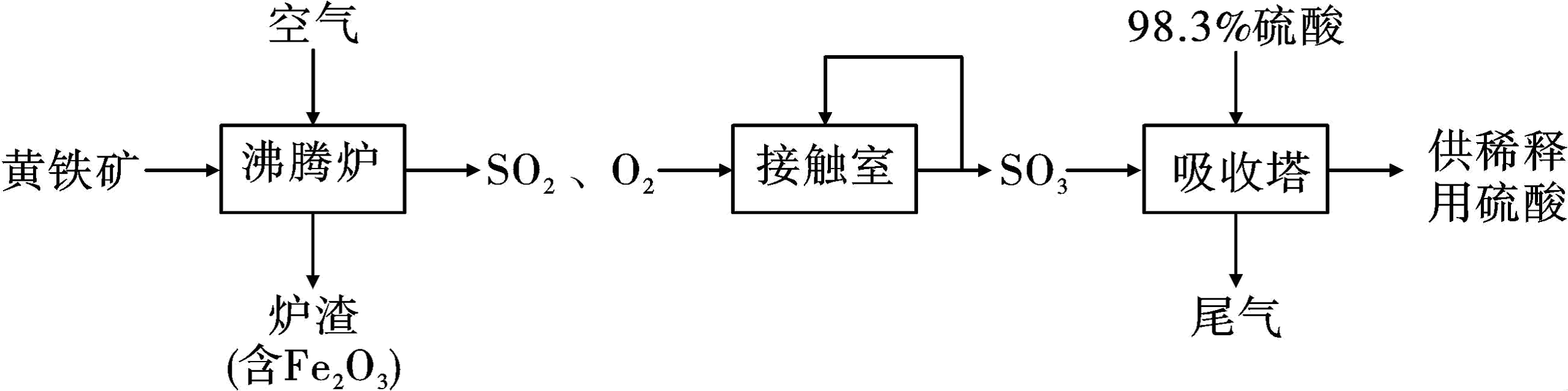 A、将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率 B、SO2能使酸性高锰酸钾溶液褪色体现了它的漂白性 C、接触室中排放出的SO2、O2循环利用,可提高原料利用率 D、可用浓氮水吸收尾气,并进一步转化为氮肥
A、将黄铁矿粉碎,可以提高其在沸腾炉中的反应速率 B、SO2能使酸性高锰酸钾溶液褪色体现了它的漂白性 C、接触室中排放出的SO2、O2循环利用,可提高原料利用率 D、可用浓氮水吸收尾气,并进一步转化为氮肥 -
19、某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应 ,在其他条件相同时,测得实验数据如下表:
压强/(×105Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据,下列说法正确的是
A、升高温度,反应速率加快 B、增大压强,反应速率变慢 C、在1.0×105Pa、90℃条件下,当转化率为98%时的反应已达到平衡 D、若进入反应塔的混合气体为amol,反应速率以v=Δn/Δt表示,则在8.0×105Pa、30℃条件下转化率从50%增至90%时段NO的反应速率为4a/370mol/s -
20、纯二氧化硅可用下列流程制得。下列说法不正确的是
 A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2来代替 D、SiO2既能与NaOH溶液反应,又能与氢氟酸反应,所以SiO2是两性氧化物
A、X可用作木材防火剂 B、步骤Ⅱ的反应是Na2SiO3+H2SO4=H2SiO3↓+Na2SO4 C、步骤Ⅱ中的稀硫酸可用CO2来代替 D、SiO2既能与NaOH溶液反应,又能与氢氟酸反应,所以SiO2是两性氧化物