相关试卷
-
1、氮及其化合物的转化具有重要应用。下列说法不正确的是A、自然固氮、人工固氮都是将转化为 B、侯氏制碱法以、、、为原料制备和 C、工业上通过催化氧化等反应过程生产 D、多种形态的氮及其化合物间的转化形成了自然界的“氮循环”
-
2、酮基布洛芬(D)是用于治疗各种关节炎、强直性脊柱炎引起的关节肿痛以及痛经、牙痛、术后痛和癌性痛的非处方药,其有多种合成路线,其中一种如图所示。

回答下列问题:
(1)、A的名称为 , B中官能团名称为。(2)、在A的同分异构体中,同时满足下列条件:①属于芳香族化合物;②苯环上有两个取代基且其中一个是醛基(-CHO)
其中核磁共振氢谱显示为4组峰,且峰面积比为3∶2∶2∶1的结构简式为。
(3)、下列关于物质D的说法中错误的是。a.可以发生氧化反应,加成反应、取代反应
b.分子中sp3杂化的碳原子只有1个
c.C→D的转化一定会涉及σ、π的形成和断裂
d.通过成酯修饰可缓解其酸性较强对胃肠的刺激
(4)、对化合物C,分析预测其可能的化学性质,完成下表。序号
反应试剂、条件
反应形成的新结构
反应类型
①

②
取代反应
(5)、若C到D的转化需要用到E:CH2=CH-COOHE有多种合成路线:
①若通过两种直线型分子先加成再水解获得,请写出其中有机物的结构简式为。
②若通过含氧有机物F酸性水解获得,并且还同时获得一种常见的液态燃料,请写出F与足量NaOH溶液的化学方程式。
-
3、酸在多种反应中具有广泛应用,其性能通常与酸的强度密切相关。(1)、最新研究工业上可以用H+ - Ag为催化剂氧化乙烯制备环氧乙烷(简称EO);反应方程式为2C2H4(g) + O2(g) → 2EO(g)(反应a)
已知:

①Ag位于第五周期,与Cu同族,有相似的核外电子排布,写出Ag价电子排布式。
②反应a的ΔH=。
(2)、某小组研究了3种酸对反应a的催化作用。在相同条件下,向反应体系中滴加等物质的量的少量酸,测得体系的温度T随时间t的变化如图。
据图可知,在该过程中___________。
A、催化剂酸性增强,可增大反应焓变 B、催化剂酸性增强,有利于提高反应速率 C、催化剂分子中含H越多,越有利于加速反应 D、反应速率并不始终随着反应物浓度下降而减小(3)、我国科学家报道了一种高效O-to-C的替换反应,可在温和条件下将环氧化物快速转化为环丙烷结构。一种脱氧/环加成串联反应机理如图,其中的催化剂为(填图中字母)。 (4)、在非水溶剂中研究弱酸的电离平衡具有重要科学价值:弱酸H2A在有机相和水相中存在平衡:H2A(环己烷)H2A(aq),平衡常数为Kd 。25℃时,向VmL 0.1mol∙L-1 H2A环己烷溶液中加入VmL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中c(H2A)、c(HA-)、c(A2-)、环己烷中H2A的浓度 [c环丙烷(H2A)]、水相萃取率α[α=1-]随pH的变化关系如图。
(4)、在非水溶剂中研究弱酸的电离平衡具有重要科学价值:弱酸H2A在有机相和水相中存在平衡:H2A(环己烷)H2A(aq),平衡常数为Kd 。25℃时,向VmL 0.1mol∙L-1 H2A环己烷溶液中加入VmL水进行萃取,用NaOH(s)或HCl(g)调节水溶液pH。测得水溶液中c(H2A)、c(HA-)、c(A2-)、环己烷中H2A的浓度 [c环丙烷(H2A)]、水相萃取率α[α=1-]随pH的变化关系如图。
已知:H2A在环己烷中不电离,且忽略过程中溶液体积的变化
①表示c环丙烷(H2A)的曲线为。(填字母)
②由图计算pH=6,H2A的Kd= , Ka1= , Ka2=及水相萃取率α=。(保留三位有效数字)
-
4、水合硼酸锌(2ZnO∙3B2O3∙3.5H2O,不溶于冷水)在阻燃方面具有诸多优点。以铁硼矿(主要成分为Mg2B2O5∙H2O,以及少量Fe2O3、FeO、Al2O3和SiO2等)和菱锌矿(主要成分为ZnCO3 , Fe2O3、FeO和SiO2等)为原料制备水合硼酸锌的工艺流程如下:

已知:该工艺条件下金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子
Fe3+
Fe2+
Al3+
Zn2+
Mg2+
开始沉淀pH
1.9
7.0
3.0
6.2
8.9
完全沉淀pH
3.2
9.0
4.7
8.0
10.9
回答下列问题:
(1)、“酸浸”时,Mg2B2O5∙H2O发生的离子方程式为 ,为加快“酸浸”时的浸取速率措施有(填一种)。(2)、“氧化”步骤温度不能过高的原因是。(3)、“二次调pH”时的pH范围为。(4)、“制备”水合硼酸锌的化学方程式为。(5)、一种测定硼酸纯度的方法:准确称取制得的晶体试样mg溶于水中,加入足量甘露醇,摇匀后配制成100mL溶液,取25.00mL于锥形瓶中,用酚酞试液作指示剂,用cmol/LNaOH标准液滴定至终点,消耗NaOH溶液VmL。已知:i.H3BO3在水中: H3BO3 + H2OB(OH)+ H+
ii.H3BO3与甘露醇等多羟基化合物形成稳定的络合物,增大其电离度,提高H3BO3酸性

①B易形成络离子的原因为 , ⅱ中络合物B原子的杂化方式为。
②H3BO3不能直接用NaOH溶液滴定,需要加入甘露醇之后再滴定的原因是 。
(6)、硼还可与多种金属形成化合物,其中与Ca组成的金属硼化物可做新型半导体材料,晶胞结构如图所示:
已知B6八面体(该结构中心位于晶胞顶点)中B-B键的键长为r pm,晶胞参数为a pm,如果以晶胞棱长长度为1建立坐标系来表示晶胞中钙原子的分数坐标为( , , ),则M点原子的分数坐标为。
-
5、氧化还原反应可拆分为氧化和还原两个“半反应”,可以用电极反应式表示。某小组利用半反应研究Cu2+和Fe3+的氧化性,进行如下实验。(1)、实验I:配制480mL0.1000mol∙L-1FeCl3溶液:
①计算需要FeCl3∙7H2O[M(FeCl3∙7H2O)=a g/mol]固体的质量:g。
②配制溶液过程中,下列仪器中一定不需要的是(填字母)。
 (2)、实验Ⅱ:
(2)、实验Ⅱ:步骤
现象
ⅰ.取40mL0.1000mol∙L-1FeCl3加入足量Cu片
溶液变为蓝色
ⅱ.静置取上层清液,滴加足量0.1mol∙L-1KSCN溶液
产生白色沉淀,振荡后变红
已知: CuSCN是一种难溶于水的白色固体
①从ⅰ得到一般性结论,氧化性:Fe3+ Cu2+(填“>”、“<”或“=”)。
②如果把ⅱ中的氧化还原拆成两个半反应,氧化半反应: Fe2+ - e- + 3SCN- = Fe(SCN)3。
③则还原半反应: , 因此得到结论:特定情况下氧化性Cu(Ⅱ)>Fe(Ⅲ)。
该小组同学查阅资料得知:
氧化半反应正移提高物质的还原性,还原半反应正移提高物质的氧化性
请结合平衡的知识,解释ⅱ中Cu2+可以氧化Fe2+可能的原因:。
(3)、实验Ⅲ:探究Cu2+、Fe3+、(SCN)2的氧化性步骤
现象
ⅲ.取20mL0.1mol∙L-1CuCl2 , 滴加足量0.1mol∙L-1KSCN
产生白色沉淀
ⅳ.取20mL0.1mol∙L-1FeCl3 , 滴加足量0.1mol∙L-1KSCN
溶液变红
ⅴ.取ⅳ中溶液滴加试剂m
无明显变化
步骤ⅴ的目的是为了进一步验证iv中Fe3+是否氧化SCN- , 试剂m是(填化学式)。
结论:Cu2+ > (SCN)2 > Fe3+
(4)、有同学认为上述结论不够严谨,由于混合时Fe3+与SCN-络合往往快于其它反应,所以实验ⅳ不能够证明Fe3+一定无法氧化SCN- , 于是设计简单的实验方案,证明在不相互混合的情况下,Fe3+也可以氧化SCN- , 所以物质的浓度会影响氧化性或还原性,具体问题应该结合具体情境分析。写出实验方案,并要有体现该结论的实验证据:。 -
6、在催化剂表面,丙烷催化氧化脱氢反应历程如下图。下列说法不正确的是
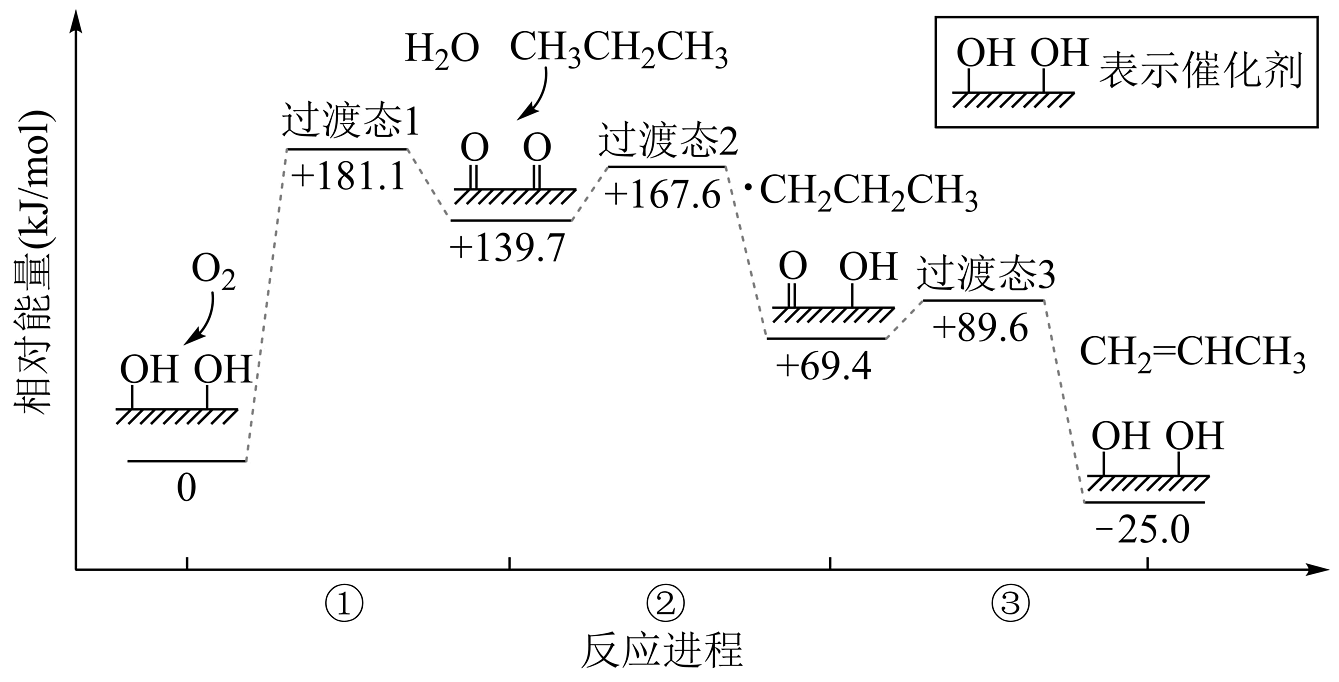 A、该历程有三个基元反应 B、①中,催化剂被氧化 C、②中,丙烷分子中的甲基先失去氢原子 D、总反应的速率由③决定
A、该历程有三个基元反应 B、①中,催化剂被氧化 C、②中,丙烷分子中的甲基先失去氢原子 D、总反应的速率由③决定 -
7、陈述I和陈述Ⅱ均正确,且具有因果关系的是
选项
陈述I
陈述Ⅱ
A
酚醛树脂可用作宇宙飞船返回舱外壳
酚醛树脂为高分子化合物,属于纯净物
B
利用FeS除去废水中的Hg2+
Ksp(FeS)<Ksp(HgS)
C
气态氢化物稳定性:H2S<H2O
熔、沸点:H2S<H2O
D
与Na反应速率:乙醇<H2O
H2O为电解质,乙醇为非电解质
A、A B、B C、C D、D -
8、一种除草剂的结构如图,X、Y、Z、W、R为原子序数依次增大的短周期元素,Z与R同主族。下列有关说法正确的是
 A、Y、Z、W的第一电离能的顺序为W>Z>Y B、最简单氢化物的稳定性:Z<R C、X与W形成的化合物为非极性分子 D、该分子能与碱反应
A、Y、Z、W的第一电离能的顺序为W>Z>Y B、最简单氢化物的稳定性:Z<R C、X与W形成的化合物为非极性分子 D、该分子能与碱反应 -
9、设NA 为阿伏加德罗常数的数值 ,下列说法正确的是A、1 mol 过氧化钠和足量水反应转移电子数为2NA B、标准状况下,11.2L SO3所含的分子数为0.5NA C、常温常压下,46g的NO2和N2O4混合气体含有的氧原子数为2NA D、46g C2H6O完全燃烧,需要氧气的体积为67.2L
-
10、硝苯地平临床用于预防和治疗冠心病、心绞痛,也用于治疗高血压,其结构简式如图所示。下列有关说法正确的是
 A、该有机物有5种官能团 B、该有机物易溶于水 C、该有机物所有原子可能共面 D、该有机物能发生加成反应、取代反应
A、该有机物有5种官能团 B、该有机物易溶于水 C、该有机物所有原子可能共面 D、该有机物能发生加成反应、取代反应 -
11、苯甲酸常用作防腐剂、药物合成原料、金属缓蚀剂等,微溶于冷水,易溶于热水、酒精。实验室常用甲苯为原料,制备少量苯里酸,具体流程如图所示:

 +MnO2苯甲酸钾溶液苯甲酸固体
+MnO2苯甲酸钾溶液苯甲酸固体下列说法正确的是
A、操作1为蒸发 B、操作2为过滤 C、操作3为酒精萃取 D、进一步提纯苯甲酸固体,可采用重结晶的方法 -
12、港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是A、防腐涂料可以防水、隔离O2 , 降低吸氧腐蚀速率 B、防腐过程中铝和锌均作为负极,失去电子 C、钢铁在海水中发生吸氧腐蚀时正极反应为O2+4e-=2O2- D、方法①②③只能减缓钢铁腐蚀,未能完全消除
-
13、化学科学在“国之重器”的打造中发挥着重要作用。下列有关叙述正确的是A、“墨子号”卫星成功发射实现了光纤量子通信,生产光纤的原料为晶体硅 B、实现海上首飞的“鲲龙”水陆两栖飞机的燃料为航空煤油,其组成元素与生物柴油相同 C、长征五号火箭的箭体蒙皮材料2219-铝合金,可一定程度上减轻火箭的质量 D、“奋斗者”号载人潜水器成功坐底,深度10909m,所用硬质合金潜孔钻头属于复合材料
-
14、杭州亚运会的成功举办、“天宫课堂”的如期开讲、天舟六号货运飞船成功发射、嫦娥五号采回月壤等,均展示了我国科技发展的巨大成就。下列说法错误的是A、月壤中的与地球上的互为同位素 B、杭州亚运会火炬所用燃料甲醇为有机物 C、发射天舟六号货运飞船的火箭所用推进剂为液氮和液氢 D、乙酸钠过饱和溶液析出晶体并放热的过程涉及物理变化和化学变化
-
15、我国在几千年前就把制作乐器的材质分成了八类:金、丝、石、竹、匏、土、革、木。下列材质的主要成分属于有机高分子的是




A.金(代表乐器锣)
B.石(代表乐器磬)
C.竹(代表乐器笛)
D.土(代表乐器埙)
A、A B、B C、C D、D -
16、甲醇是一种理想的可再生清洁能源。CO2和H2在一定条件下合成甲醇:CO2(g) + 3H2(g)CH3OH(g) + H2O(g) ΔH;相关物质的能量如图1所示,在两个容积相同的密闭容器中分别充入n molCO2和3n molH2 , 在两种催化剂(I和II)、不同温度下发生上述反应,经过相同时间测得CO2的转化率与温度的关系曲线如图2所示(不考虑温度对催化剂活性的影响),下列说法不正确的是
 A、—49.3 B、C点的正反应速率: C、在T2温度下,此反应活化能:催化剂I>催化剂II D、T1—T3温度区间,反应未达平衡,CO2的转化率随温度升高而增大
A、—49.3 B、C点的正反应速率: C、在T2温度下,此反应活化能:催化剂I>催化剂II D、T1—T3温度区间,反应未达平衡,CO2的转化率随温度升高而增大 -
17、高铁酸钾是一种新型、高效、多功能绿色环保水处理剂,某兴趣小组以铁屑为原料制备高铁酸钾的流程如下。
 (1)、中的化合价为。(2)、“氧化”时,生成的离子反应方程式为 , 该反应生成的个数和转移电子的个数比为。(3)、反应I的发生,能证明该条件下两种物质的氧化性大小关系为。(4)、反应I的还原产物是。参加反应I的和的离子数目比为。(5)、高铁酸钾净水的原理与其强氧化性以及遇水产生胶体有关。实验室用饱和溶液制备胶体的方法是。(6)、为探究酸性条件下氧化性强弱,甲同学取反应I所得含溶液滴入到盐酸中,观察到产生黄绿色气体,经检验气体为。该现象能否证明“酸性条件下氧化性强于”,并说明理由。(7)、另一种制备的方案是:
(1)、中的化合价为。(2)、“氧化”时,生成的离子反应方程式为 , 该反应生成的个数和转移电子的个数比为。(3)、反应I的发生,能证明该条件下两种物质的氧化性大小关系为。(4)、反应I的还原产物是。参加反应I的和的离子数目比为。(5)、高铁酸钾净水的原理与其强氧化性以及遇水产生胶体有关。实验室用饱和溶液制备胶体的方法是。(6)、为探究酸性条件下氧化性强弱,甲同学取反应I所得含溶液滴入到盐酸中,观察到产生黄绿色气体,经检验气体为。该现象能否证明“酸性条件下氧化性强于”,并说明理由。(7)、另一种制备的方案是:【步骤Ⅰ】在密闭、干燥的环境中混合,加热到700℃:。用单线桥表示该反应电子转移的方向和数目。
【步骤Ⅱ】再生:
该制备的方案相比于兴趣小组的制备方案的优点是。(填一项)
-
18、氯化铁是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:

已知:氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
(1)、A中发生反应的离子方程式为。(2)、B中液体为。(3)、铁粉与氯气在加热条件下反应的化学方程式为。(4)、C放置在盛冰水的水槽中,冰水浴的作用是。(5)、D中装的药品可以选用(填一种),它的作用是。(6)、该小组在实验中发现稀盐酸与混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:猜想①:是由于浓度降低所致。
猜想②:是由于所致。
根据猜想,小组设计了以下实验方案进行验证:
a.稀盐酸滴入中,然后通入气体加热
b.稀盐酸滴入中,然后加入固体加热
c.稀盐酸滴入中,然后加入浓硫酸加热
d.与的浓溶液混合加热
e.浓硫酸与固体、固体共热
现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此可知猜想成立。
-
19、试剂级可用海盐(含泥沙、海藻、、、、、等杂质)为原料制备。制备流程简图如下:
 (1)、除杂和操作的目的是除去海盐溶液中的杂质离子。根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。
(1)、除杂和操作的目的是除去海盐溶液中的杂质离子。根据除杂原理,在表中填写除杂时依次添加的试剂及其预期沉淀的离子。实验步骤
试剂
预期沉淀的离子
步骤1
溶液
步骤2
溶液
①
步骤3
②
③
(2)、操作X为。(3)、检验溶液I中是否残留有胶体的方法是。(4)、检验溶液I中含有的方法及对应现象为。(5)、某研究小组制备的溶液中的杂质可能含有下列离子中的几种:、、、、、 , 现通过以下实验对其成分进行确定。回答有关问题:实验编号
实验步骤
实验现象
实验结论
实验1
取少量固体样品,加水溶解
得到澄清溶液
实验2
取适量溶液加入烧杯中,加入足量溶液,过滤、洗涤、干燥,得到白色沉淀和滤液。①
②。
样品中存在 , 不存在
实验3
向滤液中滴加酚酞试液
溶液变红。
样品中不存在③。(填离子符号)
-
20、钠及其化合物的系列转化如下:
 (1)、B的化学式中阳离子和阴离子的个数之比为。(2)、写出B→D反应的化学方程式:。(3)、若用所示装置验证D、E的热稳定性,则乙中装入的固体最好是(填化学式)。
(1)、B的化学式中阳离子和阴离子的个数之比为。(2)、写出B→D反应的化学方程式:。(3)、若用所示装置验证D、E的热稳定性,则乙中装入的固体最好是(填化学式)。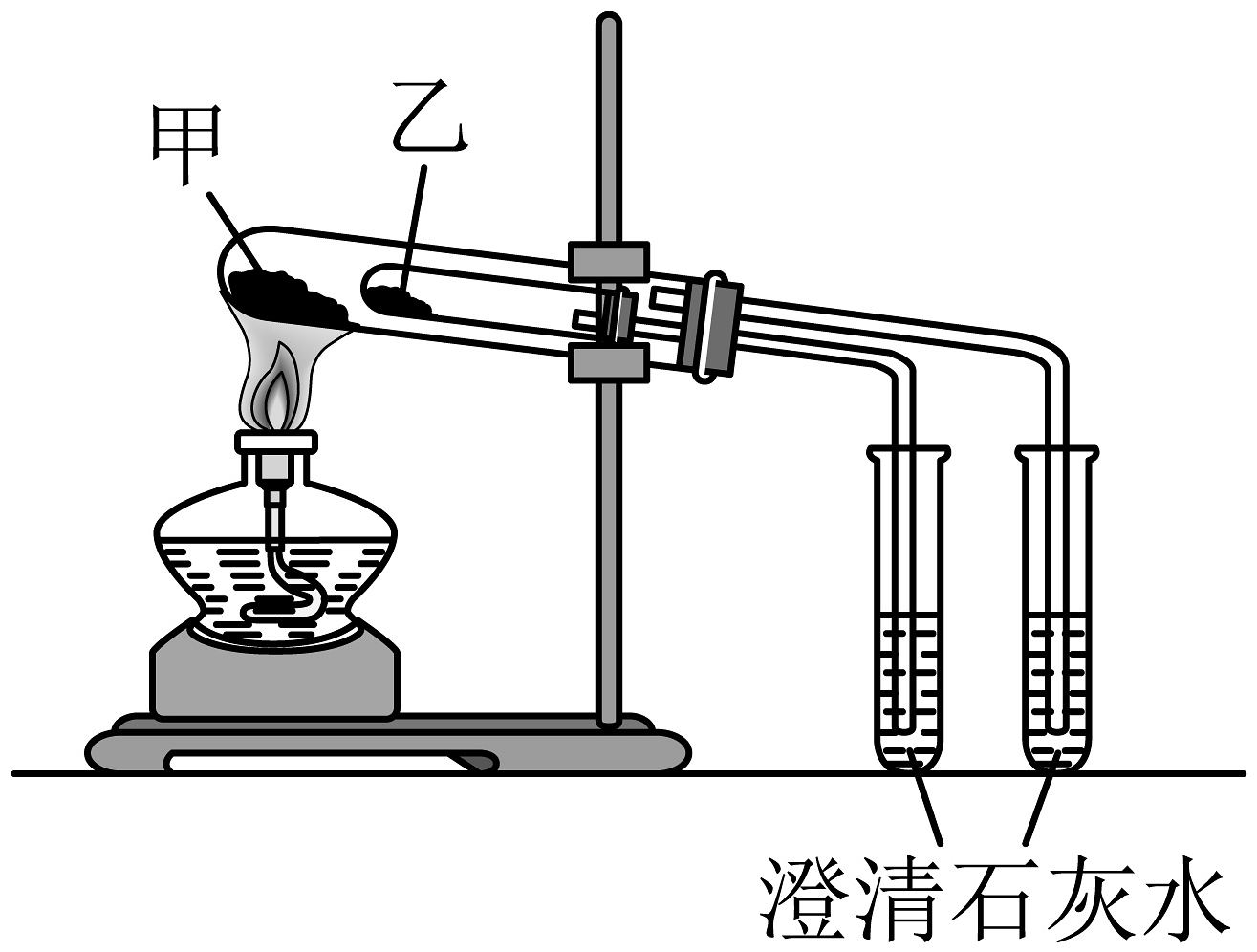 (4)、向滴入酚酞的D溶液中滴入少量稀盐酸,现象是没有气泡生成,溶液 , 反应的离子方程式为 , 继续滴加盐酸至过量,现象是。(5)、将一定量的B投入含有下列离子的溶液中:、、、 , 反应完毕后溶液中上述离子数目明显增多的有(填离子符号)。
(4)、向滴入酚酞的D溶液中滴入少量稀盐酸,现象是没有气泡生成,溶液 , 反应的离子方程式为 , 继续滴加盐酸至过量,现象是。(5)、将一定量的B投入含有下列离子的溶液中:、、、 , 反应完毕后溶液中上述离子数目明显增多的有(填离子符号)。