相关试卷
-
1、实验室以苯甲醛为原料制备间溴苯甲醛的反应如下:

已知:①温度过高,间溴苯甲醛易被氧化。
②溴、苯甲醛、1,2-二氯乙烷、间溴苯甲醛的沸点及相对分子质量见下表:
物质
溴
苯甲醛
1,2-二氯乙烷
间溴苯甲醛
沸点/℃
58.8
179
83.5
229
相对分子质量
160
106
99
185
步骤1:将一定配比的无水、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后装入三颈烧瓶(如图所示),缓慢滴加足量经浓硫酸干燥过的液溴,控温反应一段时间,冷却。

步骤2:将反应后的混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机层用溶液洗涤。
步骤3:向经洗涤的有机层加入适量无水固体,放置一段时间后过滤出晶体。
步骤4:分离有机层,减压蒸馏有机相,收集相应馏分。
(1)、实验装置中盛装液溴的仪器名称是 , 锥形瓶中的试剂为(填化学式)溶液,其作用为。(2)、步骤1反应过程中,为提高原料利用率,适宜的温度范围为____(填字母)。A、>229℃ B、58.8~179℃ C、<58.8℃(3)、有同学建议将装置中温度计换成搅拌器,那么温度计应移到(填位置)。(4)、步骤2中用溶液洗涤,是为了除去溶于有机层的(填化学式)。(5)、步骤4中采用减压蒸馏技术,其目的是。(6)、若实验结束后得到3.7g间溴苯甲醛。则本实验中间溴苯甲醛产率为。 -
2、纳米氧化锌是一种新型无机功能材料。以氧化锌烟灰(含及少量、、、)为原料制备纳米氧化锌的工艺流程如下:
 (1)、“浸取”时盐酸不宜过量太多的原因有。(2)、“氧化除杂”所得“滤渣1”的成分含和。
(1)、“浸取”时盐酸不宜过量太多的原因有。(2)、“氧化除杂”所得“滤渣1”的成分含和。①与发生反应的离子方程式为。
②判断该步骤已完成的现象是。
(3)、写出除铜过程中发生的离子反应方程式。(4)、晶体有立方和六方两种晶型,晶胞结构如题图1所示。下列关于两种晶胞的说法正确的有____(填标号)。 A、立方硫化锌中与最近的有12个 B、都与4个紧邻 C、1个晶胞都含有4个(5)、“沉锌”得到碱式碳酸锌,化学式为。
A、立方硫化锌中与最近的有12个 B、都与4个紧邻 C、1个晶胞都含有4个(5)、“沉锌”得到碱式碳酸锌,化学式为。①“沉锌”的离子方程式为。
②碱式碳酸锌加热升温过程中固体的质量变化如图-2所示。350℃时,剩余固体中已不含碳元素,此时剩余固体的成分及物质的量之比是。

-
3、某废水处理过程中始终保持 , 通过调节使和形成硫化物而分离,体系中与关系如下图所示,c为、、和的浓度,单位为。已知:。下列说法正确的是( )
 A、④为与的关系曲线 B、 C、p点生成的沉淀中含有和 D、
A、④为与的关系曲线 B、 C、p点生成的沉淀中含有和 D、 -
4、与催化重整生成和 , 可减少温室气体排放,同时得到高热值的燃料。重整时涉及的主要反应如下:①;②。在恒压密闭容器中,起始时通入 , 实验测得和的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )
 A、曲线A表示的平衡转化率随温度的变化 B、若压强恒为 , 则800K时反应②的压强平衡常数 C、X点时,对于反应②有: D、若在恒压、绝热容器中进行反应,反应达平衡时充入 , 达新平衡后保持不变
A、曲线A表示的平衡转化率随温度的变化 B、若压强恒为 , 则800K时反应②的压强平衡常数 C、X点时,对于反应②有: D、若在恒压、绝热容器中进行反应,反应达平衡时充入 , 达新平衡后保持不变 -
5、中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如图甲,电池的工作原理如图乙。下列有关说法正确的是( )
 A、放电时,纸张中的纤维素作为锂电池的负极 B、充电时,若阳极放出 , 则有回到电源正极 C、开关K闭合给锂电池充电,X对应充电电极上的反应为 D、放电时,由正极经过有机电解质溶液移向负极
A、放电时,纸张中的纤维素作为锂电池的负极 B、充电时,若阳极放出 , 则有回到电源正极 C、开关K闭合给锂电池充电,X对应充电电极上的反应为 D、放电时,由正极经过有机电解质溶液移向负极 -
6、丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化,*表示吸附在催化剂表面的物种。下列有关说法正确的是( )
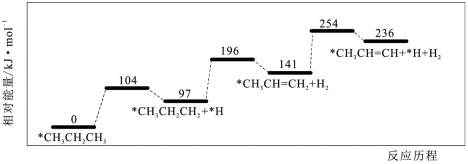 A、1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和 B、在该条件下,所得丙烯中不含其它有机物 C、该过程中发生了碳碳键的断裂与形成 D、相同条件下在该催化剂表面,比脱氢更困难
A、1mol丙烷中的总键能大于1mol丙烯及1mol氢气的总键能之和 B、在该条件下,所得丙烯中不含其它有机物 C、该过程中发生了碳碳键的断裂与形成 D、相同条件下在该催化剂表面,比脱氢更困难 -
7、聚合硫酸铁(SPFS)是水处理中重要的絮凝剂,SPFS可以表示为。下图是以废铁屑为原料制备SPFS的一种工艺流程,下列说法错误的是( )
 A、酸浸釜中加入的酸最好是稀硫酸 B、每生成1mol SPFS消耗 C、在聚合釜中,随着水的加入中变小 D、减压蒸发的优点是蒸发温度低,SPFS不易分解
A、酸浸釜中加入的酸最好是稀硫酸 B、每生成1mol SPFS消耗 C、在聚合釜中,随着水的加入中变小 D、减压蒸发的优点是蒸发温度低,SPFS不易分解 -
8、短周期主族元素X、Y、Z、W、M的原子序数依次增大,这五种元素组成一种常用的增味剂T,其结构如图所示。下列叙述正确的是( )
 A、、的键角相等 B、简单氢化物的沸点:W>Y>Z C、第一电离能:Y<Z<W D、工业上电解熔融制备单质M
A、、的键角相等 B、简单氢化物的沸点:W>Y>Z C、第一电离能:Y<Z<W D、工业上电解熔融制备单质M -
9、某同学在实验室探究的性质:常温下,配制溶液,测得其为9.7;取少量该溶液滴加溶液至 , 滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是( )A、溶液呈碱性的原因是的水解程度大于电离程度 B、加入促进了的电离 C、反应的离子方程式是 D、反应后的溶液中存在:
-
10、酚酞是一种常见的酸碱指示剂,其分子结构如图所示。下列说法不正确的是( )
 A、酚酞的分子式为 B、酚酞分子中不存在手性碳,并且分子中所有碳原子不可能共平面 C、1mol酚酞与浓溴水反应,最多可消耗 D、1mol酚酞与溶液反应,最多可消耗
A、酚酞的分子式为 B、酚酞分子中不存在手性碳,并且分子中所有碳原子不可能共平面 C、1mol酚酞与浓溴水反应,最多可消耗 D、1mol酚酞与溶液反应,最多可消耗 -
11、一种利用磁铁矿()制备铁红的流程如下:

下列说法正确的是( )
A、往滤液A中滴加少量酸性溶液,可观察到紫红色褪去 B、可以用溶液和氯水检验滤液A中是否有 C、在空气中煅烧的反应方程式为 D、最终得到铁红中的元素的质量小于原磁铁矿中的元素的质量 -
12、下列过程对应的离子反应方程式书写正确的是( )A、溶液与过量澄清石灰水混合: B、向明矾溶液中通入过量氨气: C、用稀硝酸洗涤试管内壁的银镜: D、向溶液中加入少量溶液:
-
13、下列除杂试剂及除杂方法错误的是( )
选项
物质(括号内为杂质)
除杂试剂
除杂方法
A
饱和溶液
洗气
B
——
加热、灼烧
C
盐酸
过滤
D
——
A、A B、B C、C D、D -
14、下列化学用语或图示表达正确的是( )A、乙烯分子中的键:
 B、中C原子最高能级的电子云轮廓图
B、中C原子最高能级的电子云轮廓图 C、的VSEPR模型:
C、的VSEPR模型: D、的电子式可以表示为
D、的电子式可以表示为
-
15、下列生活中的现象与物质结构关联不正确的是( )A、焰色试验与电子跃迁有关 B、植物油加氢制硬化油与植物油中含有酯基有关 C、橡胶老化与碳碳双键有关 D、金属可加工成各种形状与金属键有关
-
16、化学与生活密切相关。下列叙述错误的是( )A、二甲苯可作油漆的清洗剂 B、聚乙炔可用于制备优良的绝缘高分子材料 C、天然气作为化工原料可用于制备甲醇和氨 D、含增塑剂的聚氯乙烯(PVC)薄膜不能用来生产食品包装材料
-
17、磷酸二氢钾(KH2PO4)在医药、农药、食品、工业上均有广泛应用。工业上以氟磷灰石[主要成分为CaF(PO4)3 , 含SiO2等杂质]制备KH2PO4的工艺流程如图1所示:

图1
已知:25℃时,;;。
回答下列问题:
(1)、酸浸时加入的两种酸均过量,滤渣1不含CaF2 , 则滤渣1的主要成分为;生成的HF与SiO2反应生成二元强酸H2SiF6 , 反应的离子方程式为。(2)、脱氟1的主要目的是脱去 , 试剂X选用Na2CO3而不是BaCO3的原因为;加入的Na2CO3与溶液中的物质的量相等时,溶液中mol·L-1。电解制备KH2PO4装置示意图如图2所示。
图2
(3)、膜a为(填“负离子”或“正离子”)交换膜。(4)、阴极电极反应式为;电路中每通过1mol电子,产品室中理论上生成产品的质量为g。常温下,中和制备KH2PO4时,溶液中含磷粒子分布分数(平衡时某粒子浓度占各粒子浓度之和的分数)与pH关系如图3所示。

图3
(5)、pH=4.2时,溶液中。(6)、0.1mol·L-1KH2PO4溶液中,含磷粒子的浓度大小关系为。 -
18、甲醇是一种理想的储氢载体,我国科学家研发的全球首套太阳能燃料合成项目被称为“液态阳光”计划,可利用太阳能电解水产生H,再将CO2与H2转化为甲醇,以实现碳中和。在2L恒容密闭容器中充入2molCO2和nmolH2 , 在一定条件下发生反应:
CO2的转化率与温度、投料比的关系如下图所示。
 (1)、若从反应开始到A点需要10s,则mol·L-1·s-1。(2)、根据图象判断(填“>”、“<”或“=”,下同),该反应的焓变△H0,平衡常数。(3)、若在500K时,按投料,在恒压下进行,达到平衡状态,此时CO2的转化率(填“>”、“<”或“=”)75%。(4)、该反应的平衡常数表达式为。
(1)、若从反应开始到A点需要10s,则mol·L-1·s-1。(2)、根据图象判断(填“>”、“<”或“=”,下同),该反应的焓变△H0,平衡常数。(3)、若在500K时,按投料,在恒压下进行,达到平衡状态,此时CO2的转化率(填“>”、“<”或“=”)75%。(4)、该反应的平衡常数表达式为。若 , 保持CO2投料为2mol不变,则B点的(填数值)。
-
19、将纯铁片和纯铜片按图甲、乙方式插入100mL相同浓度的稀硫酸中一段时间,回答下列问题:
 (1)、下列说法正确的是____。A、甲中铜片质量减少、乙中铁片质量减少 B、甲、乙均为化学能转变为电能的装置 C、乙中铜片上产生气泡 D、甲、乙两烧杯中均减小(2)、在相同时间内,两烧杯中产生气泡的速度:甲乙(填“>”、“<”或“=”)。(3)、请写出甲、乙中构成原电池的正极电极反应式:。电池工作时,溶液中向极(填“正”或“负”移动。当甲中溶液质量增重27g时,电极上转移电子数目为。(4)、下图各烧杯中盛有海水,铁在其中被腐蚀
(1)、下列说法正确的是____。A、甲中铜片质量减少、乙中铁片质量减少 B、甲、乙均为化学能转变为电能的装置 C、乙中铜片上产生气泡 D、甲、乙两烧杯中均减小(2)、在相同时间内,两烧杯中产生气泡的速度:甲乙(填“>”、“<”或“=”)。(3)、请写出甲、乙中构成原电池的正极电极反应式:。电池工作时,溶液中向极(填“正”或“负”移动。当甲中溶液质量增重27g时,电极上转移电子数目为。(4)、下图各烧杯中盛有海水,铁在其中被腐蚀
铁腐蚀的速率由大到小的顺序为。 (5)、为了降低某水库的铁闸门被腐蚀的速率,可以在铁闸门上焊接金属。(6)、如图所示,该装置通电5min后,电极5的质量增加,回答下列问题:
(5)、为了降低某水库的铁闸门被腐蚀的速率,可以在铁闸门上焊接金属。(6)、如图所示,该装置通电5min后,电极5的质量增加,回答下列问题:
电源:a是极。 (7)、A池阳极的产物为:。(8)、中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇(CH3OH)燃料电池的工作原理如图所示。
(7)、A池阳极的产物为:。(8)、中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,甲醇(CH3OH)燃料电池的工作原理如图所示。
该电池工作时,c入口处对应的电极为极。该电池负极的电极反应式为。
-
20、人们应用原电池原理制作了多种电池以满足不同的需要。在现代生活、生产和科学技术发展中,电池发挥着越来越重要的作用。(1)、配平下列离子方程式。
I-+H+=Cl-+I2+H2O
(2)、直接提供电能的反应一般是放热反应,下列反应能设计成电池的是____。A、与NH4Cl反应 B、H2与Cl2燃烧反应 C、灼热的炭与CO2反应 D、氢氧化钠与稀盐酸反应