相关试卷
-
1、二氧化碳的捕集、利用与封存已成为我国能源领域的一个重要战略方向。
已知:相关物质的燃烧热如表。
名称
化学式(状态)
△H/()
氢气
(g)
-285.8
乙烯
(g)
-1411.0
(1)、请写出表示(g)燃烧热的热化学方程式:; 。(2)、恒温条件下,向容积为1L的恒容密闭容器中,充入1mol和3mol , 发生反应:。反应过程中部分物质的物质的量浓度随时间变化如图。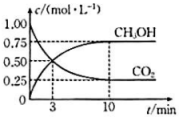
①3min时,(填“>”“<”或“=”);0~3min内,氢气的平均反应速率为。
②10min时,的转化[]为 , 此时容器中。
③10min时,容器内压强与反应起始时容器内压强之比为。
-
2、在无水三氯化铝的催化作用下,利用乙醇制备乙烯的反应温度是120℃。某兴趣小组设计实验,合成无水并完成乙烯的制备及收集。
Ⅰ.无水的制备[氯化铝遇水极易发生反应生成和HCl]:
 (1)、装置B的作用为 , 硬质玻璃管直接接入收集器的优点是;装置F的作用是。(2)、Ⅱ.乙烯的制备:
(1)、装置B的作用为 , 硬质玻璃管直接接入收集器的优点是;装置F的作用是。(2)、Ⅱ.乙烯的制备:
实验操作:检验装置气密性后,在圆底烧瓶中加入5g无水三氯化铝和10mL,无水乙醇,点燃酒精灯。
盛装无水乙醇的仪器名称为 , 加入药品后,开始实验前,应先打开止水夹(填“1”“2”或“1和2”),反应进行一段时间后,当观察到(描述现象),再关闭该止水夹。
(3)、装置D中球形于燥管的作用是;D中发生反应的化学方程式为。 -
3、下列情境中的实验方案、现象及结论均正确的是( )
选项
方案
现象
结论
A
向淀粉溶液中滴加稀硫酸,水浴加热,加入新制
溶液变蓝
淀粉没有发生水解
B
常温下,将Cu片加入盛有浓的试管中
无明显现象
常温下,Cu在浓中发生钝化
C
向a试管中加入2mL5%的溶液和2滴1溶液,向b试管中加入2mL3%的溶液
试管a中反应更剧烈
可以加快的分解
D
用电流表测试由Mg、Al、稀硫酸构成的简易电池
铝片上产生大量气泡
铝片作正极
A、A B、B C、C D、D -
4、设为阿伏加德罗常数的值。下列说法正确的是( )A、一定条件下,0.1mol和0.15mol充分反应,转移的电子总数为0.6 B、常温常压下,11.2L中含有的C—H键的数目为3 C、标准状况下,22.4L与足量氯气完全反应,生成的数目为0.1 D、常温下,100g质量分数为46%的乙醇溶液中,氧原子数目为4
-
5、某温度下,在2L恒容密闭容器中加入4molX,发生反应 , 据如表所示。下列说法正确的是( )
时间段
0~20s
0~40s
0~60s
v(Z)/()
0.12
0.075
0.05
A、第10s时,Y的浓度等于0.4 B、0~40s内,用X表示的平均速率为0.05 C、反应到40s时,已经达到化学平衡状态 D、容器内气体Y的体积分数不再变化时,达到化学反应的限度 -
6、某电池的工作原理如图(阴离子交换膜只允许阴离子通过),该电池的总反应为 , 下列说法错误的是( )
 A、石墨为电池的正极 B、电路中电子的流向:Zn→电流表→石墨→阴离子交换膜→Zn C、反应一段时间,阴离子交换膜左侧浓度降低 D、Zn极上的电极反应为
A、石墨为电池的正极 B、电路中电子的流向:Zn→电流表→石墨→阴离子交换膜→Zn C、反应一段时间,阴离子交换膜左侧浓度降低 D、Zn极上的电极反应为 -
7、下列反应的离子方程式书写正确的是( )A、向溶液中滴入足量稀盐酸: B、将金属Na加入水中: C、向溶液中加入过量的氨水: D、向漂白粉的溶液中通入过量:
-
8、某有机物的结构如图所示,下列有关判断正确的是( )
 A、该有机物中含有3种官能团 B、该有机物分子式为 C、该有机物不能发生取代反应 D、该有机物能使酸性高锰酸钾溶液褪色
A、该有机物中含有3种官能团 B、该有机物分子式为 C、该有机物不能发生取代反应 D、该有机物能使酸性高锰酸钾溶液褪色 -
9、矿物M中含有原子序数依次增大且均不大于20的X、Y、Z、W、E五种主族元素,X、W为同主族非金属元素,Y、Z、E为金属元素,Z的最高正化合价为+2价,Z和E同主族。下列说法错误的是( )A、最简单气态氢化物的稳定性:W<X B、简单离子半径:X>Y>Z C、最高价氧化物对应的水化物的碱性:Z<E D、X和Y形成的离子化合物中不可能含共价键
-
10、下列有关化学品的合理使用的说法正确的是( )A、处方药需要凭医生处方购买,其包装上有OTC标识 B、亚硝酸钠是一种防腐剂和护色剂,可用于腊肉、香肠的生产 C、超量使用食品添加剂能有效增强食品的营养,不影响身体健康 D、一次忘记服药,下次可以增加一倍剂量服用
-
11、下列所示的四个图像中,能正确反映对应变化关系的是( )




A.盐酸与小苏打反应过程中的能量变化
B.Mg条与盐酸反应过程中的生成速率随时间的变化
C.向20mL的饱和溶液中加入一定量的CaO,溶液中溶质的浓度随时间t的变化曲线
D.常温下,铁片、铜片插入浓中形成的原电池电流强度(I)随时间(t)的变化
A、A B、B C、C D、D -
12、下列说法错误的是( )A、分子式为和的烃一定互为同系物 B、光照条件下,等物质的量的甲烷与氯气反应的有机产物有4种 C、等质量的乙烯和聚乙烯完全燃烧,消耗氧气的质量相同 D、蛋白质和纤维素均为天然高分子,二者完全燃烧的产物相同
-
13、如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则下列液体A和气体B的组合不可能的是( )
 A、NaOH溶液、 B、稀硫酸、空气 C、、 D、NaOH溶液、NO
A、NaOH溶液、 B、稀硫酸、空气 C、、 D、NaOH溶液、NO -
14、下列实验选用的试剂或进行的操作正确的是( )A、检验:将气体通入溶液中 B、检验:先加稀硝酸,再加溶液 C、检验NO:在空气中移开集气瓶上的玻璃片 D、检验:加入苛性钠溶液,将湿润的蓝色石蕊试纸放在试管口检验
-
15、下列反应与对应的反应类型不符的是( )A、乙烷在氧气中燃烧——氧化反应 B、乙烯制乙醇——取代反应 C、丙烯制聚丙烯——加聚反应 D、植物油制氢化植物油——加成反应
-
16、下列化学用语表示正确的是( )A、硫离子的结构示意图为
 B、乙烯的结构简式为
C、羟基的电子式为
B、乙烯的结构简式为
C、羟基的电子式为 D、HClO的结构式为H—Cl—O
D、HClO的结构式为H—Cl—O
-
17、《天工开物》中记载金属锌的冶炼方法:“每炉甘石()十斤,装载入一泥罐内,……逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。冷定,毁罐取出每十耗去其二,即倭铅(金属锌)也。”该冶炼方法属于( )A、热还原法 B、电解法 C、热分解法 D、湿法冶金
-
18、肉桂硫胺(M)是抗击新型冠状病毒的潜在用药,其合成路线如下:

已知:Ⅰ.

Ⅱ.
 (1)、A中官能团的名称为。(2)、下列说法正确的是____。A、M的分子式为 B、反应A->B的条件是NaOH水溶液,加热. C、反应E-→F中苯的作用是溶剂 D、F中最多有18个原子共平面(3)、G-→H的反应方程式为。(4)、写出2种符合下列条件的E的同分异构体。
(1)、A中官能团的名称为。(2)、下列说法正确的是____。A、M的分子式为 B、反应A->B的条件是NaOH水溶液,加热. C、反应E-→F中苯的作用是溶剂 D、F中最多有18个原子共平面(3)、G-→H的反应方程式为。(4)、写出2种符合下列条件的E的同分异构体。a.具有两个取代基的芳香族化合物.
b.能水解,水解产物遇到溶液显紫色
c.核磁共振氢谱显示苯环上有4种化学环境的氢
(5)、乙酰苯胺结构为( )。参照上述合成路线和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)已知:
)。参照上述合成路线和下面的信息,设计一条由苯和乙酸为起始原料制备乙酰苯胺的合成路线。(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)已知: -
19、碘化锡()是一种非极性分子,主要用于制造有机锡配合物。某小组利用单质锡和碘制备碘化锡,其主要实验流程如下(反应装置见下图,夹持仪器略去);

已知:
①无水碘化锡为橙红色立方晶体,受潮易水解,熔点145.7℃,沸点364.5℃。
②碘化锡在丙酮和热的石油醚中溶解度较大,在冷的石油醚中溶解度小。
③石油醚的沸点为60~90℃,碘单质的升华温度为45~77℃。

请回答:
(1)、反应装置中仪器A的名称是。(2)、下列说法不正确的是____。A、将锡片剪成细小碎片、碘磨细的原因是增大接触面积、提高反应速率 B、步骤II可以不转移反应液,直接在原反应装置(圆底烧瓶)中进行后续操作 C、步骤II,圆底烧瓶中还附着四碘化锡晶体,可用热的石油醚洗涤内壁,一起转移到小烧杯中 D、步骤IV采用蒸发结晶比冷却结晶更好(3)、产品可以进乙步采用重结晶法提纯。请从下列选项中选择最佳选项并进行排序。取碘化锡样品放入烧杯中→→→a.加入适量的热水 b.加入适量的热的石油醚
c.用冷水浴冷却结晶 d.趁热过滤
e.加入适量的冷的石油醚
(4)、实验结果得到碘化锡产品25.08g,此次实验的实际产率为(保留一位小数)。(5)、经测定,查阅文献发现,用乙酸代替石油醚作反应溶剂能得到更高的产率,但需将锡粒处理为极碎的锡箔,若仍然用锡粒,反应引发后很容易停止。产生这种现象的原因是。 -
20、将转化成可利用的化学能源的“负碳”技术是减少碳排放的重要途径。
方法I:二氧化碳催化加氢制甲醇。该反应一般认为通过如下步骤来实现:
①
②
(1)、总反应的;(2)、反应①的平衡常数为 , 反应②的平衡常数为 , 则总反应的平衡常数为(用含、的式子表示)。(3)、下列关于二氧化碳加氢制甲醇的说法不正确的是____。A、图1中能正确反映总反应平衡常数K随温度变化关系的曲线为a B、体系中的平衡转化率(a)与温度和压强的关系如图2所示,则压强最大的为 C、反应达平衡后,在恒温恒容条件下充入一定量的 , 体系压强增大,反应速率加快 D、选择合适的催化剂能提高的平衡转化率 (4)、方法II:电解法制甲醇。利用电解原理,可将转化为 , 其装置如图3所示:
(4)、方法II:电解法制甲醇。利用电解原理,可将转化为 , 其装置如图3所示:
电极上电极反应方程式:。
(5)、方法III:超干重整得到的CO经偶联反应可制得(草酸)。在水溶液中、和物质的量分数pH关系如图4所示,则c点(1、3两条线的交点)溶液。