相关试卷
-
1、已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,在酸性溶液中的还原性顺序为:SO2>I->Fe2+>H2O2>Cl- , 则下列反应不可能发生的是A、2Fe3++SO2+2H2O=2Fe2++SO+4H+ B、2Fe2++I2=2Fe3++2I- C、I2+SO2+2H2O=H2SO4+2HI D、H2O2+SO2=H2SO4
-
2、青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:

下列有关此工艺操作不正确的是
A、破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率 B、操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯 C、操作II是蒸馏,利用了乙醚与青蒿素的沸点相差较大 D、操作III的主要过程加水溶解,蒸发浓缩、冷却结晶、过滤 -
3、如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(式中为阿伏加德罗常数)A、 B、 C、 D、
-
4、下列图示实验装置和原理能达到实验目的的是
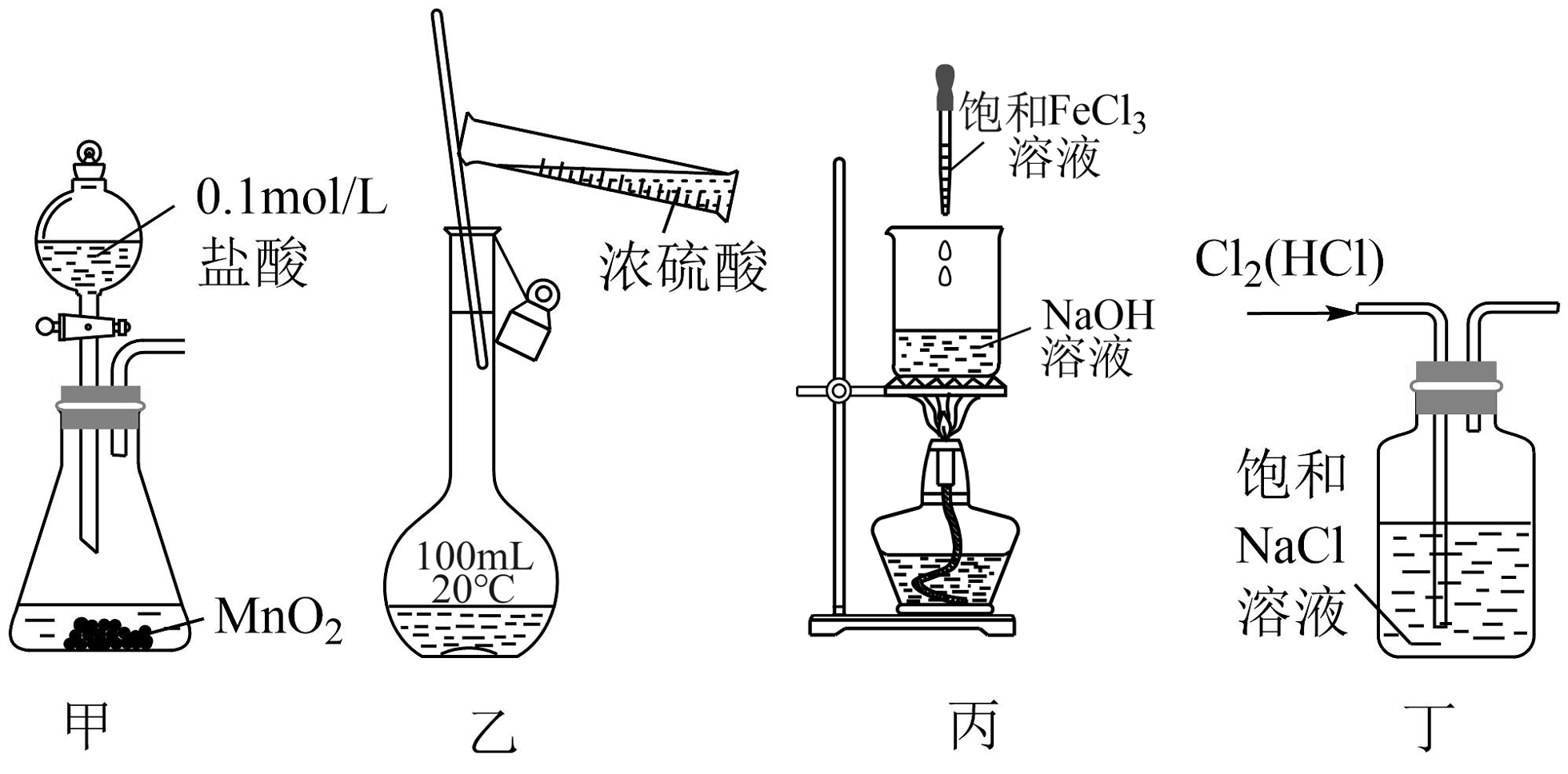 A、装置甲:实验室制取少量Cl2 B、装置乙:用浓硫酸配制一定物质的量浓度的稀硫酸 C、装置丙:制备氢氧化铁胶体 D、装置丁:除去氯气中混有的少量HCl
A、装置甲:实验室制取少量Cl2 B、装置乙:用浓硫酸配制一定物质的量浓度的稀硫酸 C、装置丙:制备氢氧化铁胶体 D、装置丁:除去氯气中混有的少量HCl -
5、下列关于Na2CO3和NaHCO3的性质说法正确的是A、碳酸氢钠晶体中加少量水会溶解,并伴有放热现象 B、碳酸钠溶液中逐滴滴加稀盐酸,开始无明显现象,一段时间后产生大量气泡 C、等物质的量的碳酸钠和碳酸氢钠固体分别与足量盐酸反应,相同条件下产生CO2体积后者多 D、可用澄清石灰水鉴别Na2CO3和NaHCO3溶液
-
6、
将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一,煤转化为水煤气的主要化学反应为:。C(s)、CO(g)和完全燃烧的热化学方程式分别为:
① ;
② ;
③ 。
试回答:
(1)请你根据以上数据,写出C(s)与水蒸气反应生成CO和的热化学方程式:。(2)比较反应热数据可知,和完全燃烧放出的热量之和,比完全燃烧放出的热量(填“多”或“少”)。甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图
 (3)请你写出、、、之间存在的关系式。(4)乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是。
(3)请你写出、、、之间存在的关系式。(4)乙同学据此认为:“将煤转化为水煤气再燃烧放出的热量,最多与直接燃烧煤放出的热量相同。”请分析:甲、乙两同学的观点正确的是(填“甲”或“乙”)同学,另一同学出现错误观点的原因是。 -
7、超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为: , 下列说法正确的是A、AlN是氧化产物 B、C在反应中被还原 C、Al2O3在反应中得到电子 D、生成1mol AlN时,转移3mol电子
-
8、如图所示为氟利昂破坏臭氧层的过程,下列说法不正确的是
 A、过程Ⅳ中既有极性共价键的断裂又有非极性共价键的形成 B、整个过程可用方程式表示为 C、的电子式为
A、过程Ⅳ中既有极性共价键的断裂又有非极性共价键的形成 B、整个过程可用方程式表示为 C、的电子式为 D、上述过程说明氟利昂产生的氯原子是破坏臭氧层的催化剂
D、上述过程说明氟利昂产生的氯原子是破坏臭氧层的催化剂
-
9、已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A、a=b B、混合溶液的pH=7 C、混合溶液中,c(H+)=mol.L-1 D、混合溶液中c(H+)+c(B+)=c(OH-)+c(A-)
-
10、下列变化一定不涉及电子转移的是A、天然气燃烧 B、用生石灰干燥氢气 C、食物变质 D、KClO3分解制氧气
-
11、下列离子在指定条件下的溶液中,一定能大量共存的是A、无色澄清溶液中:K+、Fe3+、SO、Mg2+ B、使石蕊变红色的溶液中:NO、Cl-、K+、SO C、含有大量Ba2+的溶液:NH、Na+、CO、I- D、加入Na2O固体的溶液中:Ba2+、Cu2+、NO、Cl-
-
12、下列有关化学用语表述正确的是A、和离子结构示意图均可以表示为
 B、HClO的结构式: H-Cl-O
C、的电子式:
B、HClO的结构式: H-Cl-O
C、的电子式: D、用电子式表示的形成过程为
D、用电子式表示的形成过程为
-
13、有4种碳骨架如图所示的烃,下列说法正确的是
 A、a和b、d互为同分异构体 B、a和b都能发生加成反应 C、b和c互为同系物 D、只有b和c能发生取代反应
A、a和b、d互为同分异构体 B、a和b都能发生加成反应 C、b和c互为同系物 D、只有b和c能发生取代反应 -
14、实验室用等原料制取少量的实验流程如下。下列说法正确的是
 A、“熔融”时,应先将和混合加热一段时间后再加入KOH B、通入“歧化”时,氧化剂与还原剂的物质的量之比为2:1 C、“过滤”时,为加快分离速率可采用减压过滤 D、制得的粗品可能会含有 , 可以向粗品中滴加盐酸观察是否有气泡来检验是否含有
A、“熔融”时,应先将和混合加热一段时间后再加入KOH B、通入“歧化”时,氧化剂与还原剂的物质的量之比为2:1 C、“过滤”时,为加快分离速率可采用减压过滤 D、制得的粗品可能会含有 , 可以向粗品中滴加盐酸观察是否有气泡来检验是否含有 -
15、我国科学家侯德榜发明了联合制碱法。联合以氯化钠、氨及二氧化碳为原料,同时生产纯碱和氯化铵两种产品,又称“侯氏制碱法”,对世界制碱工业做出了卓越贡献。下列是“侯氏制碱法”制备纯碱的工艺流程,回答下列问题。
 (1)、纯碱的化学式为 , 他的类别是(填“单质”、“氧化物”、“酸”、“碱”或“盐”),其常见用途有。(2)、请写出“侯氏制碱法”中,往饱和食盐水中通入和发生的化学反应方程式该反应(填“属于”或“不属于”)氧化还原反应。(3)、粗盐水中含大量、、 , “除杂”时依次加入过量的、、提纯。用离子方程式说明加入的目的。(4)、若在实验室中进行“分离”操作,用到的玻璃仪器有烧杯、。(5)、循环Ⅰ中参与循环的物质是。(6)、制得的纯碱可能含少量 , 检验含有该杂质的方法及现象是。
(1)、纯碱的化学式为 , 他的类别是(填“单质”、“氧化物”、“酸”、“碱”或“盐”),其常见用途有。(2)、请写出“侯氏制碱法”中,往饱和食盐水中通入和发生的化学反应方程式该反应(填“属于”或“不属于”)氧化还原反应。(3)、粗盐水中含大量、、 , “除杂”时依次加入过量的、、提纯。用离子方程式说明加入的目的。(4)、若在实验室中进行“分离”操作,用到的玻璃仪器有烧杯、。(5)、循环Ⅰ中参与循环的物质是。(6)、制得的纯碱可能含少量 , 检验含有该杂质的方法及现象是。 -
16、数字化实验是利用传感器和信息处理终端进行数据采集与分析的实验手段。下图是利用数字化实验测定光照氯水过程中得到的图像,该图像表示的意义是
 A、氯离子浓度随时间的变化 B、氧气体积分数随时间的变化 C、氯水的pH随时间的变化 D、氯水导电能力随时间的变化
A、氯离子浓度随时间的变化 B、氧气体积分数随时间的变化 C、氯水的pH随时间的变化 D、氯水导电能力随时间的变化 -
17、下面能正确表达氧化还原反应中电子转移方向和数目的是A、
 B、
B、 C、
C、 D、
D、
-
18、
Na2FeO4具有强氧化性,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3.某化学兴趣实验小组利用如图所示实验装置用Fe(OH)3与NaClO在碱性条件下制取Na2FeO4(紫色),并验证其处理含CN-废水的能力。回答下列问题:

I.制取Na2FeO4
(1)洗气瓶B中的试剂为。装置D的作用为。
(2)大试管中反应的与被氧化的盐酸的比例为。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2.通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:、。
(4)某同学上网查阅资料得知:还可用FeSO4与Na2O2反应生成Na2FeO4、Na2SO4、Na2O和O2制备Na2FeO4.若参加反应的FeSO4与Na2O2的物质的量之比为1:3,则该反应的化学方程式为。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(5)取足量的Na2FeO4溶液加入烧瓶中,向其中加入0.2mol·L-1的NaCN溶液100mL,CN-被氧化为和N2;然后向其中加入足量稀硫酸,生成的气体通过盛有浓硫酸的洗气瓶和装有碱石灰的干燥管,碱石灰干燥管增重0.792g,则CN-的去除率为%;有同学认为这样操作有误差,使CN-的去除率偏低,其原因可能为。
-
19、恒温恒压下,在起始容积为的密闭容器中发生反应:
0
0
5
10
反应过程中的部分数据如上表。下列说法正确的是
A、容器内气体密度不变,标志着反应已达到平衡状态 B、内,用C表示的平均反应速率为 C、时,A的物质的量浓度为 D、反应达到平衡后充入少量氦气不参与反应 , 正反应速率减小,逆反应速率增大 -
20、NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图1;研究发现在催化剂上可能发生的反应过程如图2。下列说法不正确的是
 A、NH3催化还原NO为放热反应 B、过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 C、过程III的离子方程式: D、反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物
A、NH3催化还原NO为放热反应 B、过程I中NH3断裂极性键,需要吸收能量,Fe3+体现了氧化性 C、过程III的离子方程式: D、反应过程中,反应物为NH3、O2、NO,Fe3+、Fe2+为中间产物