-
1、化学反应有多种类别。化合反应、分解反应、氧化反应的关系可用如图表示,其中b处表示的反应既属于化合反应,又属于氧化反应。现有反应:甲烷+氧气二氧化碳+水,则此反应应该填充到
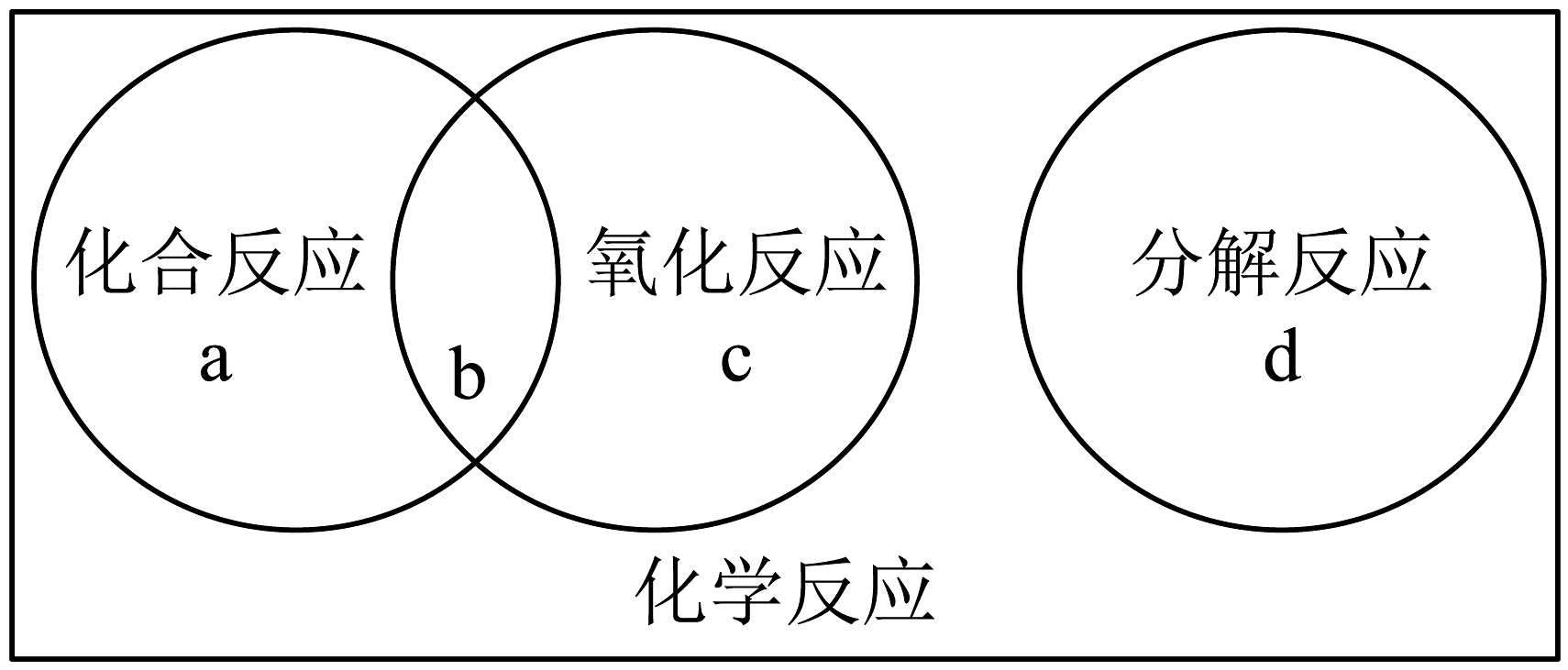 A、a处 B、b处 C、c处 D、d处
A、a处 B、b处 C、c处 D、d处 -
2、下图是氧化汞分解的微观示意图。下列根据图示的有关叙述中,正确的是
 A、反应中,发生变化的是汞原子和氧原子 B、反应中,氧化汞分子可以再分,汞原子、氧原子不能再分 C、氧化汞是由汞和氧气组成的 D、氧化汞分子是由汞分子和氧分子构成的
A、反应中,发生变化的是汞原子和氧原子 B、反应中,氧化汞分子可以再分,汞原子、氧原子不能再分 C、氧化汞是由汞和氧气组成的 D、氧化汞分子是由汞分子和氧分子构成的 -
3、拉瓦锡用定量的方法研究了空气的成分。某兴趣小组利用氧气传感器来检测足量红磷燃烧过程中氧气的含量,如图所示,下列判断正确的是
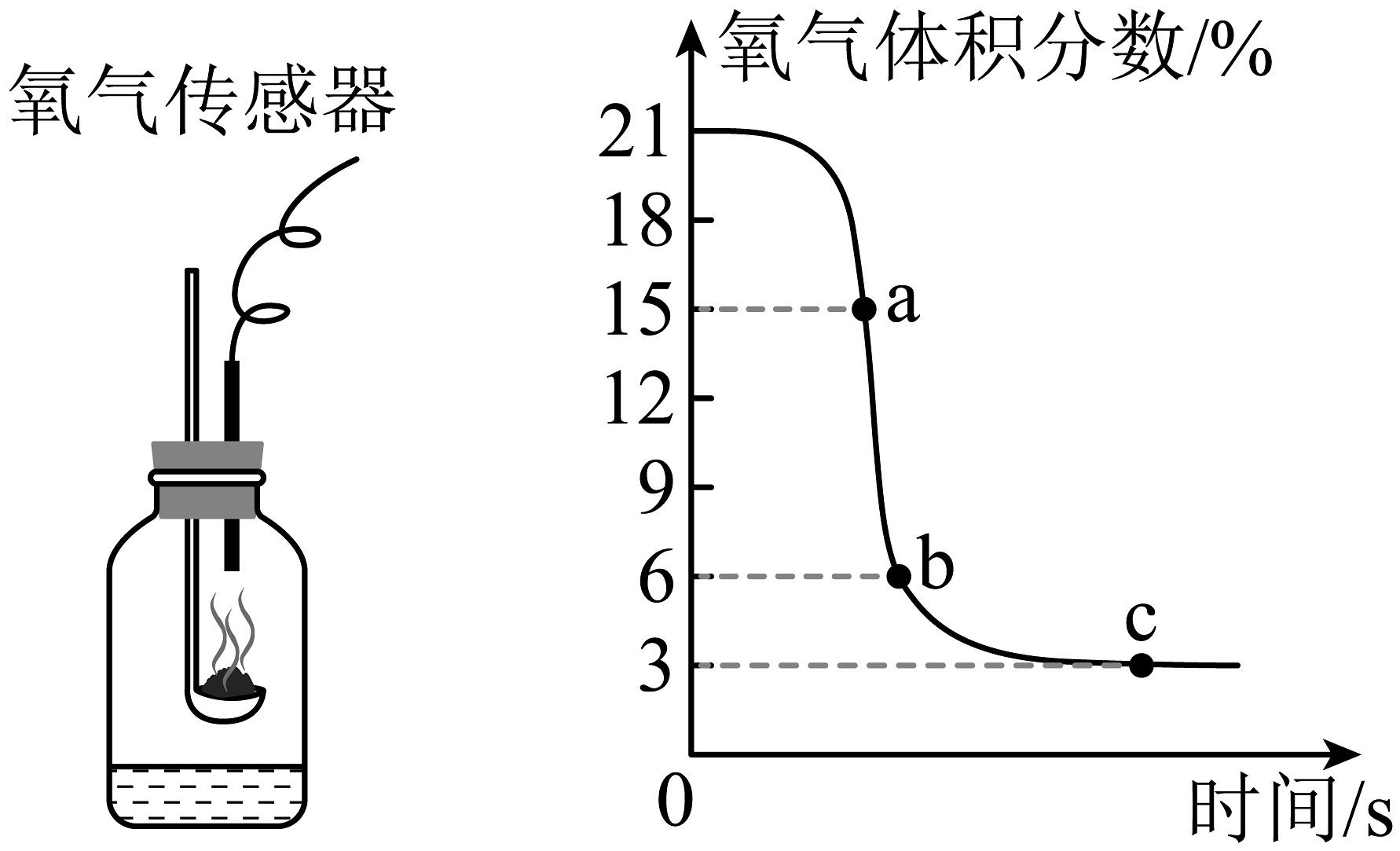 A、a点时,容器内氮气体积分数为85% B、将红磷换成木炭也能得到相似的实验数据 C、氧气有剩余,说明物质燃烧时氧气必须达到一定浓度 D、此实验测得空气中氧气的质量分数为18%
A、a点时,容器内氮气体积分数为85% B、将红磷换成木炭也能得到相似的实验数据 C、氧气有剩余,说明物质燃烧时氧气必须达到一定浓度 D、此实验测得空气中氧气的质量分数为18% -
4、下列物质燃烧的实验现象描述正确的是A、蜡烛燃烧产生黄色火焰,冒白烟 B、硫在氧气中燃烧后生成有刺激性气味的气体 C、铁丝在空气中燃烧时,火星四射,生成黑色固体 D、木炭在氧气中剧烈燃烧,发出白光,生成二氧化碳
-
5、
某实践活动小组在老师带领下,对空气质量检测等开展了一系列项目式学习活动。
活动一:了解空气质量指数所表示的含义
【思考分析】

(1)图1是该小组所在地区某日的空气质量情况,其空气质量状况为(填“优”“良”或“轻度污染”)。
活动二:认识微型空气质量“检测站”
【查询网络】微型空气质量检测系统可实时、准确地检测室外空气污染物、其结构如图2所示。
(2)太阳能板工作时发生的能量转化是。
活动三:调查微型空气质量“检测站”
观察并记录某段时间显示的数据如下表
二氧化氮
臭氧
一氧化碳
22
158
1.3
(3)除显示器显示的内容外,还需要检测的空气污染物有(写一种)。
活动四:进行实践
同学们对工厂附近的空气质量感到好奇,调研发现该工厂为了获得充足的能量。长期采用燃煤技术。于是同学们猜测该工厂排放的废气中含有二氧化硫。
【查阅资料】二氧化硫是有刺激性气味的气体,能使澄清石灰水变浑浊,也能使品红溶液褪色。
(4)设计并进行实验
实验操作
实验现象
实验结论
收集一瓶该工厂的废气,加入 , 振荡。
废气中含有二氧化硫
活动五:提出空气质量改进方案
(5)为了保护人类赖以生存的环境,我们在校园中能做什么?(写一条)。
-
6、甲醛(CH2O)是空气污染物,石墨负载MnO2催化甲醛氧化原理如图1所示:
 (1)、甲醛中碳、氧元素质量比为。图1中含氧元素质量分数最高的化合物是(填化学式)。(2)、抽取某室内空气样品2m3 , 所含甲醛充分氧化(),产生的CO2质量为0.44mg,求1m3该空气样品中甲醛的质量是多少(写出计算过程)?是否超标(最大限值为0.08mg/m3)?(3)、不同催化剂、温度对甲醛催化转化的影响如图2所示,效果最好的是(填对应曲线字母)。以单位时间内甲醛转化为CO2的百分数衡量催化转化速率,100℃时,γ-MnO2与β-MnO2催化的速率比为。
(1)、甲醛中碳、氧元素质量比为。图1中含氧元素质量分数最高的化合物是(填化学式)。(2)、抽取某室内空气样品2m3 , 所含甲醛充分氧化(),产生的CO2质量为0.44mg,求1m3该空气样品中甲醛的质量是多少(写出计算过程)?是否超标(最大限值为0.08mg/m3)?(3)、不同催化剂、温度对甲醛催化转化的影响如图2所示,效果最好的是(填对应曲线字母)。以单位时间内甲醛转化为CO2的百分数衡量催化转化速率,100℃时,γ-MnO2与β-MnO2催化的速率比为。
-
7、
兴趣小组发现实验室一片久置的铜片表面附着了一层绿色固体,通过查阅资料得知该绿色固体是铜绿[Cu2(OH)2CO3]。
(1)甲同学刮下一些铜绿进行如下探究,请完成下表:
实验装置
实验现象
实验结论

试管内壁有水雾
铜绿受热后生成
铜绿受热后生成氧化铜
气球胀大
乙同学对气球胀大的原因产生了兴趣,于是进行如下探究。
【作出猜想】
猜想Ⅰ:试管内的空气受热膨胀;
猜想Ⅱ:铜绿受热后生成二氧化碳;
猜想Ⅲ:铜绿受热后生成一氧化碳:
猜想Ⅳ:铜绿受热后生成一氧化碳和二氧化碳。
【实验与分析】
(2)熄灭酒精灯并冷却至室温后,气球仍比加热前大,证明猜想(填序号)不成立。
(3)乙同学用下图装置进行实验,发现A中 , 反应的化学方程式为 , 说明铜绿受热后生成二氧化碳;B处玻璃管内无明显现象,说明猜想(填序号,下同)不成立。
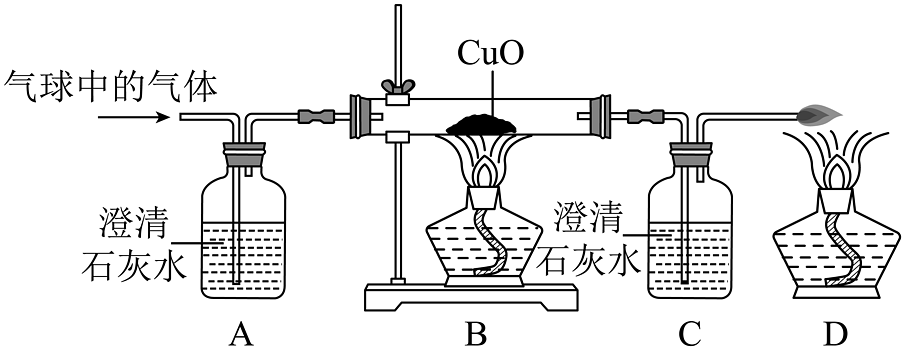
【实验结论】
(4)猜想成立。
【反思】
(5)根据铜绿的化学式可知,铜绿是铜与空气中的氧气、水和(填物质名称)共同作用形成的。
(6)丙同学认为乙同学的实验中省略A处集气瓶也能得到相同的结论,请描述与结论相对应的实验现象:。
-
8、
Ⅰ.氧气、二氧化碳制取与性质实验
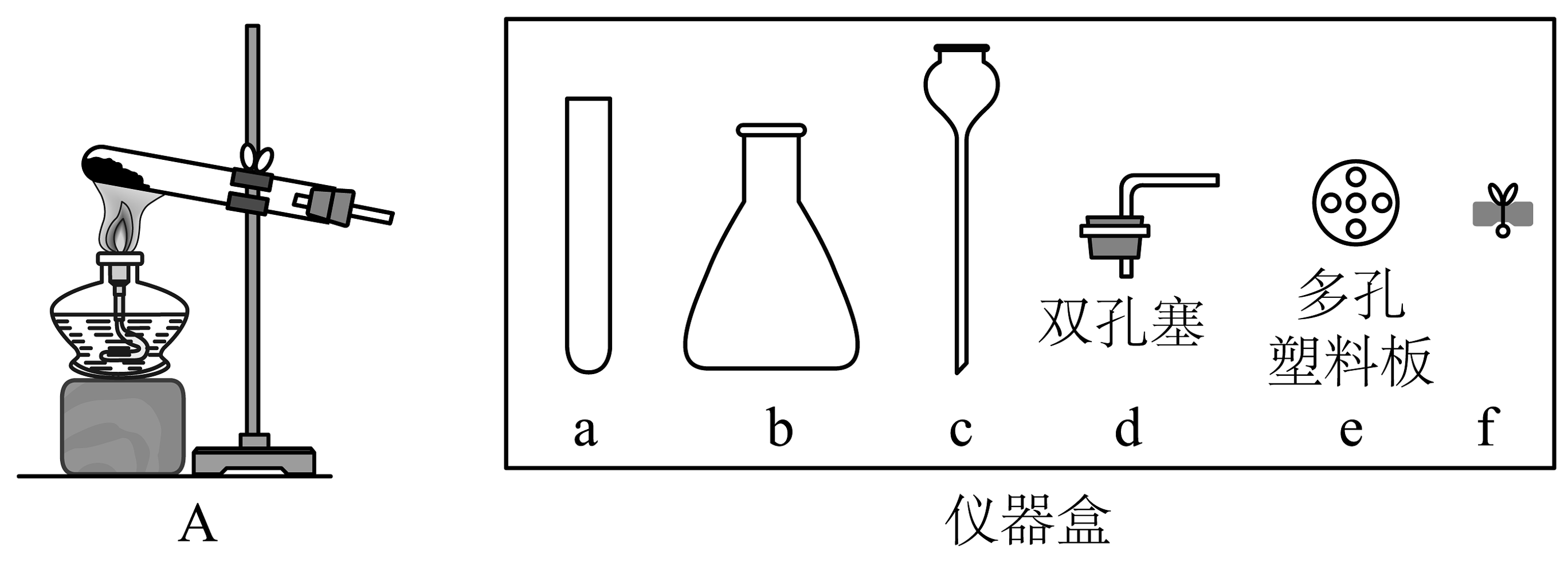
(1)用装置A(试管里装有少量高锰酸钾)制取O2的反应化学方程式是 , 试管口略向下倾斜的原因是 , 组装随开随用,随关随停制取CO2的发生装置,需选择仪器盒中的d、e和。
(2)氧气的性质实验:将装在燃烧匙的硫粉点燃,伸入集满氧气的集气瓶中,观察到硫粉燃烧,放出热量,发出火焰。硫粉燃烧生成了(填物质化学式),其中集气瓶中装有水,水的作用是。
Ⅱ.自制简易CO2吸收及供氧器
(3)利用回收材料制备一次性CO2吸收器(如下图)。O2发生器内先放入红砖粉末催化剂,倒入过氧化氢溶液,反应的化学方程式为 , 可作为CO2吸收剂的固体是。
a.CaCO3 b.Ca(OH)2 c.MnO2 d.CuO

-
9、碳元素是人类接触和利用最早的元素之一,由碳元素组成的单质有很多,部分碳单质的结构如下图。完成下面小题。
 (1)、关于碳单质的说法错误的是A、石墨和金刚石由不同种原子构成 B、金刚石是天然存在的最硬的物质 C、石墨很软且有滑腻感 D、活性炭可用于制糖工业(2)、石墨烯是目前最薄,传导电子速度最快的材料,关于石墨烯的说法错误的是A、完全燃烧的产物为CO2 B、常温下化学性质稳定 C、具有导电性 D、碳元素的化合价为+4
(1)、关于碳单质的说法错误的是A、石墨和金刚石由不同种原子构成 B、金刚石是天然存在的最硬的物质 C、石墨很软且有滑腻感 D、活性炭可用于制糖工业(2)、石墨烯是目前最薄,传导电子速度最快的材料,关于石墨烯的说法错误的是A、完全燃烧的产物为CO2 B、常温下化学性质稳定 C、具有导电性 D、碳元素的化合价为+4 -
10、新鲜大蒜头中含蒜氨酸(C6H11NSO3),大蒜头受撞击后,蒜氨酸合转化成大蒜素(C6H10S2O)。大蒜素有较强的抗菌作用,易挥发,遇热或强碱即失去抗菌活性,但不受酸影响。完成下面小题。(1)、下列有关蒜氨酸和大蒜素的说法正确的是A、都由五种元素组成 B、蒜氨酸中含有1个O3分子 C、大蒜素中含有19个原子 D、蒜氨酸中氧、硫元素的原子个数比为3:1(2)、下列有关大蒜的说法错误的是A、捣好的蒜泥加食醋不影响抗菌效果 B、捣蒜过程中发生化学变化 C、大蒜煮熟食用比生食抗菌效果更好 D、挥发性是大蒜素的物理性质
-
11、下图是某化学反应的微观示意图,相同的球代表同种原子。下列说法正确的是
 A、生成物是混合物 B、说明原子是化学变化中最小粒子 C、说明反应前后分子的种类不变 D、说明反应前后分子在化学变化中不可分
A、生成物是混合物 B、说明原子是化学变化中最小粒子 C、说明反应前后分子的种类不变 D、说明反应前后分子在化学变化中不可分 -
12、氧元素可以组成多种物质,以下物质属于氧化物的是A、CaCO3 B、O3 C、SiO2 D、KMnO4
-
13、铪可用作航天材料,下图为元素周期表中铪元素的信息。下列有关铪元素的说法正确的是
 A、核电荷数为72 B、属于非金属元素 C、相对原子质量为178.5g D、铪原子的中子数为72
A、核电荷数为72 B、属于非金属元素 C、相对原子质量为178.5g D、铪原子的中子数为72 -
14、南水北调工程是我国的一项战略性工程,功在当代,利在千秋。下列对该工程的保护措施合理的是A、扩大沿线工业生产 B、大量取水用于养鱼 C、保障水质清洁安全 D、加大沿线矿产开采
-
15、探究蜡烛及其燃烧时,发现罩在蜡烛火焰上方的烧杯内壁被熏黑。下列做法中,不可取的是A、忽略该异常现象 B、如实记录并准确描述该现象 C、向老师请教或查阅有关资料 D、重复实验,观察是否有相同现象
-
16、化学小组以NaOH为例,从定性和定量两个维度研究物质及其变化。
维度一: 定性认识 NaOH 及其溶液
⑴NaOH属于“酸”或“碱”中的。
⑵将NaOH 暴露在空气中,可观察到表面潮湿并逐渐溶解。该现象反映出 NaOH的性质有(答一条)。
⑶向稀NaOH 溶液中滴加酚酞溶液,振荡。可观察到溶液由无色变为色。
维度二:定量研究 NaOH 溶液与不同物质的反应Ⅰ.酸碱度视角
25 ℃时,利用装置(图1)测定 NaOH 溶液与稀盐酸反应过程中 pH的变化,测定结果如图2所示(控制反应过程中温度不变)。
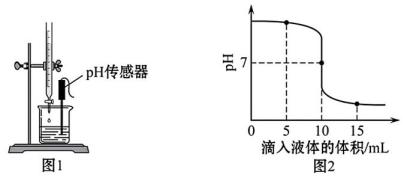
⑷烧杯中预先盛装的溶液是。
Ⅱ.能量视角
⑸当滴入液体的体积为mL时,烧杯内溶液中的溶质只有NaCl。
⑹利用传感器测定NaOH溶液与CO2反应过程中温度的变化,测定结果如图3所示,水为对照组。由图3可知,NaOH 与CO2的反应属于(选填“放热反应”或“吸热反应”)。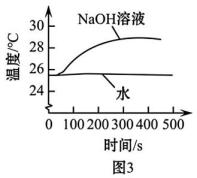
Ⅲ.压强视角
【提出问题】如何通过气体压强变化认识NaOH 溶液与CO2的反应?
【查阅资料】①可以通过反应物的减少或生成物的增加判断反应的发生情况;
②影响密闭体系内气体压强的因素有气体分子数、气体所占体积和温度。
【实施实验】利用气密性良好的装置(图4)进行实验。打开传感器,待压强平稳后将水匀速注入充满 CO2 的集气瓶中,压强稳定后再匀速注入等体积的NaOH 溶液。测得气体压强变化如图5所示。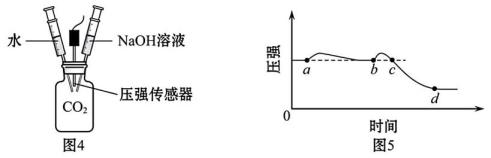
【分析解释数据】
⑺对比a点、b点及点压强的大小,可证明NaOH与CO2发生了反应。
⑻结合b点→c点的变化过程,解释b点、c点压强相同的原因:。 -
17、回答“氧气的实验室制取”实验中的相关问题。
 (1)、仪器a的名称是。(2)、实验室用加热高锰酸钾的方法制取O2。
(1)、仪器a的名称是。(2)、实验室用加热高锰酸钾的方法制取O2。①该反应的化学方程式为;
②用该方法制取O2的发生装置应选择图1中的装置(填序号)。
(3)、将图2中的仪器组装成收集装置,与选择的发生装置相连,制取氧气。实验完成后,老师对“组装收集装置”和“收集气体”的过程进行点评,上述两个过程中的一些错误操作,可能会影响收集到氧气的浓度,例如“未验满就停止收集”。请再写出两点可能导致收集到氧气的浓度偏低的错误操作:。 -
18、中科院李灿院士团队在二氧化碳制甲醇(化学式为CH3OH,甲醇是内燃机的理想燃料之一)的研究方面取得了新进展,该反应的微观示意图如下。
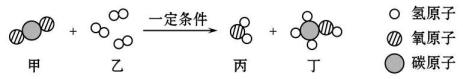 (1)、 图中表示CH3OH的是(填序号)。(2)、该反应的化学方程式为。(3)、若该反应生成的两种物质中氧元素的总质量为16g,则参加反应的氢气的质量为g(可能用到的相对原子质量: H——1 C——12 O——16)。(4)、该反应的应用价值是(答一条)。
(1)、 图中表示CH3OH的是(填序号)。(2)、该反应的化学方程式为。(3)、若该反应生成的两种物质中氧元素的总质量为16g,则参加反应的氢气的质量为g(可能用到的相对原子质量: H——1 C——12 O——16)。(4)、该反应的应用价值是(答一条)。 -
19、在农业生产中,可利用不同溶质质量分数的NaCl溶液选种。
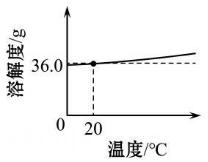 (1)、NaCl在水中的溶解有限度。右图为NaCl的溶解度曲线。
(1)、NaCl在水中的溶解有限度。右图为NaCl的溶解度曲线。①NaCl的溶解度随温度升高而;
②20℃时, NaCl的溶解度是 g。
(2)、若用NaCl固体和水配制100kg溶质质量分数为16%的NaCl溶液, 需要NaCl固体的质量是 kg。 -
20、五行传千载,变化藏其中。“‘金、木、水、火、土’五行相生相克”是古人对物质及物质之间关系最朴素的认知。
 (1)、木生火 (木燃烧生成火)。木柴能燃烧,从“燃烧的条件”分析,木柴是。(2)、火生土 (火燃烧后变成灰烬)。将秸秆晒干烧灰,……即得到草木灰 (含有碳酸钾)。碳酸钾属于“氮肥”“磷肥”“钾肥”中的肥。(3)、土生金(矿石冶炼得到金属)。“火法炼锌”过程中应用的原理之一为: 其反应类型是反应。(4)、金生水(金属能凝聚水蒸气而成水)。水蒸气在温度较低的金属表面液化成水,该过程中水分子间的间隔变。(5)、水生木(用水灌溉,树木生长)。除水外,再写一条影响植物生长的因素:。(6)、与现代化学理论相比, “五行学说”具有一定的局限性。试举一例说明其局限性: 。
(1)、木生火 (木燃烧生成火)。木柴能燃烧,从“燃烧的条件”分析,木柴是。(2)、火生土 (火燃烧后变成灰烬)。将秸秆晒干烧灰,……即得到草木灰 (含有碳酸钾)。碳酸钾属于“氮肥”“磷肥”“钾肥”中的肥。(3)、土生金(矿石冶炼得到金属)。“火法炼锌”过程中应用的原理之一为: 其反应类型是反应。(4)、金生水(金属能凝聚水蒸气而成水)。水蒸气在温度较低的金属表面液化成水,该过程中水分子间的间隔变。(5)、水生木(用水灌溉,树木生长)。除水外,再写一条影响植物生长的因素:。(6)、与现代化学理论相比, “五行学说”具有一定的局限性。试举一例说明其局限性: 。