-
1、通常情况下,硫酸与大理石反应很难产生持续的气流。为探究用硫酸与大理石反应制取CO2的优化条件,进行如下实验。下列说法错误的是
序号
硫酸体积/mL
硫酸浓度/%
粒状大理石的质量/g
搅拌速率/(r・min-¹)
2粒/g
5粒/g
1
15
2.5
15
0
0
2
15
2.5
15
0
750
3
15
2.5
n
0
1250
4
15
1
15
0
1250
5
15
1
0
15
1250
A、实验1和2对比可探究搅拌速率的影响 B、实验4和5对比可探究大理石颗粒大小的影响 C、欲探究硫酸浓度的影响,n的值应为0 D、搅拌可使微溶的硫酸钙不易附着在大理石表面 -
2、科学思维是化学核心素养的重要组成部分。下列说法错误的是A、归纳:食物腐烂、细胞呼吸、醋的酿造均属于缓慢氧化 B、比较:金刚石和石墨中碳原子的排列方式不同,二者物理性质差异较大 C、分析:试管加热时发生炸裂,可能是没有预热或试管底部触及灯芯 D、推理:蜡烛燃烧减小的质量一定等于生成水和二氧化碳的质量之和
-
3、我国提出 2060年前实现“碳中和”(如图1),海水对 CO2的固定起重要作用。CO2在水中的溶解度如图2所示。下列说法正确的是
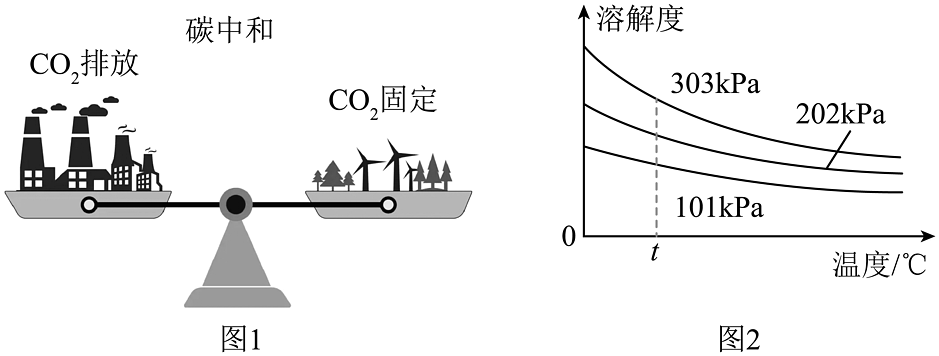 A、减少 CO2排放,能减少酸雨形成 B、“碳中和” 是指完全不排放 CO2 C、升温可增大 CO2在海水中的溶解度 D、t℃时,不同压强下,CO2的溶解度:303 kPa>202 kPa>101 kPa
A、减少 CO2排放,能减少酸雨形成 B、“碳中和” 是指完全不排放 CO2 C、升温可增大 CO2在海水中的溶解度 D、t℃时,不同压强下,CO2的溶解度:303 kPa>202 kPa>101 kPa -
4、为探究铁、铜、锰的活动性,进行了如图所示实验(金属丝均足量),观察到锰丝表面有固体析出。下列说法错误的是
 A、实验前要打磨金属丝 B、①中溶液逐渐变为黄色 C、①、②中发生的均为置换反应 D、三种金属的活动性顺序:锰>铁>铜
A、实验前要打磨金属丝 B、①中溶液逐渐变为黄色 C、①、②中发生的均为置换反应 D、三种金属的活动性顺序:锰>铁>铜 -
5、铜和锰在元素周期表中的信息如图所示。下列说法错误的是

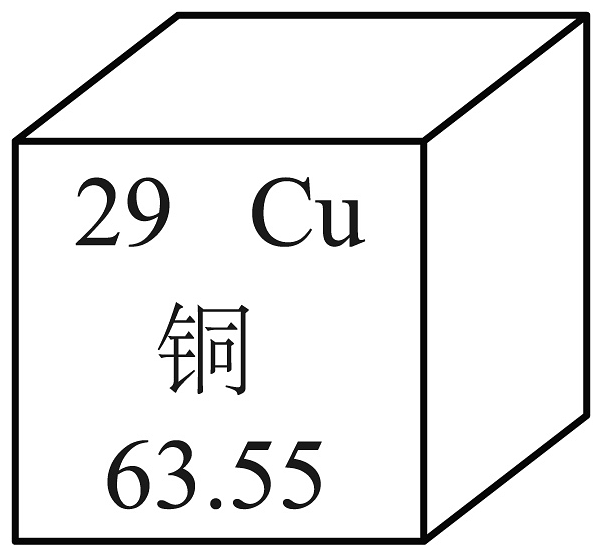 A、锰的原子序数为25 B、铜原子的核外电子数为29 C、1个铜原子的质量比1个锰原子的质量大 D、铜和锰在化合物中均只显+2价
A、锰的原子序数为25 B、铜原子的核外电子数为29 C、1个铜原子的质量比1个锰原子的质量大 D、铜和锰在化合物中均只显+2价 -
6、下列关于角钢的说法错误的是A、是一种合金 B、熔点比纯铁低 C、只含有金属元素 D、可用于桥梁建造等
-
7、化学知识可以帮助我们解决许多生活中的问题,下列方案不能解决相应生活问题的是
选项
生活问题
解决方案
A
发现厨房燃气泄漏
立即打开排风扇
B
去除河水中的悬浮物
加入明矾静置,过滤
C
锁头开启不灵活
向锁头中加入铅笔芯粉末
D
家中绿植叶片发黄
施加适量尿素 [CO(NH2)2]
A、A B、B C、C D、D -
8、无尘粉笔是在普通粉笔中加入甘油、海藻酸钠等作黏结剂使粉尘不易飞散。如图是甘油的结构式,下列说法正确的是
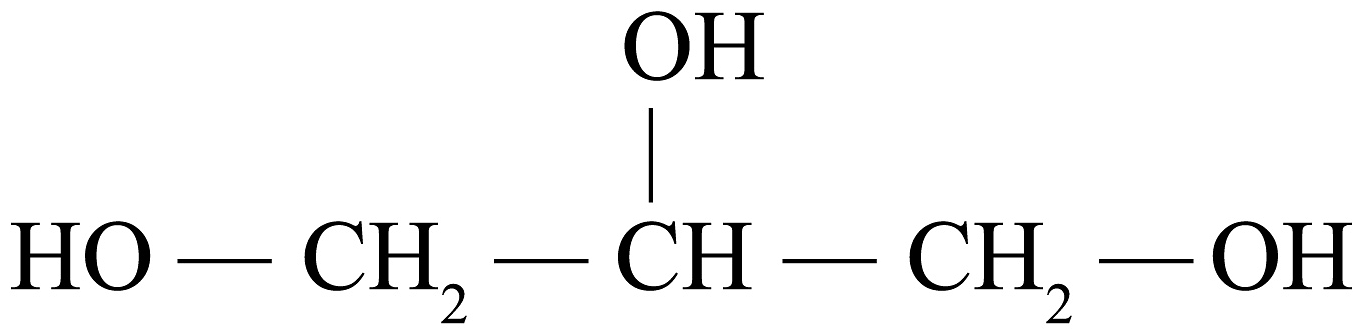 A、甘油的化学式为C3H3O3 B、甘油中氧元素的质量分数约为52% C、甘油中碳、氢元素的质量比为3∶8 D、海藻酸钠中钠离子的结构示意图为
A、甘油的化学式为C3H3O3 B、甘油中氧元素的质量分数约为52% C、甘油中碳、氢元素的质量比为3∶8 D、海藻酸钠中钠离子的结构示意图为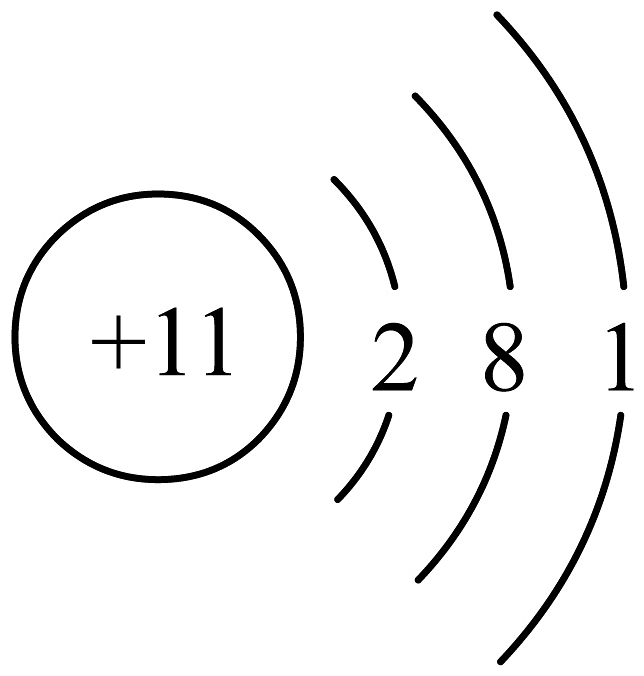
-
9、在钢笔的墨水中加稳定剂如氢氧化钠、柠檬酸钠(C6H5O7Na3)、甲醛等可避免墨水变色或书写时发生断水现象。下列说法正确的是A、氢氧化钠俗称纯碱 B、柠檬酸钠属于酸 C、甲醛可用作食品防腐剂 D、用碳素墨水所作字画能长久保存不褪色
-
10、毛笔是中国独有的发明。随着社会发展,制作毛笔笔头的材料不断变迁,下列其制作材料中,属于合成材料的是A、蚕蛹蛋白丝 B、钛镍合金丝 C、聚酯纤维 D、碳纳米管纤维
-
11、下列图标与如图所示实验无关的是
 A、
A、 用电
B、
用电
B、 护目镜
C、
护目镜
C、 热烫
D、
热烫
D、 明火
明火
-
12、保持氢气化学性质的最小粒子是A、H+ B、H C、2H D、H2
-
13、下面是一些生活中常见的物质,其中碱性最强的是A、柠檬汁 B、牛奶 C、牙膏水 D、肥皂水
-
14、“霓虹灯火照天明,夜色街头气象新。” 霓虹灯中充入的气体可能是A、氧气 B、氦气 C、氮气 D、空气
-
15、
某兴趣小组阅读课外资料时,了解到钡餐是一种造影剂,在X光照射下显示胃肠道有无病变。常见的钡餐是难溶于水的药用硫酸钡,对人体无害,但是可溶性钡盐对人体的伤害很大。
【提出问题I】碳酸钡也是难溶于水的钡盐,是否能做胃肠道检查的钡餐?
【实验I】在实验室中模拟碳酸钡与胃酸主要成分的反应,如下图。

【表达交流I】
(1)试管内有无色气泡冒出,固体逐渐溶解得到无色透明溶液,其反应的化学方程式为________;因此医疗上________(填“能”或“不能”)用碳酸钡作钡餐。
【提出问题Ⅱ】反应后溶液中溶质成分是什么?
猜想一:只有猜想二:和HCl。
【查阅资料】氯化钡溶液显中性。
【实验Ⅱ】
(2)分别取少量反应后的溶液于a、b两支试管中,并进行如下的实验。
操作
现象
结论
①
向试管a中滴加硝酸银溶液
________
有氯化银生成
②
向试管b中滴加(4)________
溶液显红色
溶液显酸性
【表达交流Ⅱ】
(3)若只做①,不能证明猜想二成立,因为________(用化学方程式表示)。通过①、②分析:猜想二成立。
【反思拓展】
I.实验结束后,将废液倒入废液缸中进行集中处理后再排放。
Ⅱ.若不小心误食可溶性钡盐,急救的方法之一是用某稀溶液洗胃,以除去重金属
(4)下列物质可用于急救的是_______(填字母)。
A. 溶液 B. 溶液 C. 稀 -
16、屠呦呦因发现青蒿素并研制出抗疟药而获得诺贝尔奖。青蒿琥酯是我国自主研发的青蒿素衍生抗疟药,下列关于青蒿琥酯说法正确的是A、属于无机化合物 B、相对分子质量是206 C、由三种元素组成 D、该物质由55个原子构成
-
17、某种手机电路板主要含有Fe、Cu、Ag、Ni(镍)等金属及非金属基材,某工厂回收金属铜的工艺流程图如图所示。
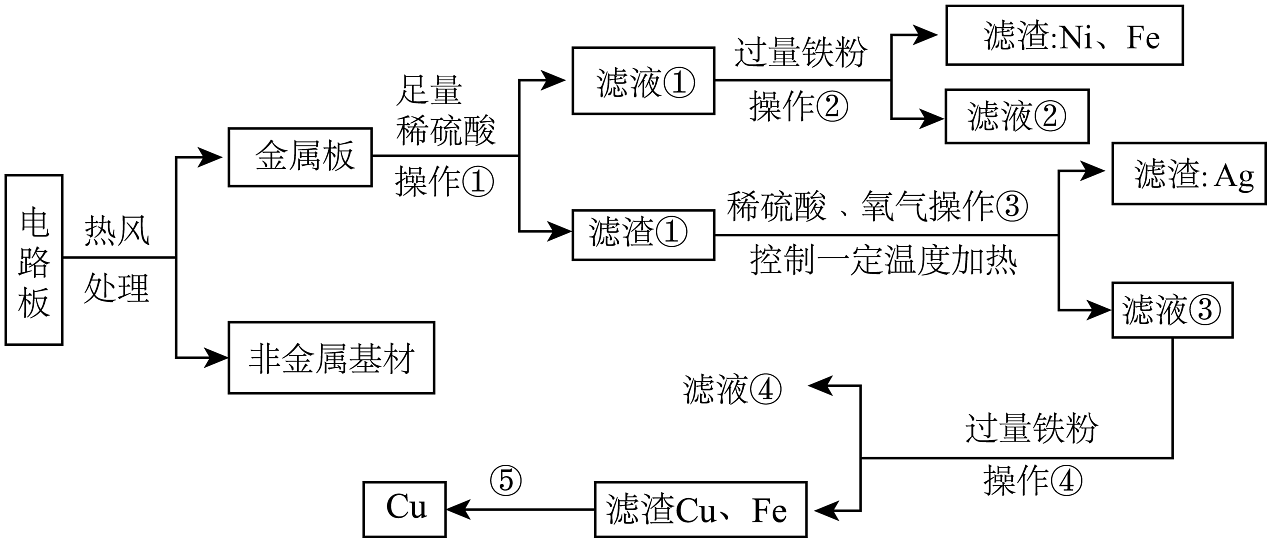
已知:
(1)、电路板热风处理的目的。(2)、操作①的名称是。(3)、滤液①中主要含有的金属阳离子有 Ni2+和(填离子符号)。(4)、生成滤渣 Ni的化学反应方程为。(5)、滤液②中滴加NaOH,请写出其化学方程式。(6)、滤液③中的溶质是。(7)、滤液④中的溶质为。(8)、最后步骤⑤中如何分离滤渣 Cu、Fe?。 -
18、
铁制品容易生锈,但将铁加热熔入金属铬,可制成不锈钢。化学兴趣小组进行以下实验,比较铬、铁、铜的金属活动性强弱。
【查阅资料】铬是一种抗腐蚀性强的银白色金属。硫酸亚铬(CrSO4)溶液呈亮蓝色,在空气中能迅速被氧化成碱性硫酸铬[Cr(OH)SO4],其溶液呈绿色。
【提出猜想】
(1)三种金属的活动性强弱为:猜想一:Cr>Fe>Cu,猜想二:Fe>Cr>Cu,猜想三:。【实验探究】
(2)步骤1:取大小相同的三种金属片,用砂纸打磨光亮。步骤2:将三种金属片分别放入三支装有等量、等浓度稀硫酸的试管中。
序号
实验操作
实验现象
实验结论
Ⅰ
将铁片放入稀硫酸
铁片表面产生气泡较慢,溶液逐渐变为色
猜想成立
Ⅱ
将铬片放入稀硫酸
铬片表面产生气泡较快,铬片逐渐 , 溶液变为蓝色
Ⅲ
将铜片放入稀硫酸
无明显现象
【分析解释】
(3)请写出铬与稀硫酸反应生成CrSO4的化学方程式:。反应后的溶液一段时间后变成绿色,其原因是: , 反应的化学方程式为:4CrSO4+O2+2X=4Cr(OH)SO4 , 其中X的化学式为 , Cr(OH)SO4中的Cr化合价为。【反思评价】
(4)实验结束后有同学提出质疑:金属和酸反应放出的热量会对反应速率造成影响,因此上述实验结论不够科学。建议用铬片、铜片和溶液进一步验证铬、铁、铜三种金属的活动性强弱。 -
19、根据下列实验装置,回答有关问题。
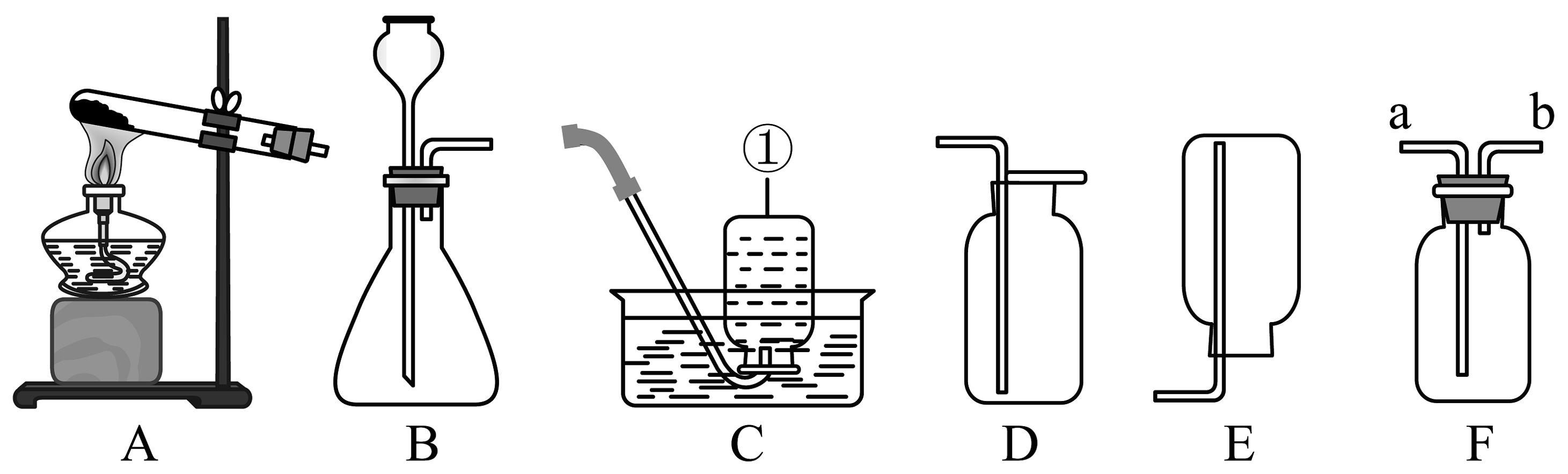 (1)、仪器①的名称。(2)、用过氧化氢和二氧化锰制取较为纯净氧气的装置组合是 , 若选用F装置收集气,气体应从(填“a”或“b”)下同)端通入;也可先将集气瓶装满水,让气体从导管进入。(3)、实验室用高锰酸钾制取氧气当选用C装置收集完气体后,测得瓶中氧气纯度明显偏低,以下原因可能的是 。A、收集前,集气瓶中未注满水 B、集气瓶在移出水面前未盖玻璃片 C、未见气泡连续均匀冒出时就开始收集(4)、氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,选用的发生装置是 , 选用的收集装置是。(5)、某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③双手紧贴塑料瓶外壁并倒转瓶口,三步实验中测得氧气的体积分数随时间变化的曲线依次为图3中的MN段、NP段和PQ段。
(1)、仪器①的名称。(2)、用过氧化氢和二氧化锰制取较为纯净氧气的装置组合是 , 若选用F装置收集气,气体应从(填“a”或“b”)下同)端通入;也可先将集气瓶装满水,让气体从导管进入。(3)、实验室用高锰酸钾制取氧气当选用C装置收集完气体后,测得瓶中氧气纯度明显偏低,以下原因可能的是 。A、收集前,集气瓶中未注满水 B、集气瓶在移出水面前未盖玻璃片 C、未见气泡连续均匀冒出时就开始收集(4)、氨气极易溶于水,且密度比空气小,实验室常用加热固体硫酸铵和固体熟石灰的混合物来制取氨气,选用的发生装置是 , 选用的收集装置是。(5)、某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶氧气进行以下三步实验:①敞口放置;②双手贴在塑料瓶外壁上;③双手紧贴塑料瓶外壁并倒转瓶口,三步实验中测得氧气的体积分数随时间变化的曲线依次为图3中的MN段、NP段和PQ段。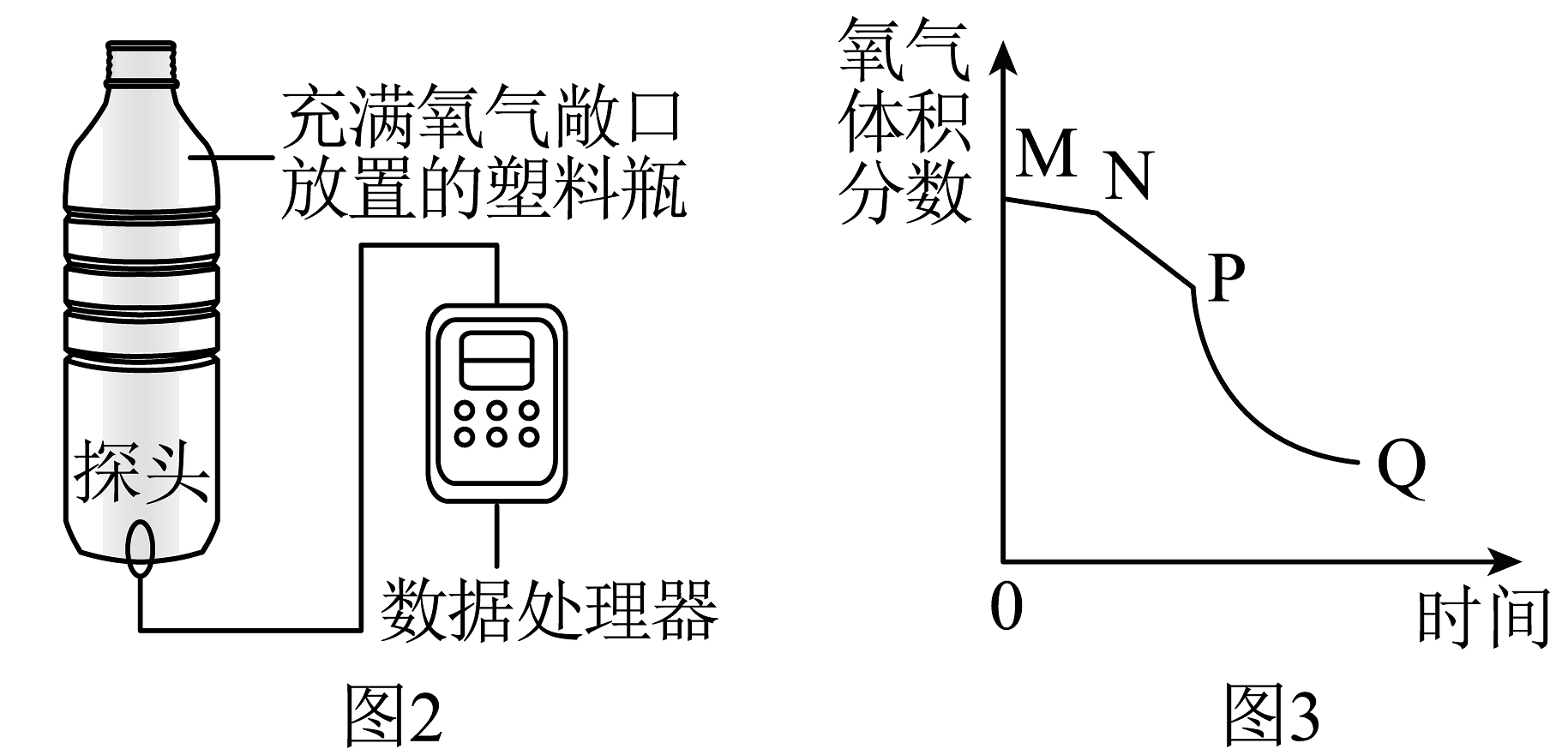
i.能说明温度越高分子运动速率越快的曲线是。
A.MN段 B.NP段 C.PQ段
ii.PQ段与NP段相比可以得出结论:。
iii.随着实验的进行,传感器测出氧气的体积分数约为时几乎不再变化。
-
20、减少CO2排放,实现碳中和,其中碳替代、碳减排、碳封存、碳循环是实现碳中和的4种主要途径。科学家预测,到2050年,4种途径对全球碳中和的贡献率如图1。CO2的吸收是碳封存的首要环节,常选用 NaOH、氨水、一乙醇胺等作吸收剂。在研究膜吸收法吸收 CO2时,研究人员通过实验比较了一乙醇胺、二乙醇胺、氨基乙酸钾3 种吸收剂对烟气中CO2的脱除效果,其结果如图2。

依据上述内容回答下列问题:
(1)、自然界碳的循环中,化石燃料燃烧(填“吸收”或“释放”)CO2。(2)、由图1可知,到2050年,对全球碳中和贡献率最大的途径是。(3)、用NaOH溶液吸收CO2 , 发生反应的化学方程式为。(4)、判断下列说法是否正确(填“对”或“错”)。i.由图2可知,随烟气流速增大,CO2脱除效果增强。
ii.节约用电,绿色出行,有助于实现碳中和。
(5)、对比图2中三条曲线,得出的结论是:在实验研究的烟气流速范围内,当烟气流速相同时,。