-
1、 氢气的发现、制取、储存和利用意义重大。
发现氢气:16世纪科学家就发现稀H2SO4与Fe反应能生成“易燃空气”。1787年拉瓦锡将H2O(g)[表示水蒸气]通过一根烧红的铁制枪管,得同样“易燃空气”。他将“易燃空气”命名为“生成水的元素”,即氢。
(1)、拉瓦锡实验中,枪管内壁有黑色固体(Fe3O4)生成,该反应的化学方程式为。制取氢气:一种以NiFe2O4为催化剂制氢的反应原理如图1所示。
 (2)、反应Ⅰ中NiFe2O4(填“参加”或“未参加”)化学反应。(3)、将16gCH4和足量的H2O(g)通过该方法制氢,理论上可获得g H2.
(2)、反应Ⅰ中NiFe2O4(填“参加”或“未参加”)化学反应。(3)、将16gCH4和足量的H2O(g)通过该方法制氢,理论上可获得g H2.储存氢气:镁基材料固态储氢具有储量大、安全等优点。储氢时,Mg与H2在一定条件下反应生成MgH2固体。1m3镁基材料储存的H2在常温常压下体积可达1345m3.
(4)、MgH2由两种离子按个数比1:2构成。构成MgH2的是Mg2+和(填离子符号)。(5)、镁基材料储氢量大的原因是。利用氢气:氢氧燃料电池能将化学能转化为电能,工作原理如图2所示。
 (6)、质子交换膜中只允许一种微观粒子通过,该微观粒子为____(填字母)。A、e- B、H+ C、O2-(7)、燃料电池中发生反应的化学方程式为。
(6)、质子交换膜中只允许一种微观粒子通过,该微观粒子为____(填字母)。A、e- B、H+ C、O2-(7)、燃料电池中发生反应的化学方程式为。 -
2、 “鱼浮灵”是水产养殖中常见增氧剂,主要成分是过碳酸钠(2Na2CO3·3H2O2),遇水分解为Na2CO3和H2O2 , 能快速增加水体中溶解氧。学习小组对增氧原理进行探究。
已知∶溶解氧是指水溶液中溶解O2的浓度,单位mg·L-1 , 可用溶解氧传感器测定。
【猜想】
(1)、“鱼浮灵”溶于水后,能快速增加水体中溶解氧的物质是什么?猜想一∶Na2CO3溶液。猜想二∶。猜想三∶Na2CO3溶液和H2O2溶液协同作用。
(2)、【实验】实验Ⅰ∶配制一定质量分数的过碳酸钠溶液,测量其pH。向过碳酸钠溶液中加入少量MnO2 , 有无色气体生成,该气体能使带火星木条复燃。反应后将混合物过滤,向滤液中加足量盐酸有无色气体产生。
下列仪器在配制溶液过程中无需使用的是____(填字母)。
A、 B、
B、 C、
C、 D、
D、 (3)、室温下,测得过碳酸钠溶液的pH=10.5,说明其溶液呈性。(4)、由实验Ⅰ可知,过碳酸钠溶液中能使水体增氧(产生O2)的物质为。(5)、实验Ⅱ∶室温下,在相同时间内用溶解氧传感器测量80mL的下列试剂,测得下表数据。
(3)、室温下,测得过碳酸钠溶液的pH=10.5,说明其溶液呈性。(4)、由实验Ⅰ可知,过碳酸钠溶液中能使水体增氧(产生O2)的物质为。(5)、实验Ⅱ∶室温下,在相同时间内用溶解氧传感器测量80mL的下列试剂,测得下表数据。实验序号
ⅰ
ⅱ
ⅲ
ⅳ
测量试剂
水
4%Na2CO3溶液
4%H2O2溶液
4%H2O2溶液+2gNa2CO3
溶解氧/mg·L-1
4.6
4.4
6.5
9.1
【结论】
由实验Ⅰ、Ⅱ得出的结论是∶猜想(填“一”或“二”或“三”)正确。
(6)、【反思】已知∶①在一定pH范围内,pH越大水体中的H2O2越易分解,溶解氧越大。
②Na2CO3溶液呈碱性,主要原因是溶液中部分与水反应生成和OH-。质量分数相同的NaOH溶液和Na2CO3溶液,NaOH溶液pH大。
为验证溶液pH对H2O2分解的影响,还需补充完整以下实验方案∶室温下,各取80mL4%的H2O2溶液于两只烧杯中,向烧杯中分别加入 , 在相同时间内用溶解氧传感器测定烧杯中溶液的溶解氧。(实验中必须使用的试剂:NaCl、NaOH)
(7)、从微观粒子变化角度分析过碳酸钠溶于水后能快速增加水体中溶解氧的原因∶。 -
3、 自然界中的碳氧循环是人类生存的基础。
绿色植物的光合作用可吸收CO2放出O2 , 反应∶6CO2+6XC6H12O6+6O2。
(1)、C6H12O6属于____(填字母)。A、有机物 B、无机物 C、氧化物(2)、化合物X的化学式为。(3)、化石能源的燃烧、人和动物的呼吸作用消耗O2 , 产生CO2。下列关于化石能源的说法正确的是____(填字母)。
A、化石能源只能通过燃烧加以利用 B、石油炼制可得到煤气、汽油和石蜡等多种产品 C、与燃煤相比,使用天然气可以减少SO2、氮氧化物等排放(4)、某化学小组同学为比较人体吸入的气体与呼出的气体中CO2、O2含量高低,实验如下:取4个相同的集气瓶,分别编号A、B、C、D,其中A、B用玻璃片盖好;C和D通过排水集气法收集两瓶呼出的气体,备用。完成下表:
实验内容
现象
结论
向A、C中分别滴加等量的澄清石灰水,振荡,观察现象。
A中无明显现象,C中。
呼出气体中的CO2含量大于空气中CO2含量。
将燃着的小木条分别伸入B、D中,观察现象。
B中无明显现象,D中燃着的木条熄灭。
呼出气体中O2含量。
实现碳中和意义重大。燃煤烟气中CO2的捕集可通过如下所示的物质转化实现。
 (5)、“吸收”中所得的KHCO3溶液与石灰乳反应的化学方程式为。(6)、“过滤”得到的K2CO3溶液能循环利用的原因是。(7)、工业上常用高温煅烧CaCO3制取CO2并获取CaO。理论上获取1.1吨CO2时能生产CaO多少吨?(写出计算过程)
(5)、“吸收”中所得的KHCO3溶液与石灰乳反应的化学方程式为。(6)、“过滤”得到的K2CO3溶液能循环利用的原因是。(7)、工业上常用高温煅烧CaCO3制取CO2并获取CaO。理论上获取1.1吨CO2时能生产CaO多少吨?(写出计算过程) -
4、 中华文化源远流长,化学与文化传承密不可分。(1)、《庄子》中记载“木与木相摩则然(燃)”。从燃烧条件分析,“木与木相摩”的取火原理是使可燃物。(2)、《吕氏春秋》中对青铜有“金(指铜)柔锡柔,合两柔则刚”的记载。古代青铜器的硬度比纯铜(填“大”或“小”)。(3)、“春蚕到死丝方尽,蜡炬成灰泪始干”是唐代诗人李商隐的著名诗句。
①蚕丝属于(填“天然”或“合成”)纤维。
②“蜡炬成灰”属于(填“物理变化”或“化学变化”)。
(4)、《富春山居图》是元代水墨画。此画能保存至今而不变色的原因是。(5)、《天工开物》记载了我国古代利用天然气熬制井盐(主要成分为NaCl)。下列说法正确的是____(填字母)。A、天然气燃烧吸收能量 B、天然气属于纯净物 C、熬制井盐经过蒸发结晶过程 -
5、 通过数字化实验探究NaOH的性质。
实验1∶在盛有NaOH固体的密闭容器中,水蒸气含量随时间的变化如图-1所示。
实验2∶取长期放置后的NaOH固体于烧杯中,加水溶解冷却至室温,加入BaCl2固体,溶液pH随时间的变化如图-2所示。
实验3∶向一定体积NaOH溶液中滴加稀盐酸,混合溶液的pH随加入稀盐酸体积的变化如图-3所示。

已知∶BaCl2易溶于水,且溶液呈中性。
下列说法正确的是( )
A、图-1证明NaOH固体能吸收CO2和H2O而变质 B、图-2中ab段pH下降证明NaOH能与BaCl2发生复分解反应 C、图-3中向c点所得溶液中滴加无色酚酞溶液,溶液显红色 D、图-3中d点所得溶液中Na+的个数小于Cl-的个数 -
6、 工业上生产CaCl2·2H2O的主要流程示意图如题图所示。下列说法正确的是( )
 A、石灰石的主要成分是Ca(OH)2 B、粉碎可以增大反应物间的接触面积 C、反应器中加入的稀盐酸可用稀硫酸代替 D、流程中用于分离提纯的设备有搅拌器和过滤器
A、石灰石的主要成分是Ca(OH)2 B、粉碎可以增大反应物间的接触面积 C、反应器中加入的稀盐酸可用稀硫酸代替 D、流程中用于分离提纯的设备有搅拌器和过滤器 -
7、80℃时将饱和Li2SO4溶液和饱和Na2CO3溶液混合反应,制备Li2CO3晶体。Na2CO3、Li2SO4、Li2CO3溶解度曲线如题图所示。下列说法正确的是( )
 A、Na2CO3的溶解度一定比Li2SO4的大 B、20℃时将Li2SO4饱和溶液升温到40℃时变为不饱和溶液 C、40℃时,60gNa2CO3固体加入100g水中得到160g溶液 D、该制备反应利用了Li2CO3溶解度相对较小的性质
A、Na2CO3的溶解度一定比Li2SO4的大 B、20℃时将Li2SO4饱和溶液升温到40℃时变为不饱和溶液 C、40℃时,60gNa2CO3固体加入100g水中得到160g溶液 D、该制备反应利用了Li2CO3溶解度相对较小的性质 -
8、 下列实验方案能达到实验目的的是( )
选项
实验目的
实验方案
A
稀释浓硫酸
取水倒入浓硫酸中,并用玻璃棒不断搅拌
B
检验H2的纯度
用拇指堵住集满H2的试管口,管口向下靠近火焰,移开拇指点火
C
分离CuO和Fe粉
加入足量水,溶解,过滤
D
验证Al、Cu、Ag的金属活动性
向CuSO4溶液和AgNO3溶液中各放入大小、形状相同的Al片
A、A B、B C、C D、D -
9、 青蒿素(C15H22O5)是我国科学家屠呦呦从传统中药中提取的抗疟疾有效成分。下列关于C15H22O5的说法正确的是( )A、由三种元素组成 B、C和O元素的质量比为3∶1 C、H元素的质量分数最大 D、1个C15H22O5分子中含有11个H2分子
-
10、 厨房中处处有化学。下列厨房中常用物质的性质与用途具有对应关系的是( )A、食醋有挥发性,可去除水垢 B、氯化钠是白色固体,可作调味品 C、竹炭有吸附性,可作冰箱除味剂 D、碳酸氢钠易溶于水,可作发酵粉
-
11、阅读下列材料,完成下面小题:
工业合成氨的反应为:N2+3H22NH3。NH3是制造硝酸(HNO3)和氮肥(如尿素[CO(NH2)2]、氯化铵等)的重要原料。元素周期表中氮元素的信息如图所示。
 (1)、下列化学用语表示正确的是( )A、2个氮原子:N2 B、NH3中氮元素的化合价: C、HNO3在水中解离出的阳离子:H+ D、氯化铵的化学式:ClNH3(2)、下列说法中正确的是( )A、地壳中氮元素含量最高 B、尿素中含有氮元素 C、氮元素的相对原子质量为14.01g D、氮原子中质子数和电子数之和等于7(3)、工业合成氨的反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应
(1)、下列化学用语表示正确的是( )A、2个氮原子:N2 B、NH3中氮元素的化合价: C、HNO3在水中解离出的阳离子:H+ D、氯化铵的化学式:ClNH3(2)、下列说法中正确的是( )A、地壳中氮元素含量最高 B、尿素中含有氮元素 C、氮元素的相对原子质量为14.01g D、氮原子中质子数和电子数之和等于7(3)、工业合成氨的反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应 -
12、 实验室用CaCO3、稀盐酸制取CO2 , 涉及的装置和操作正确的是( )A、制取CO2
 B、除去CO2中HCl
B、除去CO2中HCl C、干燥CO2
C、干燥CO2 D、收集CO2
D、收集CO2
-
13、 酒精(C2H5OH)是医疗及日常生活中的消毒剂。下列对酒精的描述属于化学性质的是( )A、易挥发 B、无色透明液体 C、燃烧时生成H2O和CO2 D、能与水以任意比例互溶
-
14、 《中国制造2025》对制造业提出了更高要求。我国最新研发的光控智能粘附材料由H、C、N、Fe等元素组成,其中属于金属元素的是( )A、H B、C C、N D、Fe
-
15、
铜是人类最早使用的金属之一。商代就能铸造精美的青铜礼器,现代铜在新能源汽车制造等领域有重要应用。
任务一:认识铜制品
(1)深埋于地下的古代青铜器能保存至今的原因可能是________。(写一条即可)任务二:古代制铜
(2)《大冶赋》中记载了用孔雀石制得CuO,再用CuO和木炭在高温下反应得到Cu,该反应的化学方程式为________。任务三:现代制铜
(3)制铜前,需将铜原料进行粉碎处理,目的是________。(4)制铜原理:。计算投入160kgCuSO4 , 理论上可制得Cu的质量为多少?(根据化学方程式计算,并写出计算过程)(5)制得的铜可压成薄片,是利用了铜具有良好的________。 -
16、碳酸锂(Li2CO3)是制备新能源汽车电池的重要原料。工业上用粉末状的锂辉矿为原料制取Li2CO3 , 锂辉矿主要成分为Li2O、Fe2O3、SiO2等,其工艺流程如下图。
 (1)、反应①中,X溶液的溶质为(填化学式)。(2)、反应②中,生成滤渣2的化学方程式为。(3)、反应③的基本反应类型为反应。加入过量的饱和)Na2CO3溶液的目的是。(4)、下表为Li2CO3与Na2SO4在不同温度下的溶解度(g)数据,据此判断:
(1)、反应①中,X溶液的溶质为(填化学式)。(2)、反应②中,生成滤渣2的化学方程式为。(3)、反应③的基本反应类型为反应。加入过量的饱和)Na2CO3溶液的目的是。(4)、下表为Li2CO3与Na2SO4在不同温度下的溶解度(g)数据,据此判断:温度/℃
0
20
40
60
80
Li2CO3
1.54
1.33
1.17
1.01
0.85
Na2SO4
5.0
19.4
48.8
45.3
43.7
①为获得更多的产品,加入的饱和Na2CO3溶液的最佳温度是(填字母序号)。
A.0℃ B.20℃ C.40℃
②“沉锂”后从滤液中回收Na2SO4晶体的操作是、过滤、洗涤及干燥。
(5)、已知Li2CO3的化学性质和CaCO3相似,则Li2CO3和稀盐酸反应的化学方程式为。 -
17、
近年来,我国一些地区创新采用了“水上发电、水下养殖”发展模式。该模式不仅有效提高了经济效益,而且节约了土地资源。化学兴趣小组的同学来到“水上发电、水下养殖”模式的示范地参观并进行项目式学习。
已知:鱼塘底部有机物分解易使水质酸性增强;养殖鱼虾,会定期投入CaCl2。
任务一:了解“水上发电、水下养殖”模式
(1)水上发电所架设光伏板的支架材料应具备的性质是(答一条即可)。任务二:探究鱼塘水的酸碱性和成分
【猜想假设】该鱼塘水呈酸性,且含有CaCl2。
【进行实验】
(2)操作
现象
步骤1:取少量鱼塘水于试管中向其中滴加几滴。
溶液变成红色
鱼塘水呈酸性
步骤2:取少量鱼塘水于试管中,向其中滴加足量Na2CO3溶液。
产生气泡,一段时间后,
含有CaCl2
步骤3:
产生白色沉淀
上述步骤2中能证明鱼塘水含有CaCl2的化学反应方程式为。
任务三:检测鱼塘水的酸碱度和溶氧量
(3)同学们了解到水下生产养殖过程中需保证合适的溶氧量和酸碱度等。同学们发现通常情况下,下午或傍晚时鱼塘水的pH最大,溶氧量最高,其原因可能与水中浮游植物的作用有关。(4)同学们观察到工人会定期向鱼塘撤入适量的 , 既调节鱼塘的酸碱性,防止其酸性过强,也起到了杀菌的作用。 -
18、火星作为太阳系中与地球最相似的行星,成为各航天大国深空探测的最主要目标之一。
科学家提出利用火星当地资源生产火星探测所需原料和能源,可以减少成本。目前探测出火星大气中的气体成分含量:CO2(95.3%)、N2(2.7%)、其它(2.0%)。火星表面富含丰富的Fe2O3、Al2O3、MgO等典型金属氧化物矿物资源。
甲烷(CH4)作为火箭推进剂的燃料,正被越来越多的航天公司研究和使用。研究发现:以CO2为原料的“地外合成甲烷”可以实现,其原理如图1所示。将CO2转化为CH4的反应在低温下就可自发进行,CO2转化率与温度和压强的关系如图2所示。
 (1)、火星外观呈现红色的原因是。(2)、鉴别一瓶模拟“火星大气”的气体和一瓶空气,可采取的操作为。(3)、根据图1写出“地外合成甲烷”的化学反应方程式 , 该方案的优点是。(4)、由图2可知,在所研究的温度和压强范围内,CO2转化率与温度和压强的关系是。(5)、空间站已实现图1中反应②制取O2。电解时与电源(填“正极”或“负极”)相连的玻璃管内产生O2。(6)、如要移民火星,必须要解决O2供给问题。你认为在火星制取O2最合适的原料是。
(1)、火星外观呈现红色的原因是。(2)、鉴别一瓶模拟“火星大气”的气体和一瓶空气,可采取的操作为。(3)、根据图1写出“地外合成甲烷”的化学反应方程式 , 该方案的优点是。(4)、由图2可知,在所研究的温度和压强范围内,CO2转化率与温度和压强的关系是。(5)、空间站已实现图1中反应②制取O2。电解时与电源(填“正极”或“负极”)相连的玻璃管内产生O2。(6)、如要移民火星,必须要解决O2供给问题。你认为在火星制取O2最合适的原料是。 -
19、H2和氨气(NH3)是最具前景的燃料。但NH3燃烧不稳定会产生NO造成污染,为减少氮的氧化物排放,科研人员将煤粉、NH3掺混燃烧,提高NH3燃烧的稳定性。不同燃烧技术对CO2和NO排放的影响,见图1和图2。下列说法正确的是
 A、H2燃烧的化学方程式为 B、由图2可知,分级燃烧能减少NO的排放 C、掺氨比例越高,NO和CO2排放越少 D、NO和CO2直接排放会造成环境污染
A、H2燃烧的化学方程式为 B、由图2可知,分级燃烧能减少NO的排放 C、掺氨比例越高,NO和CO2排放越少 D、NO和CO2直接排放会造成环境污染 -
20、NaOH、是常见的碱。某同学归纳了碱的化学性质如图(“——”两端的物质能发生化学反应)。下列说法正确的是
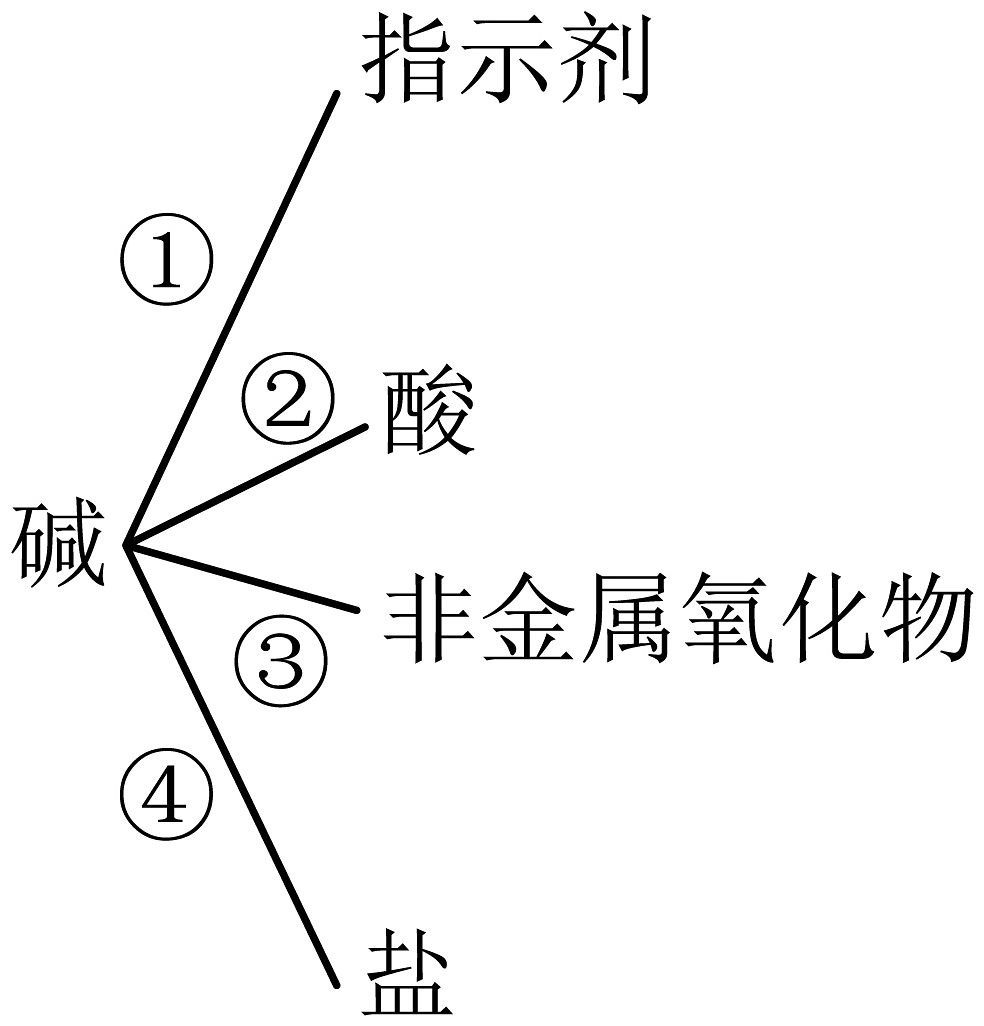 A、反应①一定不变色 B、反应②一定生成盐和水 C、反应③一定有明显现象 D、反应④一定生成白色沉淀
A、反应①一定不变色 B、反应②一定生成盐和水 C、反应③一定有明显现象 D、反应④一定生成白色沉淀