版本:
相关试卷
- 2017-2018学年九年级下学期科学开学考试模拟卷
- 2017-2018学年浙教版科学九年级下学期第三章第6节 健康生活 同步练习
- 2017-2018学年浙教版科学九年级下学期第一章第5节 遗传与进化 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第5节 生态系统的稳定性 同步练习
- 2017-2018学年浙教版科学九年级下学期第三章第5节 人的运动系统和保健 同步练习
- 2017-2018学年浙教版科学九年级下学期 第四章第4节 实现可持续发展 同步练习
- 2017-2018学年浙教版科学九年级下学期第一章第4节 生物的进化 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第4节 生态系统的结构和功能 同步练习
- 2017-2018学年浙版科学九年级下学期 第三章第4节 非传染性疾病 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第3节 生物群落 同步练习
-
1、我国化学家徐光宪应用并优化了“串级萃取理论”,一举攻克错、钕两种元素的分离难关。镨和钕属于不同元素的本质区别是 ( )A、质子数不同 B、中子数不同 C、电子数不同 D、相对原子质量不同
-
2、高岭土是一种含有铝元素的矿物质。下列有关铝元素符号的书写,正确的是( )A、Cl B、CL C、Al D、AL
-
3、为了探究氢氧化钡溶液和硫酸钠溶液反应后所得滤液X的成分,同学们做了以下实验:取50克滤液于烧杯中,先向烧杯中滴加溶质质量分数为6%的硫酸镁溶液20克,接着向烧杯中滴加稀硫酸。加入溶液的质量与烧杯内沉淀的质量关系如图所示。
 (1)、CD 段发生反应的化学方程式为。(2)、滤液X中含有的溶质是。(3)、滴加入30克稀硫酸时,烧杯中沉淀的质量: 的值为多少?(写出计算过程)
(1)、CD 段发生反应的化学方程式为。(2)、滤液X中含有的溶质是。(3)、滴加入30克稀硫酸时,烧杯中沉淀的质量: 的值为多少?(写出计算过程) -
4、 已知 受热易分解,各生成对应的两种氧化物。 的分解温度为66~68℃, CuCO3的分解温度为200~220℃。设固体的组成为 , 小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。请根据图示回答下列问题:
 (1)、写出CD段发生反应的化学方程式为。(2)、若将 24.0g剩余固体继续加热到更高的温度,发现固体质量少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式为。(3)、通过计算可得a:b=。
(1)、写出CD段发生反应的化学方程式为。(2)、若将 24.0g剩余固体继续加热到更高的温度,发现固体质量少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式为。(3)、通过计算可得a:b=。 -
5、某化学兴趣小组在实验室利用氯气与石灰乳 反应制取漂白粉:
已知漂白粉的有效成分为( 该兴趣小组设计了下列实验装置,进行如下实验:

请回答下列问题:
(1)、甲装置中发生如下反应用于制备氯气: 乙装置的作用是。(2)、丁装置的作用是。(3)、该兴趣小组用足量的浓盐酸与8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应, 则理论上最多可制得 Ca(ClO)2g。(4)、但小组成员发现,实际上产物中的质量明显小于理论值。为了探究其原因,小组成员查阅了相关资料得到:氯气和碱的反应为放热反应,温度较高时,氯气和碱还能发生如下反应: 为了提高 的产率,可对丙装置作适当改进。请你给出一种改进方法:。 -
6、氯化亚铜(CuCl)广泛应用于冶金、电镀、医药等行业。已知 CuCl 难溶于水和乙醇,在潮湿空气中易变质。CuCl的制备流程如下:

回答下列问题:
(1)、“滤液1”中除了 外,还存在较多的离子是。 (写离子符号)(2)、“操作 a”的名称是 , 本流程中可以循环利用的物质(水除外)是。(写化学式)(3)、 “反应”中产物除了CuCl,还有硫酸等,则该反应的化学方程式为。(4)、 可用“水洗”的原因是 , “醇洗”的目的是。(5)、 与足量NaCl经上述制备流程,可生成的 CuCl最多是g。 -
7、为探究CO2与NaOH 溶液发生的反应,某兴趣小组尝试用不同的方式进行实验。
【查阅资料】
Ⅰ.20℃时,几种物质在水中的溶解度见下表:
物质
溶解度/g
21.5
9.6
0.165
3.89
Ⅱ.本实验条件下, Na2CO3溶液和NaHCO3溶液的pH分别约为11.0和8.5。
【实验探究】
(1)、实验一:取一充满CO2的矿泉水瓶,加入一定量的水,立即拧紧瓶盖,振荡,发现瓶子变瘪,另取一相同的充满CO2的矿泉水瓶,向其中加入与水等体积的NaOH溶液,立即拧紧瓶盖,振荡,得到溶液X,此时观察到的现象是 , 实验中采用两只矿泉水瓶做对比实验的目的是。(2)、实验二:为检验( 与NaOH 溶液反应的产物,取实验一所得溶液X少许,向其中滴加 溶液,有白色沉淀产生,该反应的化学方程式为 , 实验中不宜将 溶液换成( 溶液的原因是。(3)、实验三:取实验一所得溶液X少许,向其中加入过量的 溶液,振荡,静置,取上层清液,滴入1滴酚酞试液,发现溶液呈色,证明溶液X中有NaOH剩余。实验中没有直接向少量溶液X中滴入酚酞试液,理由是。(4)、实验四:兴趣小组将持续通入一定浓度一定量的NaOH 溶液中,用数字化实验技术测定反应过程中溶液的pH变化结果如下图所示。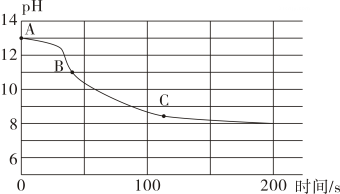
图中 BC段发生反应的化学方程式为。
-
8、一些氧化物和单质之间可发生如图所示的反应:

其中,氧化物(Ⅰ)是红棕色固体,氧化物(Ⅱ)、(Ⅲ)、(Ⅳ)在反应条件下都是气体。
(1)、 单质(Ⅲ)为; 氧化物(Ⅰ)为。(2)、反应①的化学方程式为。 -
9、稀薄燃烧发动机具有高效、经济、环保等优点,和普通汽车发动机对比如下:
发动机的类型
发动机混合气中汽油与空气的质量比
发动机运转的温度
尾气中CO的含量
尾气中 NOₓ的含量
普通发动机
1:15
较高
较高
较高
稀薄燃烧发动机
1:40
较低
较低
较低
请回答下列问题:
(1)、为何稀薄燃烧发动机产生的尾气中 CO含量会减少?。(2)、已知汽车尾气中的氮氧化物(以NOₓ表示)是氮气与氧气在高温下反应产生的。试解释为何稀薄燃烧发动机产生的尾气中NOₓ含量也会减少?。
(3)、某种减少尾气中CO与NOₓ的方法是使用催化转换器,转换过程中发生反应的化学方程式为: (未配平)。若x=1.5,则化学方程式中CO2与N2的系数之比为。 -
10、以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图,下图为铁的价类图。

请回答:
(1)、A点表示的物质所属的物质类别是。(2)、请写出B 点表示的物质化学式。(3)、已知C点表示的化合物在常温下能与氧气、水发生化合反应生成D,写出相应的化学方程式。 -
11、 一瓶不纯的K2CO3粉末, 所含杂质可能是KNO3、Ca(NO3)2、KCl、CuCl2、Na2CO3中的一种或几种。为确定其成分,进行如下实验: (1)取少量该粉末于烧杯中,加入适量蒸馏水,充分搅拌,得无色澄清溶液。 (2)取上述无色溶液少许于试管中,滴加 溶液有沉淀生成,再加入足量的稀HNO3 , 沉淀部分溶解。 (3)另称取1.38g该粉末于烧杯中,加入蒸馏水溶解,再加入足量的BaCl2溶液,充分反应后生成1.97g白色沉淀。下列说法正确的是()A、杂质中一定含有KCl, 可能含有 Ca(NO3)2 、KNO3 B、杂质中 KCl和CuCl2至少含有一种 C、杂质中一定含有 KCl、Na2CO3 D、杂质中一定含有KCl, 可能含有Na2CO3、 KNO3
-
12、如图是几种的溶解度曲线。下列说法正确的是()
 A、40℃将35g食盐溶于100g水,降温至0℃时,可析出氯化钠晶体 B、20℃时,硝酸钾饱和溶液的质量分数是31.6% C、60℃时,200水中溶解80g硫酸铜达到饱和,当降温至30℃时,可析出30g硫酸铜体晶体 D、30℃时,将35g硝酸钾和35g食盐同时溶于100水中,蒸发时先析出的是氯化钠晶体
A、40℃将35g食盐溶于100g水,降温至0℃时,可析出氯化钠晶体 B、20℃时,硝酸钾饱和溶液的质量分数是31.6% C、60℃时,200水中溶解80g硫酸铜达到饱和,当降温至30℃时,可析出30g硫酸铜体晶体 D、30℃时,将35g硝酸钾和35g食盐同时溶于100水中,蒸发时先析出的是氯化钠晶体 -
13、根据下列实验操作及实验现象,所得实验结论正确的是()
选项
实验操作
实验现象
实验结论
A
在某氢氧化钠溶液样品中,加入足量的氯化钙溶液,过滤,在滤液中滴入2滴酚酞试液
产生白色沉淀,酚酞不变红
该氢氧化钠溶液一定全部变质
B
将浓盐酸和大理石反应放出的气体通入澄清石灰水
石灰水始终未浑浊
该石灰水一定变质
C
向稀盐酸中加入一定量的氢氧化钠固体
溶液温度升高
氢氧化钠与盐酸一定发生了化学反应
D
将充满二氧化碳气体的试管倒扣在盛有氢氧化钠溶液的水槽中
试管内液面上升
二氧化碳与氢氧化钠一定发生了反应
A、A B、B C、C D、D -
14、下列图像能正确反映其对应的实验操作的是()
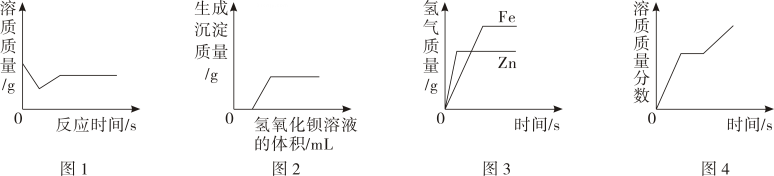 A、图1:向饱和的石灰水中加入少量生石灰 B、图2:向一定量盐酸和硫酸铜的混合溶液不断滴入氢氧化钡溶液至过量 C、图3:过量的锌和铁与等量的溶质质量分数相同的稀硫酸反应 D、图4:将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直到有晶体析出
A、图1:向饱和的石灰水中加入少量生石灰 B、图2:向一定量盐酸和硫酸铜的混合溶液不断滴入氢氧化钡溶液至过量 C、图3:过量的锌和铁与等量的溶质质量分数相同的稀硫酸反应 D、图4:将一定质量的硝酸钾不饱和溶液恒温蒸发水分,直到有晶体析出 -
15、向硫酸亚铁、硫酸铜的混合溶液中投入一些锌粉,完全反应后得到一些固体沉淀。向滤出的沉淀中加入少量稀硫酸,有气泡产生。下列对固体沉淀成分的判断正确的是()A、一定含有锌、铁,可能含有铜 B、一定含有锌、铜,可能含有铁 C、一定含有铁、铜,可能含锌 D、一定含有铁,可能含有锌、铜
-
16、某溶液含有 Mg2+、Al3+、Cl-、SO42-四种离子, 其中Mg2+、Al3+、Cl-的离子个数比 1:1:1, 则该溶液中 Al3+、SO42-离子个数比为()A、1:1 B、1:2 C、2:3 D、1:3
-
17、将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如图所示。下列是从图中所获取的信息,其中不正确的是()
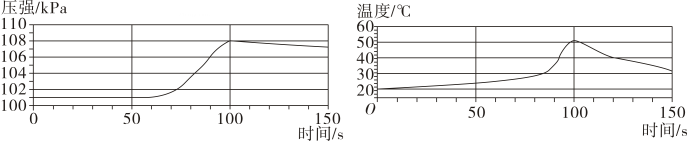 A、反应过程中有热量放出 B、0-50s, 发生的反应为 C、50s时, 溶液中的溶质为 AlCl3 D、100-140s,压强减小是因为温度降低
A、反应过程中有热量放出 B、0-50s, 发生的反应为 C、50s时, 溶液中的溶质为 AlCl3 D、100-140s,压强减小是因为温度降低 -
18、我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:原子利用率=目标生成物的质量参加该反应所有反应物的总质量 ×100%。在“绿色化学工艺”中,理想状态是原子利用率为100%。在用丙炔(C3H4)合成甲基丙烯酸甲酯(C5H8O2)的过程中,欲使原子利用率达到100%,还需要其他的反应物有()A、CO和CH3OH B、CH3OH 和 H2 C、CO2和H2O D、H2和CO2
-
19、下列各组物质的溶液,需要另加其他试剂才能区别的是()A、BaCl2、 CuSO4、NaOH、NaCl B、FeCl3、NaOH、H2SO4、Ba(NO3)2 C、MgCl2、NaOH、HCl、Na2SO4 D、Na2SO4、BaCl2、K2CO3、NaNO3
-
20、已知硒的原子序数为34,质子数与中子数之和为 79.下列有关硒原子的说法中,不正确的是()A、核外电子数为 34 B、核电荷数为 79 C、质子数为34 D、中子数为 45