相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、下列概念之间存在如图所示“并列”关系的是

选项
A
B
C
D
概念
单质
酸溶液
不饱和溶液
氧化反应
化合物
酸性溶液
稀溶液
化合反应
A、A B、B C、C D、D -
2、在给定条件下,下列物质间的转化能实现的是A、 B、 C、 D、
-
3、锂电池应用广泛。锂在元素周期表中的信息和锂原子的结构示意图如图所示。下列叙述正确的是
 A、锂的原子序数为3 B、锂的相对原子质量为6.941g C、锂原子中的核外电子数为1 D、锂原子在化学反应中容易得到电子
A、锂的原子序数为3 B、锂的相对原子质量为6.941g C、锂原子中的核外电子数为1 D、锂原子在化学反应中容易得到电子 -
4、富氢水是指含有氢气的水。镁与水反应可生成氢气,镁储氢、释氢的过程如图所示。完成下面小题。
 (1)、下列化学用语表达的意义正确的是A、H2—2个氢原子 B、H+——氢元素的化合价为 C、2OH-——2个氢氧根离子 D、H2O——水由氢原子和氧原子构成(2)、镁与水反应的化学方程式为 , 该反应的类型属于A、化合反应 B、分解反应 C、置换反应 D、复分解反应(3)、下列叙述错误的是A、富氢水中含有氢分子 B、常温常压下氢气易溶于水 C、镁和稀盐酸反应可生成氢气 D、镁是一种储氢材料
(1)、下列化学用语表达的意义正确的是A、H2—2个氢原子 B、H+——氢元素的化合价为 C、2OH-——2个氢氧根离子 D、H2O——水由氢原子和氧原子构成(2)、镁与水反应的化学方程式为 , 该反应的类型属于A、化合反应 B、分解反应 C、置换反应 D、复分解反应(3)、下列叙述错误的是A、富氢水中含有氢分子 B、常温常压下氢气易溶于水 C、镁和稀盐酸反应可生成氢气 D、镁是一种储氢材料 -
5、下列物质不属于溶液的是A、泥浆水 B、食盐水 C、蔗糖水 D、苏打水
-
6、氮化镓()可用于制造太阳能电池。下列叙述正确的是A、镓属于非金属元素 B、氮化镓属于混合物 C、氮化镓属于复合材料 D、太阳能属于新能源
-
7、
小明在阅读相关资料时,发现二氧化氮具有助燃性。他决定利用如下实验进行探究。

【提出问题】二氧化氮是否具有助燃性?
【查阅资料】
①蓝色的硝酸铜固体在加热条件下分解,化学方程式为。
②通常状况下,是一种红棕色气体,相同状况下,其密度大于氧气的密度,在低于室温时变成液态。
【实验过程】
(1)实验装置如图1,实验现象:试管内蓝色固体逐渐变成________色,有红棕色气体生成,带火星的木条________。
【实验结论】二氧化氮具有助燃性。
【反思与评价】
(2)小刚认为小明的实验不能证明具有助燃性,其理由是________。小刚认为利用如下补充实验可以证明具有助燃性。
【实验改进】
(3)
实验操作
实验现象
实验结论
步骤①:如图2,在试管和集气瓶之间连接冷却装置,重新进行加热硝酸铜的实验
带火星的木条复燃
硝酸铜分解产物中有。
步骤②:取出图2中型管,恢复到室温,待型管内充满红棕色气体时,将带火星的木条伸入型管中
________。
具有助燃性
【反思与评价】
(4)步骤①中在试管和集气瓶之间连接冷却装置,冷却装置的作用是________。
(5)已知镁在二氧化氮气体中燃烧生成氧化镁和氮气,写出该反应的化学方程式为________。由此,你对燃烧的新认识是________。
-
8、
化学兴趣小组的同学为探究某塑料的组成元素,设计了实验Ⅰ和实验Ⅱ,按以下实验装置进行探究,回答下列问题。
【资料】①塑料可燃,可能由、、元素中的一种或几种组成;②无水遇水变蓝色。
Ⅰ.制取氧气:

(1)图中标有字母的仪器名称:________。
(2)实验室用高锰酸钾制取氧气并收集干燥的氧气,所需的收集装置________(填字母序号),写出该反应的化学反应方程式________。
(3)实验室选择大理石和稀盐酸制取二氧化碳,为了得到较多的二氧化碳气体,并使装置可以较长时间的连续使用,上述装置中你认为最优的发生装置是________(填字母序号)。
Ⅱ.组成探究:
(4)定性检测:

实验操作
实验现象
实验结论
连接装置,检查气密性,装入试剂并按如图进行实验。通入 , 一段时间后,点燃处酒精灯。
装置中无水变________色。
塑料燃烧产物中有
装置中________。
塑料燃烧产物中有
由上述实验可得出结论:该塑料中一定含有碳元素和氢元素。
(5)定量测定:为进一步确定该塑料的元素组成,将该塑料在足量中完全燃烧,共生成了和 , 依据质量守恒定律,可推测该塑料中含有氢元素的质量为________ , 含碳元素质量为________ , 其中氢原子和碳原子的个数比为________。
-
9、已知、、、、、是初中化学中常见的六种物质。其中是一种黑色固体单质,与 , 与组成元素分别相同,、、常温常压下均为气体。它们之间的关系如图所示(“→”表示物质间的转化关系。“—”表示相连的物质能相互反应部分反应物、生成物和反条件已略去)。
 (1)、写出物质的化学式:________。(2)、属于________(填基本反应类型)反应。(3)、写出的化学方程式:________。
(1)、写出物质的化学式:________。(2)、属于________(填基本反应类型)反应。(3)、写出的化学方程式:________。 -
10、中国空间站的建成、神舟系列载人飞船的成功发射,标志着我国航天科技水平已处于世界领先地位。航空航天科学研究涉及许多化学知识。(1)、硅是制造空间站太阳能电池板的核心材料。硅元素属于________(填“金属”或“非金属”)元素。(2)、我国载人航天环控生保系统已实现由“补给式”向“再生式”的根本转换,空间站氧气资源100%再生。环控生保系统利用循环水电解制氧气,其反应的化学方程式为。电解水产生的氢气与宇航员呼出的二氧化碳在特殊反应器中进行催化反应,反应原理为 , 从而降低舱内二氧化碳的浓度,X的化学式为。(3)、铁酸镍()可将航天员呼出的废气转化为航天员需要的气体,中的化合价为 , 则的化合价为________。
-
11、水是生态之基、生产之要、生命之源。(1)、水是一种常用的溶剂。生理盐水是医疗上常用的一种溶液,其溶质是(填化学式),生理盐水可用于医疗注射。一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,其原因是。(2)、目前很多场所选择使用直饮水,某品牌直饮水机工作流程如下图所示:

①活性炭的作用是。
②滤膜是直饮水机的核心技术,能截留水中粒子直径大于滤膜孔隙的粒子,其原理与化学实验操作中的操作类似。
-
12、在宏观、微观和符号之间建立联系是化学学科的特点。镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠流来流去。图①是镓()的原子结构示意图,请回答以下问题:
 (1)、镓元素在化学反应中容易(填“失去”或“得到”)电子,形成(填化学符号)。(2)、图②所示、、、四种粒子中,共有种元素,其中与镓原子具有相似的化学性质的是(填字母序号,下同),达到相对稳定结构的是。(3)、我国科研团队发现了一种新的光催化反应路线,可在室温下驱动甲烷()、一氧化碳和水合成乙酸(),其微观反应示意图如图所示。
(1)、镓元素在化学反应中容易(填“失去”或“得到”)电子,形成(填化学符号)。(2)、图②所示、、、四种粒子中,共有种元素,其中与镓原子具有相似的化学性质的是(填字母序号,下同),达到相对稳定结构的是。(3)、我国科研团队发现了一种新的光催化反应路线,可在室温下驱动甲烷()、一氧化碳和水合成乙酸(),其微观反应示意图如图所示。
该反应的化学方程式为________。
-
13、化学用语是国际通用语言,是学习化学的重要工具。用化学用语填空。(1)、两个氢原子________;(2)、两个氮分子________;(3)、三个氢氧根离子________;(4)、氯化铁________。
-
14、下列有关碳和碳的化合物说法正确的是A、“碳达峰”、“碳中和”,其中“碳”指的主要是碳单质 B、室内放盆水可以防止一氧化碳中毒 C、用于灭火既利用了其化学性质又利用了其物理性质 D、向充满二氧化碳的软塑料瓶中加水振荡,瓶子变瘪,说明二氧化碳与水发生了化学反应
-
15、掌握实验安全操作常识,可防止对人身或财物造成损害。下列归纳总结中不科学的是A、点燃氢气等可燃性气体前一定要检验其纯度 B、给试管里的液体加热时,试管口不能对着自己或他人 C、可用已经燃着的酒精灯去点燃另一个酒精灯 D、实验室用高锰酸钾制取氧气,结束时先将导管从水槽中取出
-
16、2024年10月30日,搭载神舟十九号载人飞船的长征二号F遥十九运载火箭在酒泉发射中心发射成功,火箭在升空过程中发生的下列变化中属于化学变化的是A、导流槽内的水受热汽化 B、整流罩脱落 C、隔热材料熔化 D、火箭点火
-
17、漂白粉是以次氯酸钙为主要有效成分的物质,制备次氯酸钙的原理可表示为2Ca(OH)2+2Cl2=Ca(ClO)2+X+2H2O,则X的化学式是:A、CaO B、CaCl2 C、CaH2 D、Ca(ClO3)2
-
18、图是甲、乙两物质在一定条件下反应的示意图,下列说法不正确的是
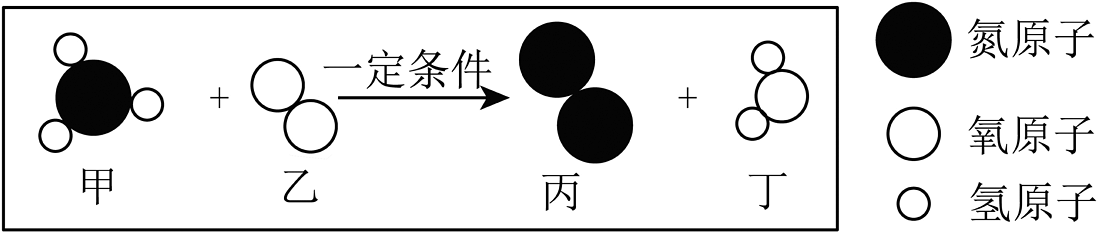 A、该反应前后原子数目不变 B、该反应前后共有两种化合物 C、参加反应的甲和乙分子个数比为 D、反应生成的丙和丁质量比为
A、该反应前后原子数目不变 B、该反应前后共有两种化合物 C、参加反应的甲和乙分子个数比为 D、反应生成的丙和丁质量比为 -
19、金属材料发展史是人类不断突破技术瓶颈、推动文明进步的缩影。古代青铜铁器、工业时代钢铁与铝、现代高性能合金,每一次材料的革新都深刻影响了社会生产力和科技发展。(1)、商代已掌握青铜铸造技术,而铁器直至春秋才普及。请设计实验验证铜、铁的金属活动性顺序,写出操作步骤、现象及结论:________。(2)、用含Fe2O380%的赤铁矿200吨与CO高温反应炼铁,理论上可制得铁多少吨?(假设杂质不参与反应;根据化学方程式计算,写出过程)(3)、钛合金制品放在海水中数年,取出后仍光亮如新。由此可知钛合金具有的化学性质是________(写出一点即可)。
-
20、硫化钠(Na2S)是一种重要的化工原料,广泛应用于矿业、造纸、化学合成等工业。以Na2SO4为原料制备Na2S的部分流程如图所示。

【查阅资料】:H2S水溶液性质与盐酸相似,属于酸,直接排放会污染环境。
(1)、实验前需将Na2SO4固体研磨至0.2mm,其目的是________。(2)、设备1中,通氢气反应前需先通氮气,原因是________。(3)、不同催化剂、不同温度对制备Na2S反应转化率的影响不同。结合图,应选择的催化剂为 , 温度为℃。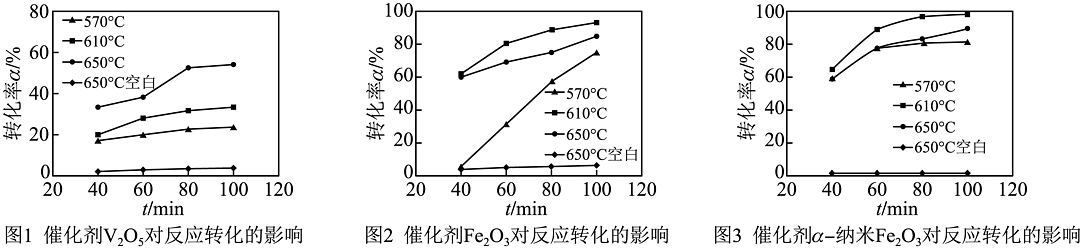 (4)、设备2中,NaOH溶液与H2S发生反应的化学方程式为 , 该反应的基本反应类型为反应。(5)、一定温度下,Na2S溶液经过蒸发浓缩形成饱和溶液,继续恒温蒸发会有Na2S晶体析出,在结晶过程中溶液的溶质质量分数________(选填“变大”“变小”或“不变”)。(6)、用煤粉与Na2SO4在900~1200℃煅烧也可以制备Na2S,其主要反应的化学方程式是2C+Na2SO4Na2S+2CO2↑,相较于上述的H2催化制Na2S生产工艺,该工艺的缺点是________(写出一点即可)。
(4)、设备2中,NaOH溶液与H2S发生反应的化学方程式为 , 该反应的基本反应类型为反应。(5)、一定温度下,Na2S溶液经过蒸发浓缩形成饱和溶液,继续恒温蒸发会有Na2S晶体析出,在结晶过程中溶液的溶质质量分数________(选填“变大”“变小”或“不变”)。(6)、用煤粉与Na2SO4在900~1200℃煅烧也可以制备Na2S,其主要反应的化学方程式是2C+Na2SO4Na2S+2CO2↑,相较于上述的H2催化制Na2S生产工艺,该工艺的缺点是________(写出一点即可)。