相关试卷
- 湖南省长沙市2016-2017学年九年级化学一模考试试卷
- 广东省东莞市中堂星晨学校2016-2017学年九年级化学一模考试试卷
- 广东省茂名高州市东岸中学2016-2017学年九年级化学一模考试试卷
- 广东省广州市花都区2016-2017学年九年级化学一模考试试卷
- 广西柳州市柳南区2014-2015学年九年级化学一模考试试卷
- 北京市西城区2017—2018学年九年级上学期化学期末考试试卷
- 北京市海淀区2017-2018学年九年级上学期化学期末考试试卷
- 北京市朝阳区2017-2018学年九年级上学期化学期末考试试卷
- 北京市丰台2017-2018学年九年级上学期化学期末考试试卷
- 广东省深圳市罗湖区2017-2018学年九年级上学期化学期末考试试卷
-
1、下列物质属于氧化物的是A、O3 B、KMnO4 C、H2O D、NaCl
-
2、化学是一门以实验为基础的科学,下列实验操作正确的是A、
 加热液体
B、
加热液体
B、 读取液体体积
C、
读取液体体积
C、 滴加液体
D、
滴加液体
D、 倾倒液体
倾倒液体
-
3、我国近代化学先驱徐寿创造了部分元素的汉语名称。下列元素符号书写错误的是A、锰(Mn) B、钙(Ca) C、锌(ZN) D、钠(Na)
-
4、保护环境,人人有责。下列做法不利于环境保护的是A、公交出行 B、焚烧垃圾 C、植树造林 D、人走电断
-
5、下列图标是我国“国家节水标志”的是A、
 B、
B、 C、
C、 D、
D、
-
6、下列习俗活动中涉及化学变化的是A、遍插茱萸 B、登高远眺 C、酿菊花酒 D、采中草药
-
7、为测定某黄铜(铜、锌合金)中铜的质量分数,某同学取 20g 黄铜样品放入盛有 200g 稀盐酸的烧杯中,恰好完全反应,测得烧杯中剩余物质的总质量为219.8g,试计算:(1)、生成氢气的质量g;(2)、该黄铜样品中铜的质量分数。(写出计算过程)
-
8、小明同学在学完合金的知识后,知道了生活中常见的不锈钢中除了含有铁,还含有 金属铬(Cr)。铬与常见的铁和铜相比,金属活动性如何呢?他决定对 Fe、Cu、Cr 三种金属的活动性进行探究。
【知识回顾】铁是一种比较活泼的金属,请写出铁与稀硫酸反应的化学方程式。
【查阅资料】铬是一种银白色金属,能与稀硫酸反应生成能溶于水的 CrSO4并放出氢气。
【猜想与假设】根据教材中常见金属的活动性顺序和查阅的资料,他对以上三种金属的活动性作出了合理的猜想:
猜想①Cr > Fe > Cu;
猜想②。
【实验探究】把用砂纸打磨过的铁片和铬片分别放入等量等浓度的稀硫酸中,观察到的现象,证明了猜想①成立。
【实验反思】经过分析,他发现用铬片、FeSO4溶液和 , 通过实验探究也能判断Fe、Cu、Cr 三种金属的活动性顺序。
【拓展迁移】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤渣中滴加稀盐酸,有气泡产生,则滤渣中一定含有的物质是 , 滤液中可能含 有的物质是。
-
9、某化学兴趣小组的同学利用下列实验装置,开展O2和CO2的实验室制取和有关性质的研究,请结合下列实验装置,回答有关问题。

(1)写出图中标有序号的仪器名称:①。
(2)实验室可用B和D装置制取并收集二氧化碳,写出反应的化学方程式:。
若实验室用高锰酸钾制取较纯净的氧气,可选用的发生装置和收集装置为 , 写出反应的化学方程式:。若用G装置盛满水收集氧气,则气体应从(填“a”或“b”)端通入。
(3)细铁丝在H装置中燃烧,可观察到的现象是。
(4)C装置与B装置相比,其优点是。
-
10、甲缩醛如果混入汽油中,易造成汽车线路漏油,还会挥发有害气体,污染环境,影响人体健康。甲缩醛的化学式为。请计算:(1)、甲缩醛是由种元素组成;(2)、甲缩醛中碳、氢、氧三种元素的质量比是;(3)、152g甲缩醛中氧元素的质量是。
-
11、在宏观、微观和符号之间建立联系是化学学科的重要思维方式.根据下列粒子结构示意图,回答问题:
 (1)、上述示意图中,共包含种元素,它们之间的本质区别是不同,属于非金属元素的有种。(2)、A、B、C、E中属于阴离子的是(填离子符号)。(3)、若D表示某元素的原子,则m= , 该粒子在化学变化中容易(选填“得到”或“失去”)电子。(4)、画出核外电子排布与E相同的原子结构示意图。(5)、B所属元素与D所属元素组成的化合物是由离子构成的,这个化合物的符号为。
(1)、上述示意图中,共包含种元素,它们之间的本质区别是不同,属于非金属元素的有种。(2)、A、B、C、E中属于阴离子的是(填离子符号)。(3)、若D表示某元素的原子,则m= , 该粒子在化学变化中容易(选填“得到”或“失去”)电子。(4)、画出核外电子排布与E相同的原子结构示意图。(5)、B所属元素与D所属元素组成的化合物是由离子构成的,这个化合物的符号为。 -
12、用恰当的化学用语填空.(1)、2个氮原子;(2)、3个亚铁离子;(3)、2个硫酸根离子;(4)、氩气。
-
13、一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法不正确的是
物质
X
Y
Z
W
反应前质量/g
10
3
90
0
反应后质量/g
3.2
3
待测
3.2
A、W可能是单质 B、Y可能是催化剂 C、该反应生成物是两种 D、反应后Z物质的质量为86.4g -
14、苏丹红一号是一种增色添加剂,可能使人体致癌,其化学式为 , 下列关于它的说法错误的是A、它的分子中,碳、氢、氮、氧原子个数比为16:12:2:1 B、它所含元素中,质量分数最高的是碳元素 C、它所含碳、氢、氮、氧元素的质量比为48:3:7:4 D、它是一种氧化物
-
15、下列关于碳和碳的氧化物的说法不正确的是A、金刚石、石墨物理性质不同是因为碳原子的排列方式不同 B、CO极易与血液中的血红蛋白结合 C、CO2含量过多会导致温室效应 D、金刚石、石墨和都是碳原子构成的单质
-
16、根据如图所示的实验,下列说法正确的( )A、②③对比说明物质燃烧需要与空气接触
 B、检验甲试管内的气体可以用燃着的木条
B、检验甲试管内的气体可以用燃着的木条 C、该实验说明二氧化碳能使紫色石蕊溶液变红
C、该实验说明二氧化碳能使紫色石蕊溶液变红 D、该实验的现象是产生淡蓝色火焰,放出热量,生成有刺激性气味的气体
D、该实验的现象是产生淡蓝色火焰,放出热量,生成有刺激性气味的气体
-
17、
某化学兴趣小组阅读课外资料得知:过氧化氢制氧气除了可用二氧化锰作为催化剂,还可以用氧化铜、马铃薯、铁锈、红砖粉末等物质作为催化剂,于是他们想检验生活中马铃薯是否能作为过氧化氢分解的催化剂。
【提出问题】马铃薯是否能作为过氧化氢分解的催化剂?
【查阅资料】马铃薯中含有过氧化氢酶,过氧化氢酶对过氧化氢的分解起催化作用。
【设计实验】
(1)化学兴趣小组的同学设计了一系列实验:
实验
实验步骤
实验现象
Ⅰ
取5%的过氧化氢溶液5mL,用带火星的木条伸入试管口
木条不复燃
Ⅱ
取5%的过氧化氢溶液5mL,加入0.5g马铃薯切成豆粒大
木条复燃
Ⅲ
待实验Ⅱ中没有气泡放出后,继续加入5%的过氧化氢溶液
木条________
(2)写出实验Ⅱ反应的符号表达式________;
(3)设计实验Ⅰ的目的是与实验Ⅱ________;
【得出结论】马铃薯能作为过氯化氢分解的催化剂。
【评价改进】
(4)大家认为此实验结论不严谨。若要确定该实验结论是否正确,还需要再增加一个实验,探究马铃薯的________在化学反应前后是否发生变化。
【实验拓展】某小组同学设计了如图所示装置,定量测定对比马铃薯与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关数据见表:
实验编号
3%过氧化氢溶液的体积
其他物质质量
待测数据
Ⅰ
20mL
马铃薯0.5g
Ⅱ
20mL
二氧化锰0.5g

(5)上述实验中“待测数据”是指________。
(6)若则可得出的结论是________。
【实验反思】
(7)影响化学反应速率的因素除了催化剂的种类外,还可能与下列哪些因素有关?______。
A. 催化剂的颗粒大小 B. 温度 C. 反应物的浓度 -
18、下列化学现象的描述,正确的是A、红磷在空气中燃烧,产生大量白色烟雾 B、硫在氧气中燃烧,发出微弱的淡蓝色火焰 C、木炭在氧气中燃烧比在空气中燃烧更旺,发出白光,并放出热量 D、铁丝在氧气中燃烧,火星四射,生成黑色的四氧化三铁
-
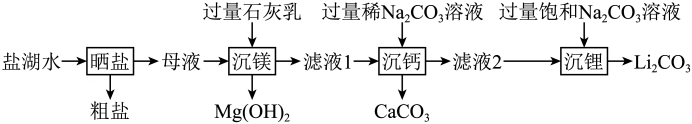
19、碳酸锂 是锂电池生产的核心原料,可以用盐湖水(含有 LiCl、NaCl、MgCl2)为原料进行制备。(1)、化学小组的同学设计的制备 实验流程如下:
请回答下列问题:
①盐湖水“晒盐”得到粗盐,是利用(填“蒸发结晶”或“降温结晶”)的方法实现的。
②“沉镁”时生成 的化学方程式为。
③“沉钙”时加入的是稀 溶液且在常温下进行过滤,而“沉锂”时加入的是饱和) 溶液,且加热到80~90℃后再进行过滤。请结合上述实验流程和 的溶解度曲线(如图),解释“沉钙”和“沉锂”时所用 溶液浓度不同和过滤时温度不同的原因是
 (2)、化学小组的同学为测定某 样品(杂质为 NaCl)中 的质量分数,称取 样品16g加入烧杯中,再加入146g溶质质量分数为10%的稀盐酸,恰好完全反应。(已知: , LiCl易溶于水)
(2)、化学小组的同学为测定某 样品(杂质为 NaCl)中 的质量分数,称取 样品16g加入烧杯中,再加入146g溶质质量分数为10%的稀盐酸,恰好完全反应。(已知: , LiCl易溶于水)请回答下列问题:
①恰好完全反应时,生成CO2的质量为g。(只填计算结果,精确至0.1g)
②恰好完全反应时,烧杯中溶液里含有的溶质为(填化学式)。
③计算该样品中 的质量分数。(写出计算过程,结果精确至0.1%)
-
20、化学小组的同学利用实验室制取氧气以及工业炼铁的化学原理进行实验探究。请根据题目要求,回答下列问题:(1)、H2O2制取氧气的实验原理。
①用H2O2溶液(MnO2作催化剂)制氧气的化学方程式为。
②收集氧气时可以用(填“向上”或“向下”)排空气法。(2)、催化剂对H2O2分解的影响。小组同学设计的实验装置如图1所示,用电子秤称量0.04g、0.08g、0.12g的MnO2粉末,分别加入三只锥形瓶中,用注射器各量取8mL 3%的) 溶液,连接装置,将H2O2溶液注入锥形瓶中,用压强传感器测量各锥形瓶中压强,压强随时间(前100s)的变化曲线如图2。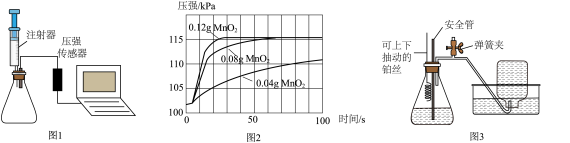
①根据图2提供的信息,从控制合适的反应速率和节约试剂的角度分析,催化分解8mL3%的 溶液制氧气时,MnO2的最佳用量为(填“0.04g”“0.08g”“0.12g”之一)。
②MnO2催化H2O2制氧气时,氧气的最终产量与MnO2的用量(填“有关”或“无关”)。
③金属铂也可以催化 H2O2制氧气。小组同学设计如图3所示装置制取氧气,实验过程中,若观察到安全管内液面不断上升,说明锥形瓶内压强过大,此时可采取的合理安全措施是(写出两条即可)。
(3)、用CO(含少量CO2和水蒸气)测定某Fe3O4样品(杂质为固体且不反应)中: 的质量分数。实验装置如图所示,检查装置的气密性,进行实验。(假设发生的化学反应都充分反应)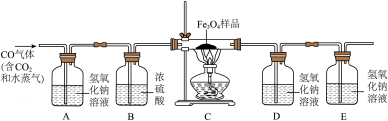
①装置B的作用是。
②在装置C 的硬质玻璃管中加入该 样品15g,充分反应后继续通CO至硬质玻璃管冷却,测得装置A质量增加2.2g,装置D质量增加8.8g,此时装置C的硬质玻璃管中固体的总质量为g(精确至0.1g),该 样品中 的质量分数为(精确至0.1%)。
③从环保角度考虑,该实验装置存在的不足之处是。