相关试卷
-
1、写出下列各符号的意义或根据要求写出对应的符号。(1)、Ca , , ;3Ni。(2)、2个金原子;H2O , ;2N2。(3)、8个碳酸分子;铁离子;3个硫离子;5个铵根离子。
-
2、用图1所示实验装置测定空气中氧气的含量,图2是实验过程中集气瓶内的气压变化曲线。下列说法错误的是
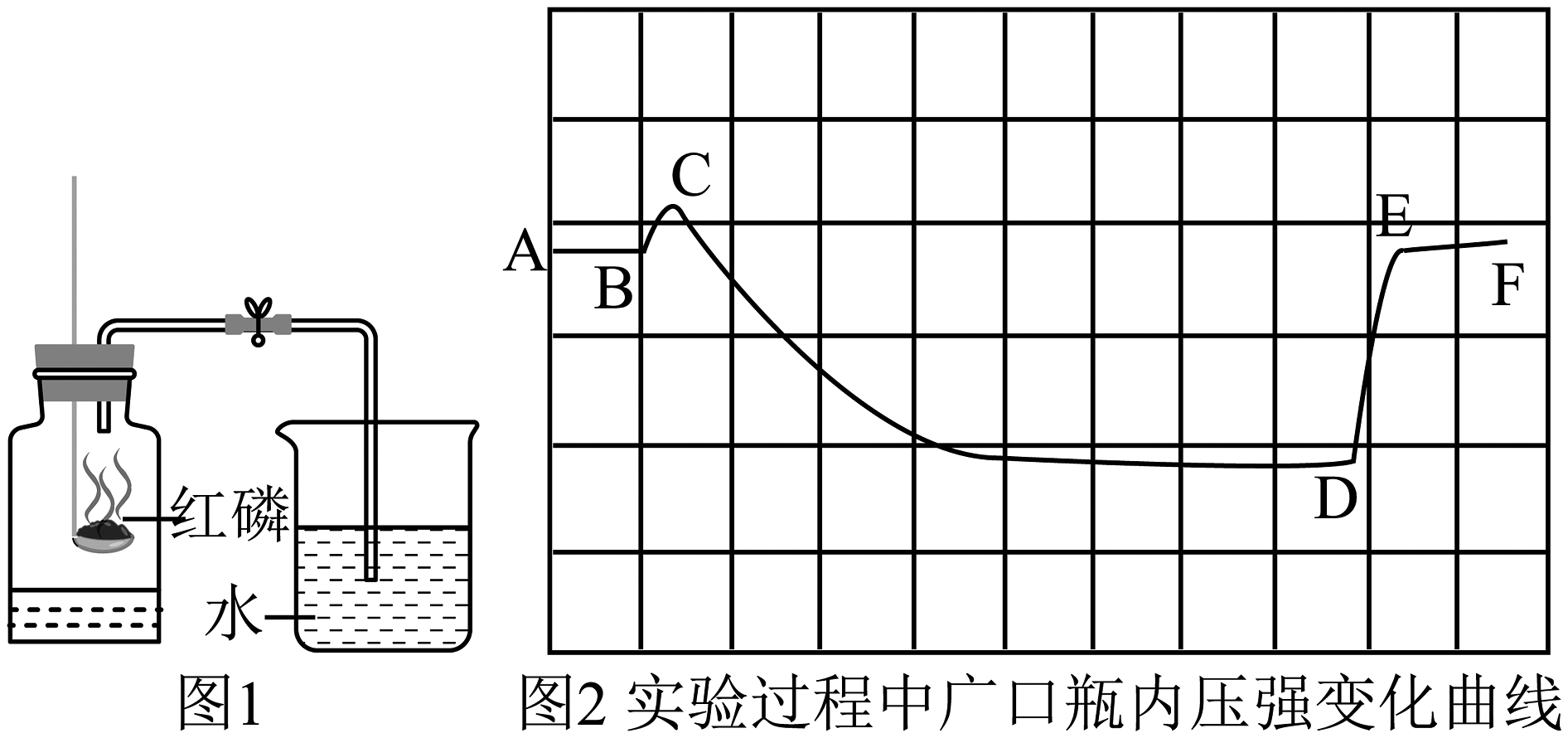 A、图1中红磷燃烧的现象:产生黄色火焰,放热,有大量白烟 B、图2中BC段气压变化的原因是烧杯中水进入集气瓶 C、图2中CD段气压变化的原因是瓶中氧气被消耗、温度降低至室温 D、实验前集气瓶内空气体积为V,烧杯中水的体积为V1 , 实验后烧杯中剩余水的体积为V2 , 计算空气中氧气体积分数的表达式为:
A、图1中红磷燃烧的现象:产生黄色火焰,放热,有大量白烟 B、图2中BC段气压变化的原因是烧杯中水进入集气瓶 C、图2中CD段气压变化的原因是瓶中氧气被消耗、温度降低至室温 D、实验前集气瓶内空气体积为V,烧杯中水的体积为V1 , 实验后烧杯中剩余水的体积为V2 , 计算空气中氧气体积分数的表达式为: -
3、汽车尾气的催化转化器可有效降低污染物的排放,反应的微观示意图如下,下列说法正确的是
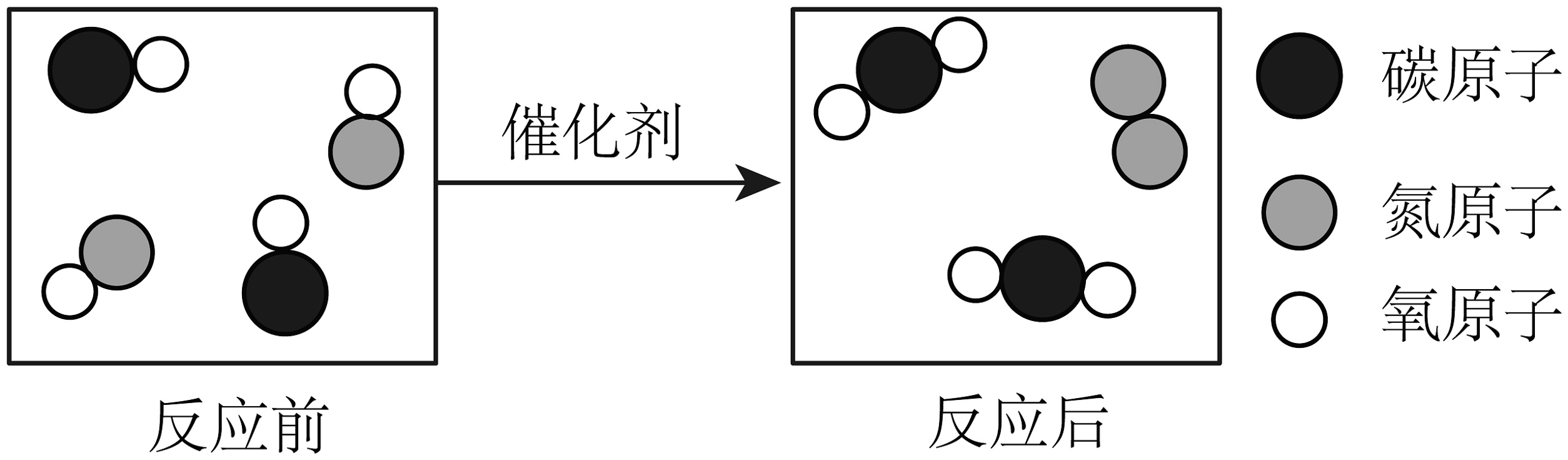 A、反应前后元素化合价均不变 B、反应前后分子种类没有发生变化 C、反应前后元素的种类不变 D、反应前后原子的数目改变
A、反应前后元素化合价均不变 B、反应前后分子种类没有发生变化 C、反应前后元素的种类不变 D、反应前后原子的数目改变 -
4、右图是电解水实验的示意图,下列说法正确的是
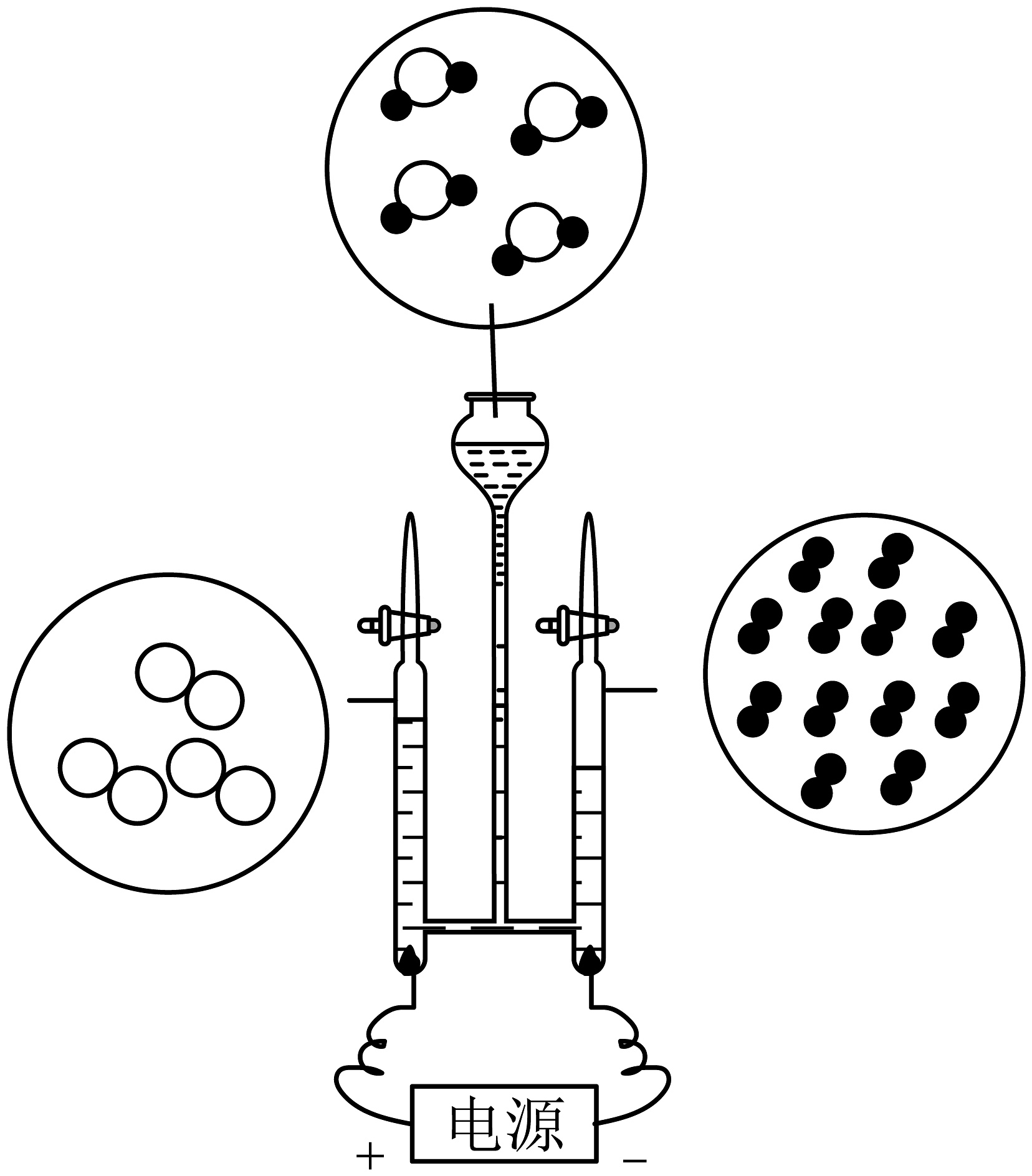 A、图中
A、图中 表示的是H2
B、该实验说明水由氢气和氧气组成
C、负极与正极产生气体的质量比是2:1
D、该化学反应中最小的微观粒子是氢原子、氧原子
表示的是H2
B、该实验说明水由氢气和氧气组成
C、负极与正极产生气体的质量比是2:1
D、该化学反应中最小的微观粒子是氢原子、氧原子
-
5、“艾灸”是中华医学的瑰宝,利用艾草燃烧放出的热量刺激体表特定部位,达到防病治病的目的。艾草含有的黄酮素(C15H10O2)具有很高的药用价值。下列有关说法中不正确的是A、黄酮素中氢、氧元素的质量比为5:1 B、黄酮素中氢元素的质量分数最小 C、黄酮素的相对分子质量为222 D、黄酮素完全燃烧生成CO2和H2O
-
6、下列对宏观事实的微观解释不正确的是A、夏天晒衣服比冬天干的更快——温度升高,分子运动速度加快 B、温度升高时,酒精温度计示数变大——温度升高,分子体积变大 C、氧气和液氧都具有助燃性——同种分子,化学性质相同 D、1滴水中大约有1.67×1021个水分子——分子的质量、体积很小
-
7、下列实验操作正确的是A、称量固体
 B、量筒读数
B、量筒读数 C、闻气味
C、闻气味 D、加热液体
D、加热液体
-
8、2024年诺贝尔化学奖,颁发给在蛋白质结构设计和预测方面作出卓越贡献的科学家。下列不属于化学研究范畴的是A、研发人工智能,推动社会进步 B、研制高效低毒农药,促进粮食增收 C、研发新物质,使世界变得绚丽多彩 D、使用清洁能源,减少环境污染
-
9、空气中含有大量的氮气,如何将氮气在常温下转化为氨气成为近年研究的热点。一种将氮气转化为氨气的循环过程如图所示。请回答下列问题:
 (1)、将液态空气升温,氮气先变成气态,说明氮气的沸点比氧气的沸点(填“高”或“低”)。(2)、过程I中发生化合反应的符号表达式为。(3)、该过程中能循环使用的物质有。
(1)、将液态空气升温,氮气先变成气态,说明氮气的沸点比氧气的沸点(填“高”或“低”)。(2)、过程I中发生化合反应的符号表达式为。(3)、该过程中能循环使用的物质有。 -
10、
同学们在学习电解水实验时对水中增加其它物质感到好奇,于是进行了探究。
【查阅资料】
①纯水中大约每十亿个水分子中,只有两个水分子分解生成氢离子和氢氧根离子。
②硫酸钠、氢氧化钠、氯化钠等物质在水中易解离出离子,如。
③溶液电导率是衡量导电性的指标之一,离子浓度(常用为单位)越大,电导率越高,导电性越好。
④是一种黄绿色、有刺激性气味的有毒气体,可溶于水。
根据资料,请回答下列问题:
(1)加入硫酸钠可以增强水的导电性的原因是。
(2)相同条件下,图1几种物质中(填化学式)导电性最好。

【提出问题】氯化钠是否会增强水的导电性?
【实验验证】小组同学用图2装置分别做了两次实验,记录结果如表。
实验步骤
实验现象
①进入蒸馏水,通电
正极:没有产生气泡。负极:没有产生气泡
②蒸馏水中加入足量氯化钠,溶解后通电
正极:产生明显气泡,试管中收集到黄绿色气体
负极:产生明显气泡,比正极气泡更多更快
【实验结论】
(3)氯化钠(填“能”或“否”)增强水的导电性。
(4)经老师指导,小组同学知道氯化钠溶液通电时,还有氢氧化钠()和氢气生成,请写出反应的符号表达式。
【反思】如果用电解水的实验证明水的组成,因为会产生氯气,不能加入氯化钠。
-
11、学习小组进行水质调查时发现某池塘水较浑浊,为此开展水质研究,探究影响明矾净水效果的因素。
【查阅资料】
①明矾溶于水生成的胶体,能吸附水中悬浮物,发生沉降,从而达到净水目的。
②胶体能溶于酸。
③净水效果可用浊度去除率表示,值越大表示净水效果越好。
【提出猜想】猜想I:一定范围内,明矾的用量越大,净水效果越好。
猜想II:一定范围内,水样的酸性越强,净水效果越差。
【设计实验,验证猜想】取该水样,按下列实验方案加入试剂后,充分搅拌,静置 , 测定水样的浊度并计算得到浊度去除率,记录数据。
实验序号
水样体积
1%絮凝剂溶液体积
9.8%硫酸体积
蒸馏水体积
后浊度去除率
①
200
5.0
0
5.0
②
200
0
7.5
③
200
0
0
④
200
5.0
2.0
3.0
⑤
200
5.0
5.0
0
【数据分析,交流讨论】
(1)、实验①、②、③用于探究猜想I是否成立,则 , 。(2)、实验测得 , 由此得出的结论是。(3)、实验证明猜想II成立,得出该结论的依据是(用A的大小关系表示)。(4)、水样的酸性越强,净水效果越差,原因是。 -
12、如图是超市销售的某种碘盐的部分标签。
精制碘盐
配料:、
含碘量:
质量:
食用注意:勿长时间加热
请回答下列问题:
(1)、中国营养学会推荐:一个普通成年人每天摄入“碘”的质量为。假设碘的来源仅依靠该碘盐,则一个普通成年人每天摄入这种碘盐g。(2)、这一袋碘盐中的质量为多少(写出计算过程,结果保留到)? -
13、同学们开展了“探究制取氧气的适宜催化剂”活动,实验方案如下:
①用、、、四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
②取30粒含的海藻酸钠微球,采用如图1所示装置进行实验。
③改用其他三种微球,分别重复上述实验,得到如图2所示的锥形瓶内压强随时间变化的曲线图。

请回答下列问题:
(1)、写出作催化剂时,过氧化氢溶液分解的符号表达式。(2)、每次实验时,海藻酸钠微球数应相同的目的是。(3)、从实验曲线看,催化效果较好、反应温和的催化剂是(填化学式)。(4)、用含的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因可能是。(5)、除上述影响过氧化氢溶液分解的因素外,你认为会影响过氧化氢溶液分解速率的因素还有哪些(填一种)。 -
14、同学们选用如图所示仪器制取氧气(橡皮塞、导气管及试剂略去,洗气瓶内放入干燥剂可以除去水蒸气),请回答下列问题:
 (1)、制取一瓶纯净的 , 若要使用双孔橡皮塞,需选用的仪器有(填字母)。(2)、用制取的符号表达式为;若用该方法制取 , 其发生装置需补充一种玻璃仪器,请在虚线框内画出该仪器。
(1)、制取一瓶纯净的 , 若要使用双孔橡皮塞,需选用的仪器有(填字母)。(2)、用制取的符号表达式为;若用该方法制取 , 其发生装置需补充一种玻璃仪器,请在虚线框内画出该仪器。 -
15、用如图所示装置进行实验,测定出空气中氧气约占1/5(按体积计算)。请回答下列问题:
 (1)、实验开始时,用酒精灯加热铁丝,其目的是。(2)、反应开始到打开弹簧夹前,②中瓶内可观察到的现象是 , 反应的符号表达式为。(3)、待冷却至室温打开弹簧夹,注射器活塞最终移至约刻度线处。
(1)、实验开始时,用酒精灯加热铁丝,其目的是。(2)、反应开始到打开弹簧夹前,②中瓶内可观察到的现象是 , 反应的符号表达式为。(3)、待冷却至室温打开弹簧夹,注射器活塞最终移至约刻度线处。 -
16、元素化合价和物质类别是认识物质的两个重要维度。如图表示硫元素的化合价与含硫物质类别之间的关系,请回答下列问题:
 (1)、A点表示的物质的名称是。(2)、B点表示的物质在空气中燃烧产生火焰,发生反应的符号表达式为。(3)、C点表示的物质(填“是”或“不是”)计入空气质量评价的主要污染物。(4)、点表示的物质可能为 , 其中的化合价为。
(1)、A点表示的物质的名称是。(2)、B点表示的物质在空气中燃烧产生火焰,发生反应的符号表达式为。(3)、C点表示的物质(填“是”或“不是”)计入空气质量评价的主要污染物。(4)、点表示的物质可能为 , 其中的化合价为。 -
17、在宏观、微观和符号之间建立联系是学习化学的重要思维方式。请根据下列原子结构示意图回答问题:
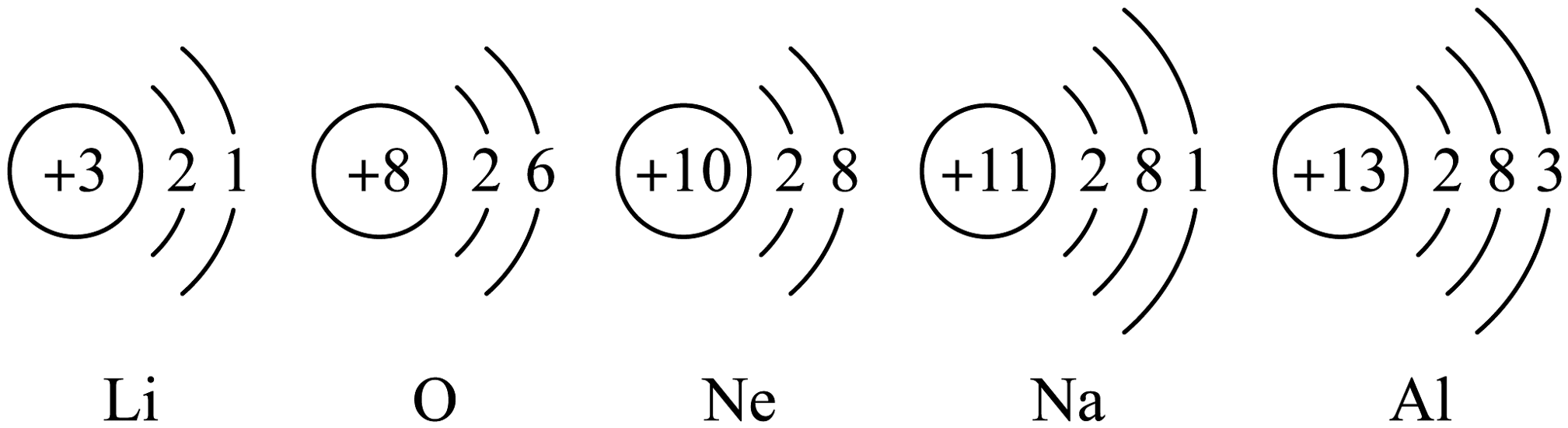 (1)、上图中,最外层达到相对稳定结构的原子是 , 该元素位于元素周期表的周期(填“二”或“三”)。(2)、在化学反应中,铝原子容易电子(填“得到”或“失去”)。(3)、锂和钠两种元素的原子具有相似的化学性质,原因是相同。(4)、由氧和铝两种元素组成化合物的化学式为。
(1)、上图中,最外层达到相对稳定结构的原子是 , 该元素位于元素周期表的周期(填“二”或“三”)。(2)、在化学反应中,铝原子容易电子(填“得到”或“失去”)。(3)、锂和钠两种元素的原子具有相似的化学性质,原因是相同。(4)、由氧和铝两种元素组成化合物的化学式为。 -
18、用化学用语填空:(1)、钾离子(2)、镁元素(3)、3个碳原子(4)、碳酸钠(5)、保持氦气化学性质的最小粒子
-
19、某反应的微观示意图如图,该反应可用于汽车尾气处理。下列说法正确的是
 A、图中的单质为氧气 B、生成物均为无毒物质 C、反应前后元素的化合价均无变化 D、反应前后原子的种类发生变化
A、图中的单质为氧气 B、生成物均为无毒物质 C、反应前后元素的化合价均无变化 D、反应前后原子的种类发生变化 -
20、在劳动中应用科学知识。下表所列劳动项目与科学知识不相符的是
选项
劳动项目
科学知识
A
移动重物时在下面垫圆木
用滚动代替滑动可以减小摩擦
B
煮沸自来水
煮沸可杀菌消毒
C
给自行车轮胎充气
气体分子间隔较小
D
利用活性炭净水
吸附、过滤水中的杂质
A、A B、B C、C D、D