-
1、 合理利用化石能源和开发新能源有利于能源结构优化。
 (1)、据图分析,目前我国能源消费中占比最大的能源是 , 写出一种“其他能源”。(2)、下列不属于石油炼制的产品是(填序号)。
(1)、据图分析,目前我国能源消费中占比最大的能源是 , 写出一种“其他能源”。(2)、下列不属于石油炼制的产品是(填序号)。a.汽油 b.煤油 c.乙醇 d.液化石油气
(3)、用天然气代替煤的优点是。(4)、焦炭可与超临界水反应制备 , 化学方程式为。根据化学方程式计算,含600kg碳的焦炭最多制备的质量是多少? -
2、 根据图文回答问题。
 (1)、分别灼烧两种纤维,闻到烧毛发焦糊味的是(填“涤纶”或“羊毛”);羊毛面料中加涤纶的优点是。(2)、米饭富含(填“糖类”或“维生素”);向盛有发热包(主要成分是CaO)的饭盒里加水,给米饭加热时,注意的安全事项是。(3)、石墨烯地暖核心材料是石墨烯电热膜,供暖时电能转化成;经新风系统净化后的空气,含量明显降低的是(填序号)。
(1)、分别灼烧两种纤维,闻到烧毛发焦糊味的是(填“涤纶”或“羊毛”);羊毛面料中加涤纶的优点是。(2)、米饭富含(填“糖类”或“维生素”);向盛有发热包(主要成分是CaO)的饭盒里加水,给米饭加热时,注意的安全事项是。(3)、石墨烯地暖核心材料是石墨烯电热膜,供暖时电能转化成;经新风系统净化后的空气,含量明显降低的是(填序号)。a.氧气 b.氮气 c.可吸入颗粒物
(4)、飞行器机身使用的玻璃纤维增强塑料属于(填“复合材料”或“合成材料”);航标灯和频闪灯常充入稀有气体,利用稀有气体的物理性质是。 -
3、 《史记正义》记载“垦畦浇晒”产盐法,过程如图。卤水含大量和NaCl等物质,结合溶解度曲线分析,下列说法正确的是( )
 A、晶体1是NaCl,晶体2是 B、“过箩”到“晒制”,NaCl的质量分数一直变大 C、“母液”中含有和NaCl D、降温结晶可除去NaCl溶液中的少量
A、晶体1是NaCl,晶体2是 B、“过箩”到“晒制”,NaCl的质量分数一直变大 C、“母液”中含有和NaCl D、降温结晶可除去NaCl溶液中的少量 -
4、 初中化学常见纯净物M、甲、乙、丙、丁,其物质类别、部分元素化合价及转化关系如图(“—”表示相互反应,“→”表示一步转化)。甲、乙、丙、丁含同种元素,丁的溶液呈黄色。下列说法错误的是( )
 A、丁对应的物质类别X一定为盐 B、反应①可判断甲在金属活动性顺序中位于氢前 C、反应②和④的化学方程式一定相同 D、反应①~④体现了M溶液中有
A、丁对应的物质类别X一定为盐 B、反应①可判断甲在金属活动性顺序中位于氢前 C、反应②和④的化学方程式一定相同 D、反应①~④体现了M溶液中有 -
5、 配制50g质量分数为6%的NaCl溶液,并用该溶液配制50g质量分数为3%的稀溶液,可能用到的仪器如图。下列说法正确的是( )
 A、配制6%的溶液选择仪器①③⑤⑥ B、将NaCl固体倒入量筒中溶解 C、稀释时,用量筒量取48.5mL水 D、量取6%的溶液时仰视读数,所配稀溶液浓度偏大
A、配制6%的溶液选择仪器①③⑤⑥ B、将NaCl固体倒入量筒中溶解 C、稀释时,用量筒量取48.5mL水 D、量取6%的溶液时仰视读数,所配稀溶液浓度偏大 -
6、 大理石与稀盐酸反应后,处理反应混合物的实验方案不能达到实验目的的是( )
选项
实验目的
实验方案
A
回收大理石
将反应混合物倒入罩有滤网的烧杯中,洗涤、晾干
B
验证滤液中有盐酸
取少量滤液于试管中,加入镁条
C
除去滤液中的盐酸
向滤液中加入过量氢氧化钙溶液
D
从滤液中获取碳酸钙
向滤液中加入适量碳酸钠溶液,过滤、洗涤、干燥
A、A B、B C、C D、D -
7、 北京大学科研团队用甲烷与二氧化碳合成乙酸,部分反应过程如图。有关说法错误的是( )
 A、合成乙酸的反应是化合反应 B、消耗的甲烷与生成的乙酸质量比为 C、催化剂在反应前后质量和化学性质不变 D、有利于减缓温室效应
A、合成乙酸的反应是化合反应 B、消耗的甲烷与生成的乙酸质量比为 C、催化剂在反应前后质量和化学性质不变 D、有利于减缓温室效应 -
8、 制备漂白粉的化学方程式为。有关化学用语表示正确的是( )A、X的化学式: B、钙离子: C、4个氯原子: D、中氯元素的化合价:
-
9、 徐寿在《化学鉴原》中命名并介绍多种元素,钠元素和硫元素在周期表中的信息及原子结构示意图如图。有关说法正确的是( )
 A、两种元素均为非金属元素 B、硫原子的质量为32.06g C、钠原子在反应中易得电子 D、两种元素可形成化合物
A、两种元素均为非金属元素 B、硫原子的质量为32.06g C、钠原子在反应中易得电子 D、两种元素可形成化合物 -
10、 青蒿琥酯可治疗疟疾,下图是青蒿琥酯片说明书的部分内容。有关说法正确的是( )
【药品名称】青蒿琥酯片
【主要成分】青蒿琥酯 化学式:
【剂型规格】每片含青蒿琥酯50mg,12片/盒
【用法用量】口服首次2片,一日2次,每次1片,连服5日
注意事项】1.孕妇及对本品过敏者禁用;2.肝肾功能不全者谨慎使用
A、青蒿琥酯由55个原子构成 B、青蒿琥酯中氧元素的质量分数最小 C、疟疾患者均可服用青蒿琥酯片 D、连服5日,最多服用青蒿琥酯550mg -
11、 学习小组在劳动实践中用木材生火做饭,下列说法错误的是( )A、引燃木材——升高木材着火点 B、冒出黑烟——木材燃烧不充分 C、架空木材——增大与空气接触面积 D、沙土盖灭——使木材与空气隔绝
-
12、 高锰酸钾制取氧气的实验如图,下列操作符合安全规范的是( )
 A、连接仪器——将试管抵住实验台,用力塞紧胶塞 B、加热试管——先预热,再对准试剂所在部位加热 C、结束实验——熄灭酒精灯后,将导管移出水面 D、整理复位——加热后的试管,立即用冷水清洗
A、连接仪器——将试管抵住实验台,用力塞紧胶塞 B、加热试管——先预热,再对准试剂所在部位加热 C、结束实验——熄灭酒精灯后,将导管移出水面 D、整理复位——加热后的试管,立即用冷水清洗 -
13、 《成都市水污染防治条例》提倡“守碧水,润蓉城”。有关保护水资源的做法正确的是( )A、加强饮用水源保护 B、污水排入雨水管道 C、大量使用农药化肥 D、工业废水直接排放
-
14、学习小组开展“调查成都特产香花醋”的实践活动。
观流程:研磨粉碎、上笼蒸煮、入瓮发酵、加水调配、消毒杀菌、转移装坛;闻气味:酸香浓郁,醇厚独特;辨用途:增香调味,用途广泛。完成下面小题。
(1)、下列制醋流程主要涉及化学变化的是( )A、研磨粉碎 B、入瓮发酵 C、加水调配 D、转移装坛(2)、闻到醋香,从微观角度分析,正确的是( )A、分子体积变大 B、分子间有间隔 C、分子不断运动 D、分子分成原子(3)、醋用途广泛,关于醋的用法不恰当的是( )A、清洗水壶中的水垢 B、中和皮蛋的碱性 C、除去铁表面的铁锈 D、治疗胃酸过多症 -
15、二氧化锰因其广泛的应用备受关注。(1)、科学家以石墨烯为基体,以二氧化锰为增强体,制得了一种新型材料,用于能源存储领域,这种新材料属于材料(填“金属”或“合成”或“复合”)(2)、某研究小组采用下图装置通过焙烧制取 , 发生反应的化学方程式为:。
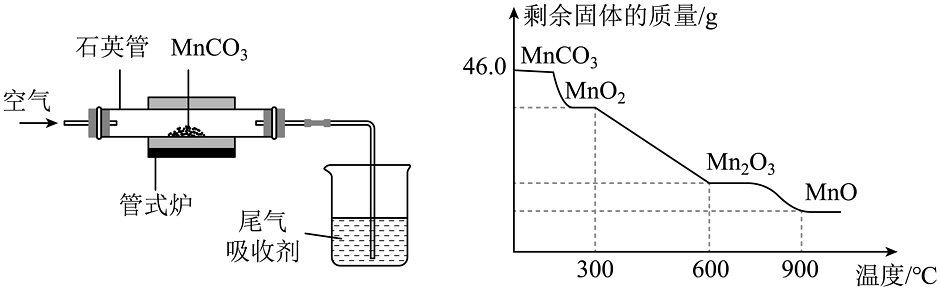
①实验过程中,石英管内剩余固体的质量和成分随温度的变化如上图所示,则焙烧制取应该控制反应的温度不高于℃。
②从加热到的过程中,剩余固体中锰元素的质量分数逐渐增大的原因是。
③若把反应温度控制在 , 充分反应后管内剩余固体的质量为g。
④实验室用二氧化锰催化过氧化氢制取氧气,现有100g溶质质量分数为6.8%的过氧化氢溶液,理论上可以制得氧气的质量为多少?(写出计算过程)
-
16、金属可用于制造货币、合金结构钢、氢化催化剂等。粗制氧化镍主要含氧化镍(NiO),以及少量氧化钴(CoO)和氧化铁,以粗制氧化镍为原料制备纯镍的流程如下:
 (1)、反应③中,黑色单质的化学式是。(2)、反应①的基本反应类型为;反应②中生石灰在生活中的用途是。(3)、从安全操作角度要求反应⑤开始前用氮气充分吹扫设备内部,其目的是 , 该反应中氧化镍转化为金属镍的化学方程式是。(4)、查阅资料,获知部分物质的沸点:
(1)、反应③中,黑色单质的化学式是。(2)、反应①的基本反应类型为;反应②中生石灰在生活中的用途是。(3)、从安全操作角度要求反应⑤开始前用氮气充分吹扫设备内部,其目的是 , 该反应中氧化镍转化为金属镍的化学方程式是。(4)、查阅资料,获知部分物质的沸点:物质
沸点/℃
43
106
52
从、和的混合物中用蒸馏的方法提应选择的温度(T)范围是。
(5)、以上生产流程中循环使用的物质是(填化学式)。(6)、若将制得的放入溶液中,没有观察到明显现象,证明的金属活动性比(选填“强”或“弱”)。 -
17、
高锰酸钾是一种重要的化工产品,它不仅是初中化学制取氧气的重要原料,在医疗上还可以用于杀菌消炎。某兴趣小组对高锰酸钾展开项目式学习。
【任务一】的物理性质
为探究高锰酸钾的溶解性,小组同学设计了如图实验。
 (1)在两支试管中分别加入一小粒高锰酸钾,如图操作,观察到A试管中固体全部溶解,溶液呈________色;B试管中固体不溶解,汽油不变色。说明物质的溶解性与________有关。(2)溶液中含有、两种离子,小明认为溶液的颜色是的颜色,请你结合所学知识回答判断依据是________。
(1)在两支试管中分别加入一小粒高锰酸钾,如图操作,观察到A试管中固体全部溶解,溶液呈________色;B试管中固体不溶解,汽油不变色。说明物质的溶解性与________有关。(2)溶液中含有、两种离子,小明认为溶液的颜色是的颜色,请你结合所学知识回答判断依据是________。【任务二】的化学性质
(3)高锰酸钾常用于实验室中制取氧气,写出该反应的化学方程式:________。【查阅资料】维生素C能与反应,使溶液褪色。
【实验探究】探究果蔬汁中维生素C含量
【进行实验】用几种果蔬汁完成实验,记录观察到溶液恰好褪色时所需果蔬汁的用量。
实验操作
果蔬汁
果蔬汁用量/滴

鲜榨的白菜汁
12
鲜榨的橙汁
8
鲜榨的西红柿汁
11
加热后冷却至室温的新鲜西红柿汁
14
放置12小时的西红柿汁
15
【实验结论】
(4)由上述实验现象可知,影响果蔬汁中维生素C含量的因素有________。(5)下列做法中能提高上述果汁中维生素C含量测量的准确度的有______(多选,填字母序号)。A. 减小高锰酸钾溶液质量分数 B. 用管口较小的滴管 C. 将等量的果蔬汁用等量的水稀释 D. 增加高锰酸钾溶液体积 (6)日常饮用橙汁时需要注意的事项是________(写一点)。(7)继续实验,发现猕猴桃汁中维生素C含量大于西红柿汁中维生素C含量,其实验方案为按照图中实验装置,逐滴滴加猕猴桃汁,________。 -
18、
Ⅰ、二氧化碳的制取
根据下列仪器装置,回答问题。

(1)写出标号仪器的名称:a.________。
(2)实验室制备和收集可从中选用________(填字母),其制取的反应原理为________(用化学方程式表示);装置是在装置基础上的改进,其优点是________。固体试剂放在多孔塑料板的________(填“上方”或“下方”)。

Ⅱ、自制简易发生器并应用于水草中,化学小组制成发生器甲与装置乙(用于除杂和观察气泡)组合为给鱼池中水草提供(如图丙)。
(3)下列分析正确的是______(多选,选填字母)。
A. 甲中的b口应与乙中的c口相连接 B. 为除去中混有的醋酸,可以是溶液 C. 可根据中冒出气泡的快慢来调节甲中的流速调节器 D. 甲装置无法用于实验室制氧气 (4)小组同学用自制的发生器连接气体细化器向水草缸中通入气体,实践效果很好。使用气体细化器的作用是________。
(5)发生器的不合理使用会影响缸中鱼类生存,请写出使用时的一条注意事项________。
-
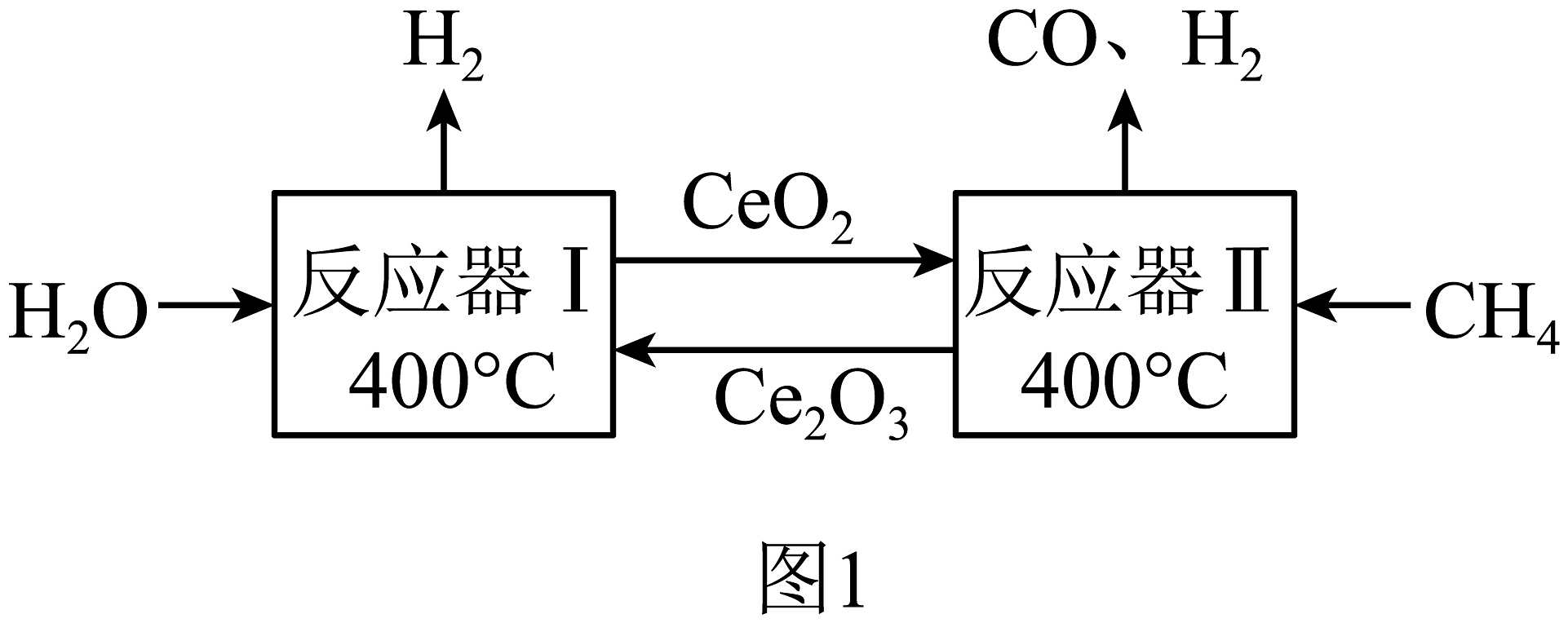
19、氢能是面向未来的清洁能源。目前,我国制氢方式有化石能源制氢[包括煤制氢和天然气制氢(如图1)]、电解水制氢和乙醇裂解制氢等。其中化石能源制氢技术比较成熟,是当前主要的制氢方式。利用可再生能源电解水制氢是理想的制氢技术,其技术主要有三种,分别是光催化、光电催化和光-电催化耦合制氢,对应的氢能转化率如下表。
可再生能源制氢技术
氢能转化率
光催化
不足5%
光电催化
不足5%
光-电催化耦合
70%以上
氢合金,中国科学家提出的“液态阳光”也是一种氢气储运是氢能产业链的重要环节。除了储储氢载体。“液态阳光”是指利用太阳能等可再生能源制取绿色氢气,结合二氧化碳加氢技术制备以甲醇为代表的液态燃料。甲醇相比氢气、甲烷等燃料,它可以直接使用现有的以汽油为主的燃料储存运输设施,降低了氢气储存和运输的成本。
“液态阳光”关键技术之一是合成甲醇时催化剂的选择。工业生产选择催化剂时,催化剂的稳定性是重要参考条件之一,中国科学家突破了这一关键技术(部分成果如图2),推动了“液态阳光”生产从实验室走向应用。事实证明,这是切实可行的碳中和路径。请依据上述材料及所学化学知识,回答下列问题。
 (1)、氢气作为清洁能源具有的优点之一是对环境无污染。当前我国最主要的制氢方式是。(2)、结合图1,试分析天然气制氢工艺存在的不足是。(3)、如表所示,光-电催化耦合技术优势之一是。(4)、煤经过加工合成的甲醇,(填“(能”或“不能”)称作“液态阳光”。(5)、“液态阳光”技术使用的可以用溶液捕获,其化学方程式为。(6)、根据图2中信息,选出合成“液态阳光”最适合的催化剂______(填标号)。A、 B、 C、(240℃) D、(7)、除“液态阳光”技术外,下列哪些措施也能促进碳中和______(填标号)。A、大力推广使用脱硫煤 B、加快煤的开采与使用,发展经济 C、大规模开采可燃冰作为新能源 D、研发新工艺将二氧化碳转化为化工产品
(1)、氢气作为清洁能源具有的优点之一是对环境无污染。当前我国最主要的制氢方式是。(2)、结合图1,试分析天然气制氢工艺存在的不足是。(3)、如表所示,光-电催化耦合技术优势之一是。(4)、煤经过加工合成的甲醇,(填“(能”或“不能”)称作“液态阳光”。(5)、“液态阳光”技术使用的可以用溶液捕获,其化学方程式为。(6)、根据图2中信息,选出合成“液态阳光”最适合的催化剂______(填标号)。A、 B、 C、(240℃) D、(7)、除“液态阳光”技术外,下列哪些措施也能促进碳中和______(填标号)。A、大力推广使用脱硫煤 B、加快煤的开采与使用,发展经济 C、大规模开采可燃冰作为新能源 D、研发新工艺将二氧化碳转化为化工产品 -
20、
当化学与浪漫相遇,你喜欢哪一款?广东肇庆中学第五届科技创新节中,化学科组推出的“晶绽创想-创意晶体制作”和“蚀韵铜华-铜板腐蚀画制作”两大特色活动作品惊艳亮相。
(1)1.科技创新节开幕式,我校化学科组的老师们用“掌中火焰”点燃了同学们对科学的热情。老师在开始表演前需将手用水浸湿,再用火机点燃手上肥皂泡中的丁烷气体使其燃烧,丁烷在手掌中燃烧不会灼伤皮肤是因为。

2.晶绽创想-创意晶体制作
选取原料:制备硫酸铜晶体使用的原料是胆矾()
(2)制备硫酸铜饱和溶液:在烧杯中加入一定量的蒸馏水并用酒精灯进行加热,逐步往其中加入胆矾,用玻璃棒搅拌至不再溶解。其中玻璃棒的作用是。
(3)制备硫酸铜晶体模型:小肇和小钟购入了一批形状各异的假花、塑料制成的玩偶以及铜丝编制的工艺品,将其浸泡在硫酸铜的饱和溶液中经过一系列操作,即可制备出精致的硫酸铜晶体模型。
①根据右侧表格中不同温度下硫酸铜在水中的溶解度,其中“一系列操作”中包含(填“降温结晶”或“蒸发结晶”)。
温度/℃
20
40
60
80
100
溶解度/g
20.7
28.5
40
55
75.4
②所购买的材料中不能是金属铁制成的,原因是(用化学方程式解释)。
硫酸铜晶体的保存:硫酸铜晶体()不能放在阳光下暴晒,否则失去晶体中的结晶水变成白色的无水硫酸铜。
3.蚀韵铜华-铜板腐蚀画制作

铜板腐蚀画的制作的原理是:利用蚀刻液与裸露金属之间发生反应,最终形成精美图案。
(4)小玥用一块铜板制作金属字画,她先用马克笔在铜板上写上“端溪书院”字,接着将铜板没入试剂a中,取出后出现银白底紫红色的“端溪书院”字。则试剂a为(填序号)。
①稀硫酸 ②硝酸银溶液 ③硫酸铜溶液
(5)保护字画。为防止金属画锈蚀。可采取的措施有(填序号)
①表面涂一层保护膜 ②放置在潮湿地方 ③常用汗手直接取用