-
1、生活中的污水常用物理、化学及生物方法进行分级处理。如图为污水分级处理流程示意图。
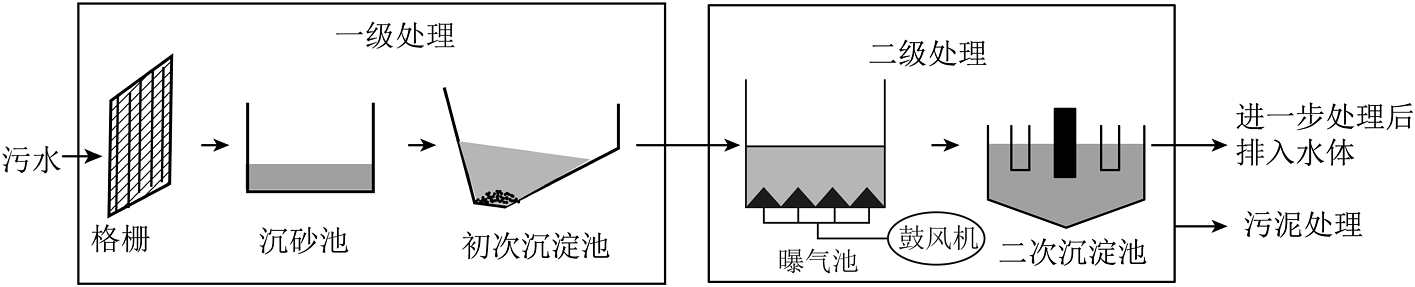 (1)、“一级处理”中,沉砂池和初次沉淀池主要去除水中(选填“可溶性”或“不溶性”)杂质。(2)、“二级处理”中,可在曝气池繁殖枯草芽孢杆菌来处理有机污染物。枯草芽孢杆菌是(填“厌氧菌”或“好氧菌”)。(3)、“进一步处理”包括消毒等步骤。二氧化氯是一种高效的饮用水消毒剂,可由亚氯酸钠和氯气反应制得,同时还会生成一种常见的盐,该反应的化学方程式为。(4)、含铝污泥能去除水中的磷。为探究影响污泥除磷率的因素,在锥形瓶中加入100mL模拟含磷废水,按下表调节pH并控制相关变量。反应3小时后过滤,测定污泥样品对磷的吸附量。
(1)、“一级处理”中,沉砂池和初次沉淀池主要去除水中(选填“可溶性”或“不溶性”)杂质。(2)、“二级处理”中,可在曝气池繁殖枯草芽孢杆菌来处理有机污染物。枯草芽孢杆菌是(填“厌氧菌”或“好氧菌”)。(3)、“进一步处理”包括消毒等步骤。二氧化氯是一种高效的饮用水消毒剂,可由亚氯酸钠和氯气反应制得,同时还会生成一种常见的盐,该反应的化学方程式为。(4)、含铝污泥能去除水中的磷。为探究影响污泥除磷率的因素,在锥形瓶中加入100mL模拟含磷废水,按下表调节pH并控制相关变量。反应3小时后过滤,测定污泥样品对磷的吸附量。实验
酸碱度
污泥样品/g
反应温度/℃
吸附量/
1
3
0.3
25
3.13
2
7
0.3
25
2.62
3
11
0.3
25
2.1
4
7
0.4
25
x
5
7
0.5
25
4.24
①对比实验1、2、3,可得出结论。
②通过实验可知,相同条件下,等体积水中加入的污泥样品质量越大,污泥除磷率越高。则实验4中x的数值范围是。
-
2、
氟及其化合物是现代工业和生活重要的材料。某化学小组开启了氟元素学习之旅。
Ⅰ.识氟之初
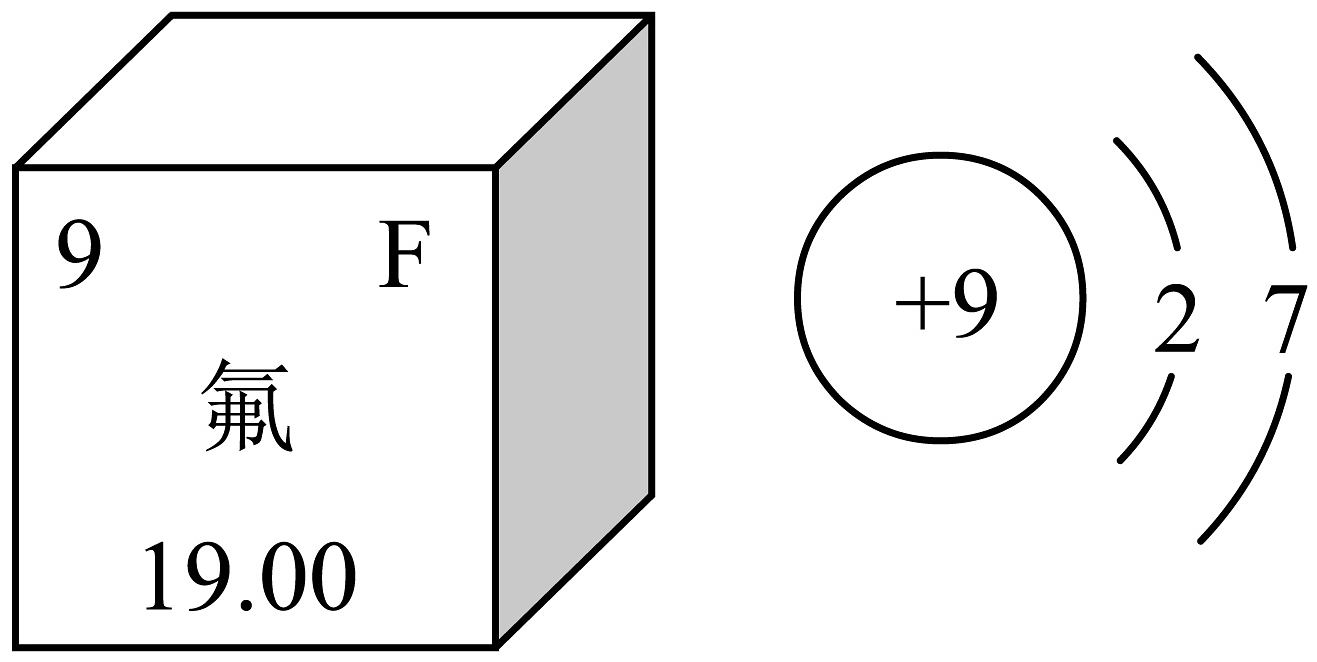
(1)从如图可知氟元素的相对原子质量为 , 其原子在化学反应中容易(填“得到”或“失去”)电子。
Ⅱ.探氟之源
(2)工业上常用萤石(主要成分为)和浓硫酸在高温下发生复分解反应,制取HF气体,HF的化学名称为。该复分解反应的化学方程式是。
Ⅲ.用氟之智
聚四氟乙烯(PTFE)是一种含氟材料,可由四氟乙烯聚合而成,常用作冲锋衣面料。
(3)工业制备四氟乙烯的反应微观示意图如下,参加反应的甲、乙、丙、丁分子个数比为 , 请补全方框中丁的微粒模型。

(4)PTFE有“塑料王”之称,其属于(填“金属”或“无机非金属”或“合成”)材料。
(5)PTFE膜有微孔结构,其直径约在0.1至之间。结合如表分析,PTFE膜可作为防水和透汗冲锋衣面料原因。
类型
水蒸气
雨水
直径/
0.0004
-
3、下列实验设计能达到实验目的的是
目的
证明燃烧的条件之一是需要与氧气接触
证明乙醇中含有碳元素
验证质量守恒定律
证明铁生锈需要与水接触
实验设计




选项
A
B
C
D
A、A B、B C、C D、D -
4、如图是KCl、两种物质的溶解度曲线,下列说法正确的是
 A、的溶解度大于KCl的溶解度 B、中混有少量KCl,可用蒸发结晶进行提纯 C、时,将与100g水充分混合,可形成180g溶液 D、时,配制等质量饱和溶液和KCl饱和溶液,所需水的质量前者小于后者
A、的溶解度大于KCl的溶解度 B、中混有少量KCl,可用蒸发结晶进行提纯 C、时,将与100g水充分混合,可形成180g溶液 D、时,配制等质量饱和溶液和KCl饱和溶液,所需水的质量前者小于后者 -
5、下列跨学科实践活动涉及的化学知识正确的是
选项
实践活动
化学知识
A
将氯化钠从海水中分离出来
采用降温结晶的方法
B
设计和制作简易供氧器
制氧剂必须含有氧元素
C
用自制简易净水器净化雨水
活性炭起到杀菌消毒作用
D
调查家用燃料的变迁与合理使用
煤炉越扇越旺是因为降低了煤的着火点
A、A B、B C、C D、D -
6、人体内的一些液体正常pH范围是:唾液6.6~7.1,胃液0.9~1.5,胰液7.8~8.4。下列说法错误的是A、上述液体中碱性最强的是胰液 B、唾液不一定显碱性 C、大量饮水后胃液pH变小 D、胃酸过多可服用含氢氧化铝的药物治疗
-
7、邻苯二甲酸酯(化学式C24H38O4)是一种增塑剂,但有一定的毒副作用,高温时塑料瓶中的增塑剂分子更容易进入食品中。下列关于邻苯二甲酸酯的说法不正确的是A、邻苯二甲酸酯由三种元素组成 B、邻苯二甲酸酯由66个原子构成 C、邻苯二甲酸酯中碳元素质量分数最高 D、普通塑料瓶不宜直接盛放热奶茶和热奶制品
-
8、《本草纲目》记载古法酿酒:“烧酒自元时创始,其法用浓酒和糟入甑,蒸令气上……其清如水,盖酒露也。”“烧酒”中有乙醇,以下说法错误的是
 A、烧酒会散发出酒香,从微观角度解释为乙醇分子在运动 B、“蒸令气上……其清如水”与实验室过滤操作原理相同 C、“浓酒和糟入甑”,酿酒过程中包含了缓慢氧化 D、乙醇可以用于体表和医疗器械的消毒
A、烧酒会散发出酒香,从微观角度解释为乙醇分子在运动 B、“蒸令气上……其清如水”与实验室过滤操作原理相同 C、“浓酒和糟入甑”,酿酒过程中包含了缓慢氧化 D、乙醇可以用于体表和医疗器械的消毒 -
9、下列与化学有关的说法正确的是A、化学与农业:用氢氧化钠改良酸性土壤 B、化学与材料:棉花、羊毛都属于合成材料 C、化学与环境:的降雨呈酸性,一定是酸雨 D、化学与科技:我国科学家徐光宪在稀土元素的分离技术研究领域取得了重大进展
-
10、下列关于空气成分及空气质量的说法,错误的是A、空气中含量最多的气体是氮气,约占空气体积的78% B、计入空气质量评价的主要污染物包括二氧化硫、一氧化碳、二氧化碳 C、稀有气体通电发不同颜色的光,可用于制作霓虹灯 D、植树造林、使用清洁能源有助于改善空气质量
-
11、“关爱生命,拥抱健康”是人类永恒的主题。下列叙述合理的是A、油锅不慎着火,应立即用大量的水浇灭 B、蚊虫叮咬时释放出的蚁酸使人觉得不适,可涂抹氢氧化钠溶液处理 C、感冒发烧时,立即大量服用对乙酰氨基酚以到达快速降温的效果 D、均衡膳食,多吃水果或蔬菜可补充人体所需维生素
-
12、物质在不断运动和变化,在氧-碳循环过程中,碳元素由大气圈进入水圈的变化是A、海水吸收二氧化碳 B、动植物的呼吸作用 C、绿色植物的光合作用 D、化石燃料的燃烧
-
13、工厂排出的废水(主要含 , 还有少量HCl等)采用生石灰或石灰石调节废水的pH的方法处理;现取1L废水样品中加入此两种物质,测得废水的pH随加入固体质量的变化如下图所示(已知:溶液显中性)。
 (1)、只加入石灰石,废水的pH始终小于7的原因是。(2)、每吨生石灰的价格约为460元,每吨石灰石的价格约为130元。联合使用生石灰和石灰石,将这两种物质先后加入1L废水,调节废水的pH至约为7,经济效益较好的可行方案为。(3)、废水的时,中的铜已全部沉淀了,此时废水中主要的溶质是。(4)、若在1L废水中加入5g , 则消耗HCl的质量为多少(根据化学方程式,写出规范计算步骤)?
(1)、只加入石灰石,废水的pH始终小于7的原因是。(2)、每吨生石灰的价格约为460元,每吨石灰石的价格约为130元。联合使用生石灰和石灰石,将这两种物质先后加入1L废水,调节废水的pH至约为7,经济效益较好的可行方案为。(3)、废水的时,中的铜已全部沉淀了,此时废水中主要的溶质是。(4)、若在1L废水中加入5g , 则消耗HCl的质量为多少(根据化学方程式,写出规范计算步骤)? -
14、早期传统以为原料制备 , 工艺流程如下图。
 (1)、过程Ⅰ加热生成BaO等三种物质,其化学方程式为 , 该化学反应的基本类型是。(2)、过程Ⅱ涉及的反应是 , 反应前后氧元素的化合价种。(3)、过程Ⅲ中加入的试剂X是。(4)、过程Ⅳ中操作名称是。(5)、减压能降低蒸馏的温度,过程Ⅴ采用减压蒸馏的原因(试从的化学性质并用化学方程式解释)。(6)、我国科学家采用电解法实现以氧气和水为原料制备 , 相较于早期传统制法,其优点(写一条即可)。
(1)、过程Ⅰ加热生成BaO等三种物质,其化学方程式为 , 该化学反应的基本类型是。(2)、过程Ⅱ涉及的反应是 , 反应前后氧元素的化合价种。(3)、过程Ⅲ中加入的试剂X是。(4)、过程Ⅳ中操作名称是。(5)、减压能降低蒸馏的温度,过程Ⅴ采用减压蒸馏的原因(试从的化学性质并用化学方程式解释)。(6)、我国科学家采用电解法实现以氧气和水为原料制备 , 相较于早期传统制法,其优点(写一条即可)。 -
15、
实验小组同学在老师指导下对密闭体系中影响蜡烛[主要成分石蜡(),还含有少量硬脂酸()]燃烧时间的因素进行探究。
【猜想与假设】蜡烛高度、烛芯长度、氧气的体积分数都会影响蜡烛燃烧的时间。
【进行实验】将点燃的蜡烛放置于玻璃片上,再将集气瓶倒扣在玻璃片上(如图1所示),记录从倒扣集气瓶至蜡烛熄灭的时间。实验1、实验2的集气瓶中气体均为空气。

实验1:用烛芯长度均为0.5cm、不同高度的蜡烛进行实验,记录表1。
表1 实验1记录
实验序号
1-1
1-2
1-3
1-4
蜡烛高度/cm
1
3
5
7
燃烧时间/s
17.58
10.28
8.99
7.84
实验2:用高度均为2cm、不同烛芯长度的蜡烛进行实验,记录表2。
表2 实验2记录
实验序号
2-1
2-2
2-3
2-4
烛芯长度/cm
0.2
0.5
0.7
0.9
燃烧时间/s
16.01
12.90
11.40
8.49
实验3:用高度均为2cm、烛芯长度均为0.5cm的蜡烛进行实验,集气瓶中的气体用不同体积比的氧气和氮气填充。实验结果如图2所示。

【解释与结论】
(1)在蜡烛燃烧过程中,蜡烛的熔化属于。
(2)实验1的目的是。
(3)实验2的结论是。
(4)实验3中a点对应的实验与实验2-2中蜡烛的燃烧时间接近,原因是。
【反思与评价】
(5)实验小组设计了如下实验方案探究蜡烛的组成元素。

请运用你所学化学知识评价上述方案。
(6)关于蜡烛燃烧你还可以研究的是。
-
16、锂是“21世纪能源新贵”,是支撑新能源汽车产业发展、推动新能源革命的关键原材料。
锂资源主要有两种存在形态:一是存在于含锂矿石中;二是以离子的形式存在于卤水资源中,如盐湖卤水等。我国盐湖锂资源十分丰富,居世界第三位。
目前卤水提锂的产品以碳酸锂为主,吸附法是目前最为先进环保且适合低含量、高镁锂比的卤水提锂工艺,其主要工艺流程如下图。

锂离子电池是当前在纯电动汽车应用最广泛的动力电池,常见的锂离子电池类型有钴酸锂()、锰酸锂()、磷酸铁锂()、钛酸锂()等。四种锂离子电池的部分性能参数比较如下表。
性能
循环寿命/次
500-1000
500-2000
2000-6000
3000-7000
安全性
低
中
高
高
电池成本
高
低
低
中
高价值元素
锂、钴
锂
锂
锂、钛
在我国“双碳”政策的推行和落实下,当前和可预见的未来,新能源、人工智能、航空航天等都离不开锂原料。
(1)、锂资源主要存在于。(2)、“原始卤水”中含金属元素有(至少写三种)。(3)、卤水提锂的产品碳酸锂属于(填物质类别)。(4)、从低含量、高镁锂比的卤水中提锂最先进、最环保的方法是。(5)、磷酸铁锂电池的优势是(至少答两点)。(6)、我国各行各业践行“低碳”理念,在化学实验室也要“低碳”行动。请写出实验室“碳”排放的一个反应的化学方程式。 -
17、物质之间关系图如下(“—”表示两端物质能反应,“→”表示物质之间的转化关系),反应条件和部分反应物已省略。下列有关说法正确的是
 A、若X为CO,则反应①说明CO的可燃性 B、反应②的现象是铜丝能在空气中燃烧,生成黑色CuO C、反应③的发生的反应可能 D、若X为煤,反应④的产物对空气无污染
A、若X为CO,则反应①说明CO的可燃性 B、反应②的现象是铜丝能在空气中燃烧,生成黑色CuO C、反应③的发生的反应可能 D、若X为煤,反应④的产物对空气无污染 -
18、加热常用除锈剂——草酸(化学式)产生的气体中含有和CO。设计如下实验方案(装置中试剂足量)验证混合气体。有关说法错误的是
 A、装置甲Ⅰ、甲Ⅱ、甲Ⅲ中澄清石灰水都会变浑浊 B、装置乙NaOH饱和溶液目的是吸收混合气体中 C、实验方案中缺少对尾气的处理,尾气会污染空气 D、丁中的现象为黑色粉末变红
A、装置甲Ⅰ、甲Ⅱ、甲Ⅲ中澄清石灰水都会变浑浊 B、装置乙NaOH饱和溶液目的是吸收混合气体中 C、实验方案中缺少对尾气的处理,尾气会污染空气 D、丁中的现象为黑色粉末变红 -
19、下表是NaCl不同温度时的溶解度;图1是氢氧化钙的溶解度曲线;图2是加热饱和氢氧化钙溶液(加热溶液不考虑水的蒸发,下同)。下列描述正确的是
温度/℃
20
40
60
80
100
NaCl溶解度/g
36.0
36.6
37.3
38.4
39.8
 A、在20℃时可用NaCl配制质量分数为16%的NaCl溶液 B、饱和氢氧化钙溶液一定比不饱和NaCl溶液的浓度大 C、加热饱和氢氧化钙溶液无明显现象,植物油作用是防止与空气中反应 D、若加热饱和NaCl溶液,则溶液中溶质质量分数增大
A、在20℃时可用NaCl配制质量分数为16%的NaCl溶液 B、饱和氢氧化钙溶液一定比不饱和NaCl溶液的浓度大 C、加热饱和氢氧化钙溶液无明显现象,植物油作用是防止与空气中反应 D、若加热饱和NaCl溶液,则溶液中溶质质量分数增大 -
20、高铁建设因铁锈蚀报废了很多钢铁。同学们对影响铁锈蚀的因素进行如下探究。一段时间后,观察到图1中Ⅳ铁钉比Ⅰ中铁钉锈蚀更严重,Ⅱ、Ⅲ中铁钉无明显变化。按图2利用等浓度、等体积的、NaCl溶液分别进行实验,测得装置内氧气浓度的变化情况如图3。下列描述错误的是
 A、比较图1中Ⅰ、Ⅱ和Ⅰ、Ⅲ可得出铁生锈的条件 B、对比Ⅰ与Ⅳ以及图3可知铁生锈还与盐有关 C、由图3可知,两曲线呈“先陡后缓”的趋势的原因是氧气浓度下降 D、在三颈烧瓶接压强传感器,生铁粉末生锈后瓶内压强是起始的1/5
A、比较图1中Ⅰ、Ⅱ和Ⅰ、Ⅲ可得出铁生锈的条件 B、对比Ⅰ与Ⅳ以及图3可知铁生锈还与盐有关 C、由图3可知,两曲线呈“先陡后缓”的趋势的原因是氧气浓度下降 D、在三颈烧瓶接压强传感器,生铁粉末生锈后瓶内压强是起始的1/5