-
1、现有铜与金属镁、锌中的一种组成的混合物,现欲测定其组成。取该混合物粉末8.0g放入烧杯中,将140.0g溶质的质量分数为14.0%的稀硫酸平均分四次加入该烧杯中(铜与稀硫酸不反应),充分反应后,测得剩余固体质量数据记录如图,通过计算,
 (1)、该混合物粉末中铜的质量分数是。(2)、计算确定混合物中的另一种金属成分是。(3)、第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程)
(1)、该混合物粉末中铜的质量分数是。(2)、计算确定混合物中的另一种金属成分是。(3)、第三次加入稀硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程) -
2、小科同学在某化工厂进行社会实践,技术员与小明仪器分析由氯化钙和氯化钠组成的产品中的氯化钠的含量。现取13.4g固体样品,全部溶于96.6g水中,向所得的混合溶液中滴加溶质质量分数为10.6%的碳酸钠溶液,并绘制了如图所示的曲线。
(CaCl2+Na2CO3==CaCO3↓+2NaCl)
 (1)、当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g;(2)、计算13.4g样品中氯化钠的质量。(3)、当氯化钙与碳酸钠恰好完全反应时,过滤,计算所得溶液中溶质的质量分数。
(1)、当氯化钙与碳酸钠恰好完全反应时,消耗10.6%的碳酸钠溶液的质量是g;(2)、计算13.4g样品中氯化钠的质量。(3)、当氯化钙与碳酸钠恰好完全反应时,过滤,计算所得溶液中溶质的质量分数。 -
3、在一定量的氢氧化钠稀溶液中逐渐滴加稀盐酸,反应过程中不断搅拌并即使测量不同时刻溶液的温度与pH,记录数据如下表:
 (1)、观察上表发现,当反应时间在秒时开始,溶液中氯化钠的质量不再增加。(2)、完成上述实验,能否用氢氧化钠固体代替,并说明原因。(3)、结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中的溶质的质量(稀盐酸的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%)
(1)、观察上表发现,当反应时间在秒时开始,溶液中氯化钠的质量不再增加。(2)、完成上述实验,能否用氢氧化钠固体代替,并说明原因。(3)、结合上表中滴入稀盐酸体积与pH的变化数据,试计算氢氧化钠稀溶液中的溶质的质量(稀盐酸的密度取1.0g/mL,稀盐酸溶质质量分数为7.3%) -
4、钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某品牌补钙药剂主要含有碳酸钙。为了测定该品牌补钙药剂中CaCO3的质量分数,取该补钙药剂制成的粉末20g,逐滴滴入稀盐酸(补钙剂中其他成分不与盐酸反应),得到数据如图所示,请根据有关信息回答问题:(1)、该补钙剂刚好完全反应时产生气体的质量为。(2)、该品牌补钙药剂中CaCO3的质量分数是。(3)、求该盐酸中溶质的质量分数。(写出计算过程)

-
5、每年11月是橘子丰收的时节,橘子中含有丰富的核黄素即维生素B2(分子式C17H20N4O6)分子量:376,黄至橙黄色结晶性粉末,微臭,味微苦。在核黄素具有热稳定性,不受空气中氧的影响,在酸性溶液中稳定,但在碱性溶液中不稳定。光照射容易分解。(1)、写出两点核黄素化学性质。(2)、一个核黄素分子中共有个原子。(3)、计算94克核黄素中含有多少克氢元素?(请列式计算)
-
6、小科为证明无明显现象反应的发生,进行了相关实验。回答下列问题。
 (1)、【实验一】证明澄清石灰水能与盐酸反应。
(1)、【实验一】证明澄清石灰水能与盐酸反应。如图甲所示,小乐将无色酚酞滴入a中,然后(填写操作)。
(2)、一段时间后,观察到a中 , 说明澄清石灰水能与盐酸反应。(3)、【实验二】证明二氧化碳能与氢氧化钠溶液反应如图乙所示,小乐将盛满干燥二氧化碳的U型管开口端放入盛有氢氧化钠溶液的烧杯内,观察到烧杯中的溶液倒吸进入U型管,并充满U型管,但此现象并不能作为两者发生反应的证据,理由是。
(4)、若要对上述实验进行改进,则改进的思路是。 -
7、为了测定某NaOH固体中混有的Na2CO3质量分数,某同学分别设计了三种实验方案:(1)、Ⅰ吸收法:实验装置如图,碱石灰为生石灰和固体NaOH混合物,以下会使Na2CO3质量分数偏大的原因有____。
 A、装置内原有空气中的二氧化碳气体也被碱石灰吸收 B、加入稀硫酸的量不足 C、反应完成后装置中仍有二氧化碳没有被碱石灰吸收 D、装置外的空气中的水蒸气和二氧化碳被碱石灰吸收(2)、Ⅱ沉淀法:称取一定质量的固体,完全溶解于水,加入足量X产生沉淀,根据沉淀质量计算Na2CO3质量分数。如果X是一种碱,请写出X的化学式。(3)、Ⅲ滴定法:称取固体5g配制呈100mL溶液,用3.65%的盐酸滴定,至NaOH完全反应时消耗盐酸80mL,盐酸的密度为1.0g/mL,利用消耗的盐酸计算出样品中的NaOH含量。
A、装置内原有空气中的二氧化碳气体也被碱石灰吸收 B、加入稀硫酸的量不足 C、反应完成后装置中仍有二氧化碳没有被碱石灰吸收 D、装置外的空气中的水蒸气和二氧化碳被碱石灰吸收(2)、Ⅱ沉淀法:称取一定质量的固体,完全溶解于水,加入足量X产生沉淀,根据沉淀质量计算Na2CO3质量分数。如果X是一种碱,请写出X的化学式。(3)、Ⅲ滴定法:称取固体5g配制呈100mL溶液,用3.65%的盐酸滴定,至NaOH完全反应时消耗盐酸80mL,盐酸的密度为1.0g/mL,利用消耗的盐酸计算出样品中的NaOH含量。①NaOH完全被反应的判断依据是;
②根据以上数据,原固体中Na2CO3的质量分数为。
-
8、有一种均匀、呈颗粒状的Mg-Al合金,现需要测定该合金中的Mg的质量分数。
【实验原理】利用如图所示的装置,测定合金与酸反应生产H2的体积及反应前后合金质量的变化。(Mg+H2SO4==MgSO4+H2↑ 2Al+3H2SO4==Al2(SO4)3+3H2↑)

【实验过程】
(1)、应在广口瓶中加入。(2)、部分操作步骤如下:a.读出量筒内液体的体积
b.分别向烧杯和广口瓶中加入试剂
c.反应一段时间后,取出球形管
d.向球形管中加入合金,再置于烧杯中
请将上述操作进行排序:。
(3)、此装置的优点是。(4)、【实验结果】若合金的质量在实验前为m1g,反应后为m2g,量筒中接收到的液体体积为VL,该实验条件下H2的密度为ρg/L,请写出该合金中Mg的质量分数的表达式。 -
9、我国不少地方有端午吃“灰水粽”的习俗,所谓“灰水粽”是指用草木灰的浸出液(“灰水”)俗称浸泡糯米做成的粽子,这种粽子清香软糯,小乐对制作“灰水粽”的草木灰展开了如下探究:

【查阅资料】①糯米中加入食用碱可起到中和微生物生成的酸、软化食物纤维等作用;
②草木灰中富含钾盐,主要成分是K2CO3 , 还含有少量K2SO4和KCl。
【实验探究】检验草木灰的成分。并测定草木灰中K2CO3的质量分数。
(1)、取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液;取少量浸出液于试管中,滴加几滴酚酞试液,观察到酚酞试液变红,则说明草木灰的浸出液呈可起到食用碱的作用。(2)、为了检验草木灰的浸出液中存在Cl- , 小乐先往浸出液中加入足量的Ba(OH)2溶液后过滤,这样操作的目的是。(3)、小海用图示装置(图中夹持仪器已略去)测定草木灰中K2CO3的质量分数。实验中通过测定装置质量的增加量来计算K2CO3的质量(草木灰中其他成分不与稀盐酸产生气体)。写出图中发生反应的化学方程式。 -
10、某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液,加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。(1)、写出该中和反应的化学方程式:;(2)、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;
猜想三:
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡;
实验现象:。
结论:猜想一不正确。
实验步骤:取少量烧杯内溶液与另一支试管中,逐滴加入碳酸钠溶液至过量。
实验现象:。结论:猜想二不正确。猜想三正确。
(3)、根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?____(填序号)A、pH试纸 B、铜 C、紫色石蕊溶液 D、硝酸银溶液 -
11、为了除去NaCl溶液中含有少量的MgCl2、CaCl2和Na2SO4等杂质,某小组同学选用Na2CO3溶液、稀盐酸、Ba(OH)2溶液三种试剂,按一定的顺序进行如图所示的实验。
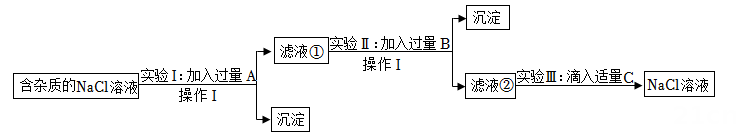
回答下列问题:
(1)、实验Ⅰ中加入试剂A除去的杂质是;(2)、滤液②中除Na+和Cl-外,还含有的离子是(填离子符号);(3)、实验Ⅲ中发生的中和反应的化学方程式是。 -
12、某同学参照生物的二歧分类检索表,对一些化学物质进行区分,现有A、B、C、D四种溶液,它们分别是氢氧化钠溶液、硫酸铜溶液、碳酸钠溶液和氯化钡溶液中的一种,他制作了如图所示的分类检索表,请帮他将图中”____”中的有关内容补充完整。(1)、2a:;(2)3a:。

-
13、如图所示,这是盐的四个方面的化学性质(图中编号①~④),请回答有关问题。
 (1)、在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 , 化学方程式为。(2)、在性质③中,X代表类物质。(3)、在归纳性质④时,从“某些盐”中选取了硝酸银,写出能与硝酸银反应的盐的化学式:(任写一个)。
(1)、在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中相互反应时产生的现象是 , 化学方程式为。(2)、在性质③中,X代表类物质。(3)、在归纳性质④时,从“某些盐”中选取了硝酸银,写出能与硝酸银反应的盐的化学式:(任写一个)。 -
14、甲乙两车间的废水中含有K+、Ag+、Cu2+、CO32-、OH-、NO3-六种离子;(1)、乙车间的废水呈蓝色,其中的阴离子为;(2)、如果甲乙两车间的废水混合,可以使废水的某些离子转化为沉淀。经过滤后的废水中含有(填氮肥,磷肥、钾肥或复合肥)。(3)、写出检验其中一个车间废水中含有OH-的方法。
-
15、如图所示为U盘的外观和内部结构示意图,请据此回答以下问题。
 (1)、图中含有的金属材料是(填1种)。(2)、制作保护套的材料铝合金替代铁的主要优点是。(3)、铜箔基板上布满电子线路,这是利用了铜的这一物理性质。
(1)、图中含有的金属材料是(填1种)。(2)、制作保护套的材料铝合金替代铁的主要优点是。(3)、铜箔基板上布满电子线路,这是利用了铜的这一物理性质。 -
16、实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾5瓶溶液。为把它们区别开,所加试剂及先后顺序合理的一组是( )A、氯化钡溶液、稀硝酸、石蕊试液 B、稀硝酸、石蕊试液、硝酸银溶液 C、石蕊试液、稀硝酸、硝酸银溶液 D、稀硝酸、酚酞试液、硝酸银溶液
-
17、如图所示,装置气密性良好,要使注射器的活塞明显向右移动,使用的液体M和固体N可能是( )

①水和氢氧化钠固体 ②硝酸银溶液和氯化钠固体 ③水和生石灰
④水和硝酸铵固体 ⑤稀盐酸和硝酸钡溶液 ⑥稀盐酸和纯碱
A、①②③ B、①③⑤ C、①③⑥ D、②④⑥ -
18、如图是稀盐酸和NaOH溶液反应的pH变化曲线图,下列说法正确的是( )
 A、该反应是将NaOH溶液滴入稀盐酸中 B、用湿润的pH试纸测量出A点溶液的pH偏大 C、该反应的微观实质是H+和OH-结合生成水分子 D、B点时加入溶液的质量和另一种溶液的质量一定相同
A、该反应是将NaOH溶液滴入稀盐酸中 B、用湿润的pH试纸测量出A点溶液的pH偏大 C、该反应的微观实质是H+和OH-结合生成水分子 D、B点时加入溶液的质量和另一种溶液的质量一定相同 -
19、出去下列物质中含有的少量杂志,所用除杂方法正确的是( )
选项
物质
杂质
除杂方法
A
O2
N2
通过灼热的铜网
B
KCl固体
MnO2固体
加水溶解、过滤、洗涤、干燥
C
Na2CO3
NaHCO3
加热
D
稀盐酸
稀硫酸
加入适量的Ba(NO3)2溶液,过滤
A、A B、B C、C D、D -
20、下列关于科学实验中“操作—现象—结论”的描述正确的是( )
选项
操作
现象
结论
A
在某固体物质中加入稀盐酸
产生大量气泡
该物质一定是碳酸盐
B
在某溶液中加入氯化钡溶液和稀硝酸
产生白色沉淀
该溶液中一定含有硫酸根离子
C
在稀盐酸和氢氧化钡反应后的溶液中滴加无色酚酞
不变色
两者可能恰好完全反应
D
将某溶液滴在pH试纸上
pH试纸变蓝色
该溶液一定是碱溶液
A、A B、B C、C D、D
版本: