浙教版(新教材)八上 4.3 海洋的探索 同步练习
试卷更新日期:2025-10-02 类型:同步测试
一、选择题
-
1. 粗盐提纯需经过称量、溶解、过滤、蒸发结晶等操作,则下列相关操作规范的是A、
 称量
B、
称量
B、 量取
C、
量取
C、 过滤
D、
过滤
D、 蒸发结晶
2. 从混有少量硝酸钾的食盐晶体中提取较纯的食盐,可供选择的实验步骤:①在较高的温度下制成该晶体的饱和溶液; ②在常温下制成该晶体的饱和溶液; ③升高溶液温度不断蒸发水分,直到有大量固体析出; ④降温至有较多晶体析出; ⑤过滤。正确的操作步骤是 ( )A、①④⑤ B、①④ C、②③ D、②③⑤3. 浙江温州矾山被称为“世界矾都”,如图为结晶池。明矾生产流程为:煅烧明矾石→加水溶解→过滤→蒸发浓缩→析出结晶物,下列说法不正确的是
蒸发结晶
2. 从混有少量硝酸钾的食盐晶体中提取较纯的食盐,可供选择的实验步骤:①在较高的温度下制成该晶体的饱和溶液; ②在常温下制成该晶体的饱和溶液; ③升高溶液温度不断蒸发水分,直到有大量固体析出; ④降温至有较多晶体析出; ⑤过滤。正确的操作步骤是 ( )A、①④⑤ B、①④ C、②③ D、②③⑤3. 浙江温州矾山被称为“世界矾都”,如图为结晶池。明矾生产流程为:煅烧明矾石→加水溶解→过滤→蒸发浓缩→析出结晶物,下列说法不正确的是 A、明矾可用于净水,去除水中的悬浮物 B、过滤后所得液体是均一、稳定的混合物 C、蒸发浓缩时,溶液中溶质的质量变大 D、池底有晶体析出,说明池中明矾溶液已饱和4. 在粗盐精制实验中,三次用到玻璃棒,其作用各不相同。下列对其作用的描述错误的是( )。A、溶解时搅拌,可加速粗盐的溶解 B、溶解时搅拌,可增加氯化钠的溶解度 C、蒸发时搅拌,可使液体受热均匀 D、蒸发时搅拌,可防止晶体飞溅5. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( )
A、明矾可用于净水,去除水中的悬浮物 B、过滤后所得液体是均一、稳定的混合物 C、蒸发浓缩时,溶液中溶质的质量变大 D、池底有晶体析出,说明池中明矾溶液已饱和4. 在粗盐精制实验中,三次用到玻璃棒,其作用各不相同。下列对其作用的描述错误的是( )。A、溶解时搅拌,可加速粗盐的溶解 B、溶解时搅拌,可增加氯化钠的溶解度 C、蒸发时搅拌,可使液体受热均匀 D、蒸发时搅拌,可防止晶体飞溅5. 如图,用下列实验操作可完成两个实验。甲实验为粗盐中难溶性杂质的去除,乙实验为配制溶质的质量分数为 10%的氯化钠溶液。下列说法中,正确的是( ) A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响6. 如图是利用海水提取粗盐的过程,下列说法中正确的是( )
A、甲实验的步骤是①④⑤,其中去除杂质的关键步骤是蒸发 B、甲实验各步操作中,玻璃棒的作用都是相同的 C、乙实验若按照②③①的步骤进行操作,②中称取食盐为 5g,则配制的溶液浓度偏大 D、乙实验中,若①所用的烧杯内壁沾有水,对配制的溶液浓度无影响6. 如图是利用海水提取粗盐的过程,下列说法中正确的是( ) A、海水进入贮水池,海水中不含有杂质 B、在蒸发池中,海水中水的质量逐渐减少 C、析出晶体后的母液是氯化钠的不饱和溶液 D、在蒸发池中,海水中的氯化钠质量逐渐增加7. 小柯同学在实验室做了粗盐提纯的实验,再用提纯得到的精盐配置10%的氯化钠溶液50g,下列说法错误的是( )
A、海水进入贮水池,海水中不含有杂质 B、在蒸发池中,海水中水的质量逐渐减少 C、析出晶体后的母液是氯化钠的不饱和溶液 D、在蒸发池中,海水中的氯化钠质量逐渐增加7. 小柯同学在实验室做了粗盐提纯的实验,再用提纯得到的精盐配置10%的氯化钠溶液50g,下列说法错误的是( ) A、这两个实验的正确操作顺序是①④⑤②③① B、②的操作中若发现指针左偏应继续加砝码或向右调节游码 C、③的操作会使得到的氯化钠溶液溶质质量分数比10%小一些 D、⑤的操作中玻璃棒的作用是搅拌防止局部温度过高,造成液体飞溅8. 某校实验室有一包含有少量氯化钠杂质的硝酸钾固体,科学兴趣小组的同学为了得到纯净的硝酸钾,设计了如图所示的操作,下列有关分析中正确的是 ( )
A、这两个实验的正确操作顺序是①④⑤②③① B、②的操作中若发现指针左偏应继续加砝码或向右调节游码 C、③的操作会使得到的氯化钠溶液溶质质量分数比10%小一些 D、⑤的操作中玻璃棒的作用是搅拌防止局部温度过高,造成液体飞溅8. 某校实验室有一包含有少量氯化钠杂质的硝酸钾固体,科学兴趣小组的同学为了得到纯净的硝酸钾,设计了如图所示的操作,下列有关分析中正确的是 ( ) A、操作Ⅰ~Ⅲ分别是溶解、加热蒸发、过滤 B、操作Ⅰ是过滤,将氯化钠固体从溶液中分离除去 C、操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠 D、操作Ⅲ是过滤,将硝酸钾晶体从溶液中分离出来
A、操作Ⅰ~Ⅲ分别是溶解、加热蒸发、过滤 B、操作Ⅰ是过滤,将氯化钠固体从溶液中分离除去 C、操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠 D、操作Ⅲ是过滤,将硝酸钾晶体从溶液中分离出来二、填空题
-
9. 如表是两种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
31.6
63.9
110
169
246
(1)、60℃时,在100g水中加入120g硝酸钾,充分搅拌,所得溶液为60℃时硝酸钾的(填“饱和”或“不饱和”)溶液。(2)、如果硝酸钾中含有少量氯化钠杂质,要提纯硝酸钾,可先将样品配制成溶液,再用(填“蒸发溶剂”或“冷却热饱和溶液”)的方法获得更高纯度的硝酸钾。10. “直将煮海作耕田”,说的是浙江省考古发现的某盐业遗址,其中制盐过程主要过程包括: (1)、依据盐(氯化钠)的溶解度特点,盐卤煎盐是利用(选填“蒸发结晶”或“冷却热饱和溶液结晶”)。(2)、盐场经上述过程制得的盐是(选填“纯净物”或“混合物”)。(3)、上述制盐过程与粗盐提纯实验操作相似。下图粗盐提纯实验操作示意图,正确的顺序为(填操作示意图的序号)。
(1)、依据盐(氯化钠)的溶解度特点,盐卤煎盐是利用(选填“蒸发结晶”或“冷却热饱和溶液结晶”)。(2)、盐场经上述过程制得的盐是(选填“纯净物”或“混合物”)。(3)、上述制盐过程与粗盐提纯实验操作相似。下图粗盐提纯实验操作示意图,正确的顺序为(填操作示意图的序号)。 11. 红糖是以甘蔗为原料,经榨汁、加热、熬制而成,请根据其制作工序回答下列问题:
11. 红糖是以甘蔗为原料,经榨汁、加热、熬制而成,请根据其制作工序回答下列问题: (1)、制作工序中,乙杯液体属于溶液(选填“饱和”或“不饱和”)。(2)、由甘蔗汁获得红糖晶体的方法是。12. 某科学兴趣小组做粗盐(含有难溶性杂质)提纯实验,以下是他们的实验操作示意图。
(1)、制作工序中,乙杯液体属于溶液(选填“饱和”或“不饱和”)。(2)、由甘蔗汁获得红糖晶体的方法是。12. 某科学兴趣小组做粗盐(含有难溶性杂质)提纯实验,以下是他们的实验操作示意图。A.
 B.
B.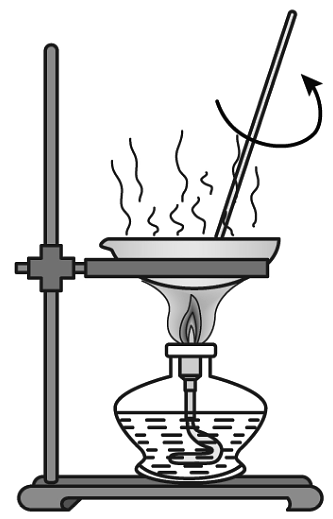 C.
C. D.
D. E.
E. (1)、将上述操作按正确的实验过程进行排序。(2)、图C装置中,漏斗内滤纸的放置方向应为(填序号)。(3)、实验中玻璃棒前后使用了三次,去掉操作(填字母)中的玻璃棒可能会影响到最终食盐的纯净度。13.
(1)、将上述操作按正确的实验过程进行排序。(2)、图C装置中,漏斗内滤纸的放置方向应为(填序号)。(3)、实验中玻璃棒前后使用了三次,去掉操作(填字母)中的玻璃棒可能会影响到最终食盐的纯净度。13.小科同学进行粗盐(含有难溶性杂质)提纯实验,并利用所得精盐配制100g溶质质量分数为17%的氯化钠溶液。

实验一:如图是小科同学进行粗盐提纯实验的操作示意图。
(1)操作⑤中玻璃棒的作用是。
(2)粗盐提纯实验的正确操作顺序为:②⑥(用序号表示)③。
实验二:用提纯得到的精盐配制100g溶质质量分数为17%的氯化钠溶液。
(3)配制该溶液时选用的量筒规格为(填“50”“100”或“500”)mL。
(4)用提纯得到的氯化钠配制上述溶液:经检测,溶质质量分数偏小,其原因可能是(填序号)。
①提纯后得到的氯化钠固体仍然不纯 ②量取水时,仰视读数 ③装瓶时,有少量溶液洒出
14. 从自然界中获得的粗盐,含有较多的不溶性杂质,小明利用所学的知识对粗盐进行提纯 (1)、如图甲所示,对圆形滤纸进行折叠,不应出现的情形是 (填序号)。(2)、图乙中利用玻璃棒的作用是 。(3)、在蒸发结晶(图丙)时,当蒸发皿内出现较多固体时,应该 (填字母)。A、继续加热蒸干水分,再移去酒精灯 B、移去酒精灯,用玻璃棒继续搅拌(4)、小明所获得的精盐产率与其他同学比明显偏低,其原因可能是 (可多选)。A、溶解时将粗盐一次全部倒入水中,立即过滤 B、过滤时滤纸破损 C、蒸发时有一些液体、固体溅出 D、提纯后的精盐未完全干燥就称质量
(1)、如图甲所示,对圆形滤纸进行折叠,不应出现的情形是 (填序号)。(2)、图乙中利用玻璃棒的作用是 。(3)、在蒸发结晶(图丙)时,当蒸发皿内出现较多固体时,应该 (填字母)。A、继续加热蒸干水分,再移去酒精灯 B、移去酒精灯,用玻璃棒继续搅拌(4)、小明所获得的精盐产率与其他同学比明显偏低,其原因可能是 (可多选)。A、溶解时将粗盐一次全部倒入水中,立即过滤 B、过滤时滤纸破损 C、蒸发时有一些液体、固体溅出 D、提纯后的精盐未完全干燥就称质量三、实验与探究题
-
15. 食盐是人们生活中不可缺少的调味剂,随着人们健康意识的不断提高,食盐的种类也越来越多,某化学兴趣小组的同学对加碘盐的制作产生了兴趣并展开了项目化学习。
任务一:从自然界中获得粗盐
【查阅资料】自然界中氯化钠主要存在于海水、盐湖、盐矿等。常用的晒盐方法是从盐湖中获得粗盐。
(1)、 任务二:从粗盐中提纯氯化钠。实验步骤
操作图
实验现象
实验结果
①向粗盐样品中加入100g水充分搅拌,过滤

固体部分溶解,过滤后溶液由浑浊变澄清,滤纸上残留有固体
除去
②将①中所得滤液置于蒸发皿中,恒温蒸发

有白色固体析出
析出固体是氯化钠
(2)、b操作中玻璃棒的作用是。(3)、c步骤中,当蒸发皿内出现较多固体时,应该____(填字母)。A、移去酒精灯,停止搅拌 B、移去酒精灯,用玻璃棒继续搅拌 C、继续加热蒸干水分,再移去酒精灯(4)、任务三:制取加碘盐【信息检索】食盐加碘(碘酸钾)技术的演变经历了以下过程:

【分析研讨】
加碘技术的不断优化,其目的是 (写一点)。
16. 古代晒盐法的主要步骤包括引卤、过箩、储卤、蒸发结晶和铲出。盐湖水的主要成分是氯化钠,还含有泥沙和一定量的硫酸钠等。
此表为氯化钠、硫酸钠在不同温度下的溶解度:
温度 (℃)
0
10
20
30
40
溶解度 (g)
氯化钠
35.7
35.8
36
36.3
36.6
硫酸钠
4.9
9.1
19.5
40.8
48.4
(1)、引卤:盐湖水引入蒸发畦,借助日晒和风吹使水分蒸发,溶液中溶质的质量分数 , (填“增大”或“减小”)得到一定浓度的卤水。(2)、过“箩”:将上述卤水降温冷却,结晶,析出的固体就是所谓的“箩”,“箩”主要是晶体。(3)、晒盐:过“箩” 4-5次后的卤水进入结晶池,继续风吹日晒得到食盐晶体,晒卤水时不能将水全部蒸干, 目的是。