相关试卷
- 浙江省宁波市北仑区2017-2018学年九年级上学期科学期末考试试卷
- 浙江省宁波市江北区2017-2018学年九年级上学期科学期末考试试卷
- 浙江省宁波市鄞州区九校2017-2018学年八年级上学期科学期末考试试卷
- 浙江省宁波市东钱湖九校2017-2018学年七年级上学期科学期中联考试卷
- 浙江省宁波市海曙区2017-2018学年九年级上学期科学期中统考试卷
- 浙江省宁波鄞州区九校2017-2018学年九年级上学期科学月考试卷
- 浙江省宁波鄞州区九校2017-2018学年七年级上学期科学第一次月考试卷
- 浙江省宁波鄞州区九校2017-2018学年八年级上学期科学第一次月考试卷
- 2017-2018学年华师大版八年级上学期科学期中模拟试卷
- 2017-2018学年华师大版九年级上学期科学期中模拟试卷
-
1、请同学们根据常见的可溶性碱的性质回答下列问题。
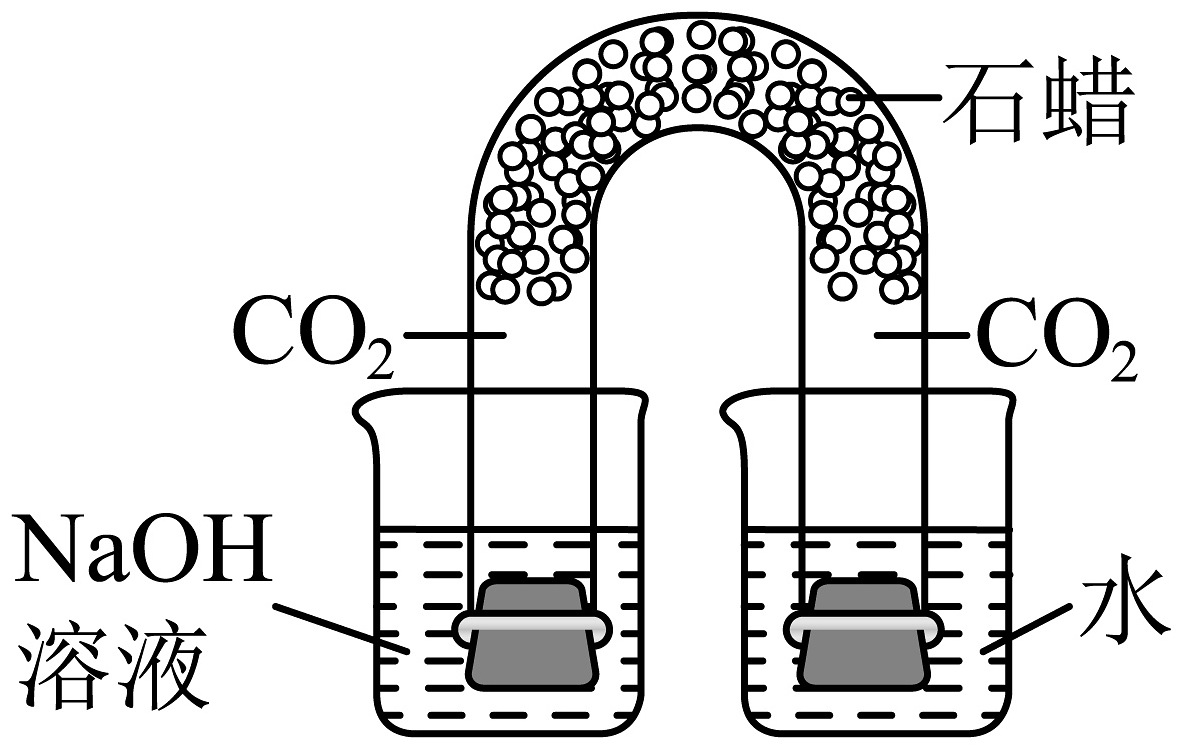 (1)、如图是用U型管改进后的创新实验装置,石蜡使左右两边气体不相通,同时取下U型管两端的橡胶塞2发生反应的证据是。(2)、为验证Ca(OH)2能与某些盐反应且又是碱的通性,可选择的物质是_________(填字母)。A、BaCO3 B、Na2CO3 C、Ba(NO3)2 D、CuSO4
(1)、如图是用U型管改进后的创新实验装置,石蜡使左右两边气体不相通,同时取下U型管两端的橡胶塞2发生反应的证据是。(2)、为验证Ca(OH)2能与某些盐反应且又是碱的通性,可选择的物质是_________(填字母)。A、BaCO3 B、Na2CO3 C、Ba(NO3)2 D、CuSO4 -
2、氢气、木炭、一氧化碳是金属冶炼中常用的还原剂。如图甲、乙、丙均是金属冶炼的三个实验装置。其中丙实验中酒精喷灯给试管加热部位顺序依次为炭粉、氧化铜。
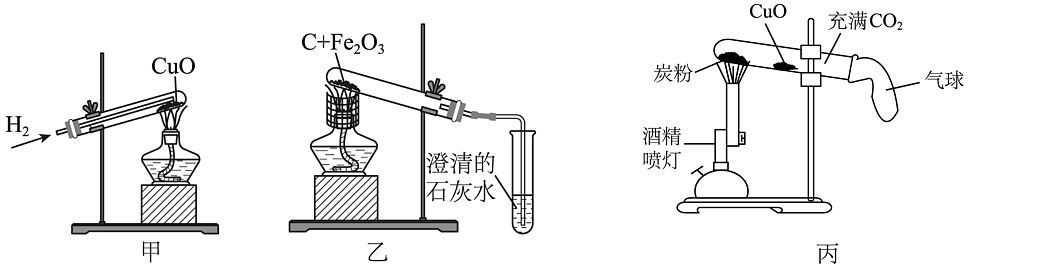 (1)、上述三个金属冶炼的实验中发生的主要反应属于置换反应的是。(填“甲、乙、丙”)(2)、甲实验反应后试管中出现红色固体变成黑色现象的原因。(3)、乙实验的冶炼效果不理想,后采用酒精喷灯代替普通酒精灯重做此实验效果较理想。由此可以推断,原装置冶炼不理想的原因。(4)、写出丙实验中得到金属铜的化学方程式。
(1)、上述三个金属冶炼的实验中发生的主要反应属于置换反应的是。(填“甲、乙、丙”)(2)、甲实验反应后试管中出现红色固体变成黑色现象的原因。(3)、乙实验的冶炼效果不理想,后采用酒精喷灯代替普通酒精灯重做此实验效果较理想。由此可以推断,原装置冶炼不理想的原因。(4)、写出丙实验中得到金属铜的化学方程式。 -
3、某化学活动小组以“酸的化学性质”为主题进行探究性实验学习,请根据如图实验回答下列问题:
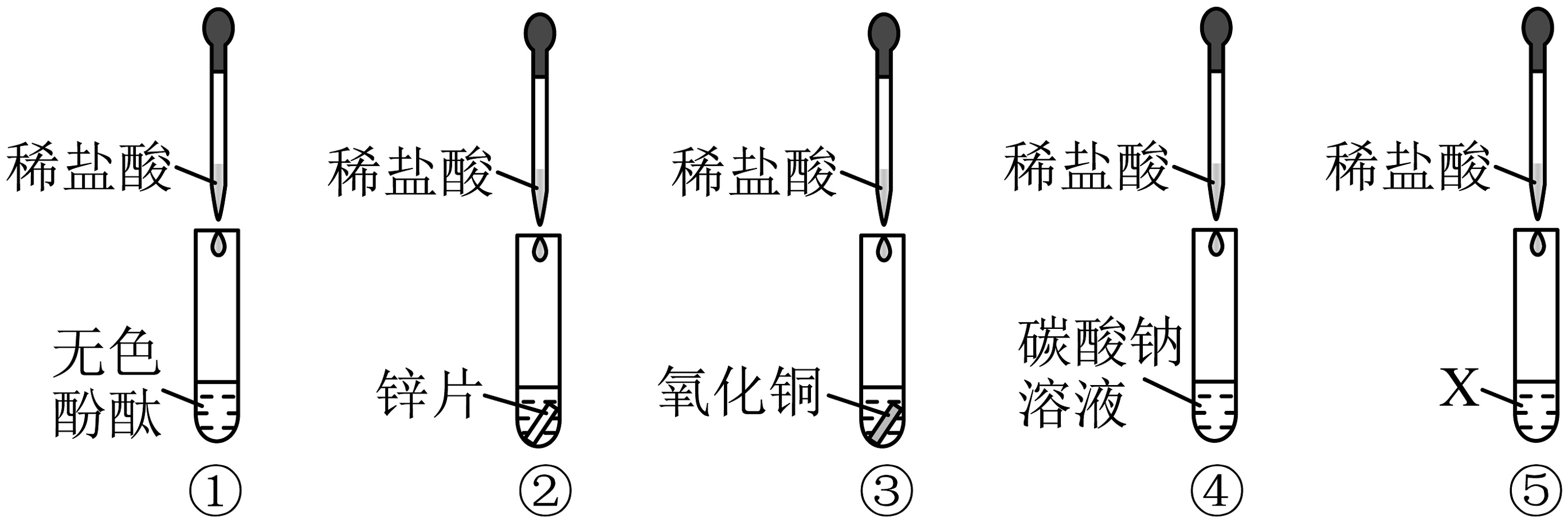 (1)、实验①②③④中观察到产生气泡是试管。(填序号)(2)、实验中观察到试管⑤中物质变黄色溶液,固体X可能是。(3)、取试管③中溶液,逐滴滴加氢氧化钠溶液,发现一段时间后才会有蓝色沉淀产生,则试管③中溶液的溶质是。(4)、将试管①和试管④中溶液都倒入同一烧杯中充分进行混合,有气泡产生且最终溶液呈红色,烧杯中溶液含有的溶质为(除酚酞外)。
(1)、实验①②③④中观察到产生气泡是试管。(填序号)(2)、实验中观察到试管⑤中物质变黄色溶液,固体X可能是。(3)、取试管③中溶液,逐滴滴加氢氧化钠溶液,发现一段时间后才会有蓝色沉淀产生,则试管③中溶液的溶质是。(4)、将试管①和试管④中溶液都倒入同一烧杯中充分进行混合,有气泡产生且最终溶液呈红色,烧杯中溶液含有的溶质为(除酚酞外)。 -
4、金属的用途很广,我们应该节约和保护金属资源,请根据如图实验回答下列问题:
 (1)、实验结果是实验①中的铁钉生锈了,而实验②、③的铁钉没有生锈,则根据实验结果可以得出铁生锈主要是铁与发生反应。(2)、为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前需要加入稀硫酸除去铁锈,化学方程式为。
(1)、实验结果是实验①中的铁钉生锈了,而实验②、③的铁钉没有生锈,则根据实验结果可以得出铁生锈主要是铁与发生反应。(2)、为了预防铁制品生锈,我们常在其表面镀一层抗腐蚀的金属,但在镀金属之前需要加入稀硫酸除去铁锈,化学方程式为。 -
5、表面布满铁锈(铁锈的主要成分是Fe2O3)的铁钉放入盛有稀硫酸的密闭容器中,用压强传感器测得容器内压强随时间的变化曲线如图所示。下列分析正确的是( )
 A、d点时H2SO4反应完,且温度高于a点 B、整个反应过程,溶液中逐渐减少 C、当压强为115千帕时,溶液中的溶质只有FeSO4 D、cd段压强减小是因为铁和稀硫酸反应结束,不再放热
A、d点时H2SO4反应完,且温度高于a点 B、整个反应过程,溶液中逐渐减少 C、当压强为115千帕时,溶液中的溶质只有FeSO4 D、cd段压强减小是因为铁和稀硫酸反应结束,不再放热 -
6、用图像表示化学变化可以提升思维能力,以下四个图像对应的变化过程正确的是( )
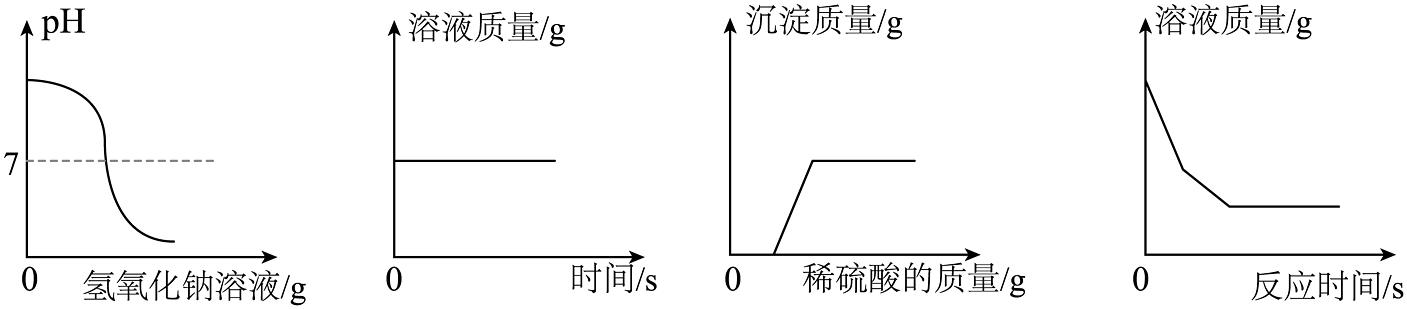 A、向稀盐酸中滴加过量的氢氧化钠溶液 B、浓硫酸长时间露置于空气中 C、向NaOH和BaCl2的混合溶液中加入足量的稀硫酸 D、向足量的硫酸铜溶液中加入铁和镁固体混合物
A、向稀盐酸中滴加过量的氢氧化钠溶液 B、浓硫酸长时间露置于空气中 C、向NaOH和BaCl2的混合溶液中加入足量的稀硫酸 D、向足量的硫酸铜溶液中加入铁和镁固体混合物 -
7、向100g质量分数分别为14.6%HCl和12%MgSO4的混合溶液中,滴加Ba(OH)2溶液至过量。下列图象中,产生的沉淀量与滴入Ba(OH)2相符的是( )A、
 B、
B、 C、
C、 D、
D、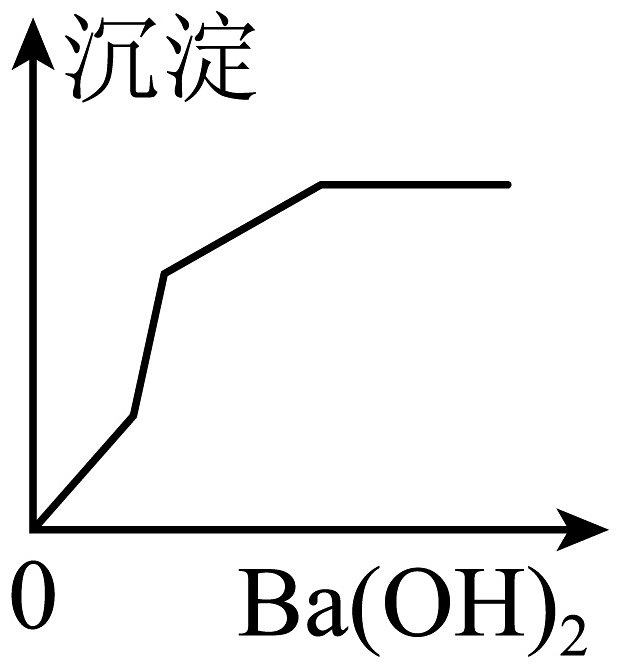
-
8、重结晶后的食盐中往往还含有少量的硫酸钠、氯化镁、氯化钙等杂质,它们在溶液中主要以、Ca2+、Mg2+的形式存在,为将这些杂质除净,可向食盐溶液中加入过量的氢氧化钠、碳酸钠、氯化钡溶液,最后经过过滤、蒸发得到精盐。下列操作及加入溶液顺序错误的是( )A、BaCl2、NaOH、Na2CO3、过滤、HCl B、BaCl2、Na2CO3、NaOH、过滤、HCl C、NaOH、BaCl2、Na2CO3、过滤、HCl D、Na2CO3、BaCl2、NaOH、过滤、HCl
-
9、久置NaOH易变质,为检验一瓶久置NaOH溶液是否已完全变质,有以下几种验证方法,其中正确的是( )
①用pH试纸测得反应后的溶液pH大于7,表示NaOH未完全变质;
②不断滴加稀盐酸,如果一段时间后出现气泡,表示NaOH未完全变质;
③滴加过量 , 过滤后在滤液中滴加酚酞,如果变红,表示NaOH未完全变质;
④滴加过量反应后取上层清液,滴加无沉淀生成,表示NaOH完全变质。
A、①② B、②③ C、②④ D、③④ -
10、下列各项实验操作,能达到目的的是( )A、加入适量的CaCl2溶液,可以达到已经部分变质的NaOH除杂的目的 B、为除去MnO2固体中的KCl,必须经过溶解、过滤、蒸发结晶的过程 C、用加入适量铜粉再过滤的方法除去Cu(NO3)2溶液中混有的AgNO3 D、向某无色未知溶液中加入BaCl2溶液,以检验溶液中的存在
-
11、下图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论不正确的是 ( )
 A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子是Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子
A、反应结束时溶液的pH=7 B、反应前后元素的种类没有变化 C、氢氧化钠溶液中存在的粒子是Na+和OH- D、该反应的实质是H+和OH-结合生成H2O分子 -
12、一般地说,金属越活泼,冶炼越困难,则甲代表的金属是( )
 A、铁 B、铜 C、钠 D、锌
A、铁 B、铜 C、钠 D、锌 -
13、2024年4月25日晚我国“神舟十八号”发射成功,这标志着中国空间探索事业的重要进步,为未来的空间站建设和技术验证提供了支持。
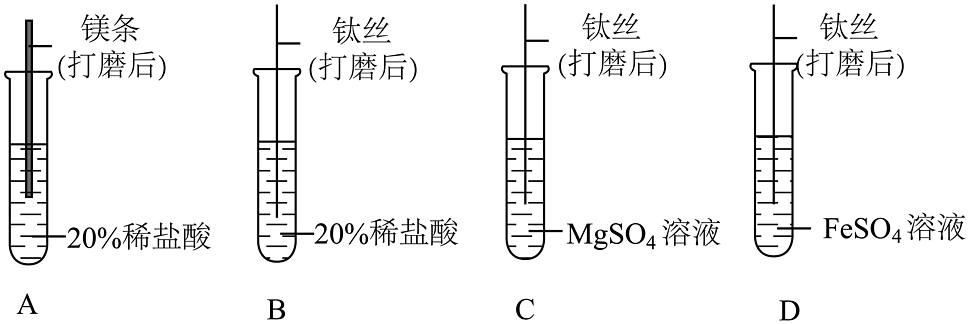 (1)、火箭制造用到了钛合金材料,你认为钛合金应具有的优点是(写一点)。已知钛的金属活动性顺序位于镁和铁之间,下列验证这三种金属活动性顺序的实验中,可行的组合是(填字母)。(2)、火箭发射的推进剂含有偏二甲肼,燃烧时反应为C2H8N2+2N2O42CO2+4H2O+3X,则X为。(3)、为提高供电能力,神舟十八号飞船的主电源储能电池由镉镍电池更改为锂离子电池,电池放电过程中能量转化关系为(4)、宇航员呼吸产生的CO2 , 采用氢氧化锂吸收的方式处理,结合图1分析,选用氢氧化锂而不用价格更便宜的氢氧化钠的原因是:。
(1)、火箭制造用到了钛合金材料,你认为钛合金应具有的优点是(写一点)。已知钛的金属活动性顺序位于镁和铁之间,下列验证这三种金属活动性顺序的实验中,可行的组合是(填字母)。(2)、火箭发射的推进剂含有偏二甲肼,燃烧时反应为C2H8N2+2N2O42CO2+4H2O+3X,则X为。(3)、为提高供电能力,神舟十八号飞船的主电源储能电池由镉镍电池更改为锂离子电池,电池放电过程中能量转化关系为(4)、宇航员呼吸产生的CO2 , 采用氢氧化锂吸收的方式处理,结合图1分析,选用氢氧化锂而不用价格更便宜的氢氧化钠的原因是:。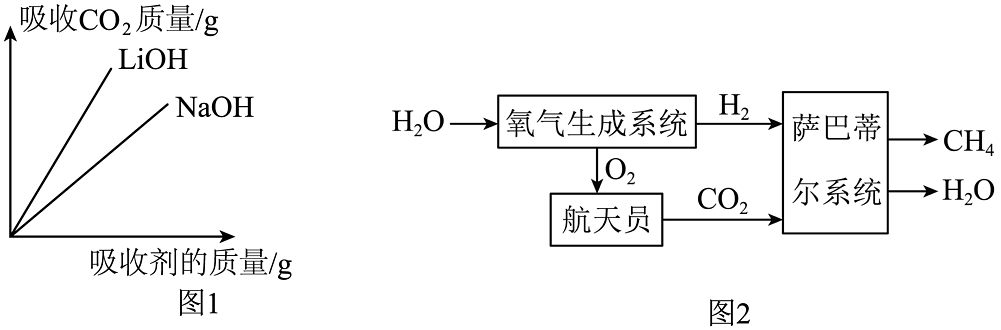 (5)、航天员预计要在天宫空间站生活半年,期间约需氧气480kg。图2是水气整合系统,其中“氧气生成系统”的原理是电解水,通过“萨巴蒂尔系统”处理航天员排出的。
(5)、航天员预计要在天宫空间站生活半年,期间约需氧气480kg。图2是水气整合系统,其中“氧气生成系统”的原理是电解水,通过“萨巴蒂尔系统”处理航天员排出的。①“萨巴蒂尔系统”内部提供高温、高压和催化剂等条件,写出该系统内反应的化学方程式:。
②若该空间站所需氧气的一半由该水气整合系统提供,整个过程需要不断补充水,理由是。
-
14、小柯用过量的稀盐酸溶液和石灰石反应制取二氧化碳后(石灰石中的杂质既不溶于水也不和酸反应),得到了含有HCl和CaCl2的混合溶液。为了探究该混合溶液中氯化钙的质量分数,他又进行如下实验:取100克混合溶液于烧杯中,逐滴滴入碳酸钠溶液,观察并记录相应数据,结果如图1所示。
 (1)、小柯发现碳酸钠溶液与混合溶液反应时存在多步反应,则a曲线涉及的化学反应所属的基本类型是。(2)、求混合溶液中氯化钙的质量分数。(3)、如图2表示原混合溶液中离子的分布情况,当所加碳酸钠溶液质量为120克时,所得溶液中相关离子数量关系正确的是____(填字母)。
(1)、小柯发现碳酸钠溶液与混合溶液反应时存在多步反应,则a曲线涉及的化学反应所属的基本类型是。(2)、求混合溶液中氯化钙的质量分数。(3)、如图2表示原混合溶液中离子的分布情况,当所加碳酸钠溶液质量为120克时,所得溶液中相关离子数量关系正确的是____(填字母)。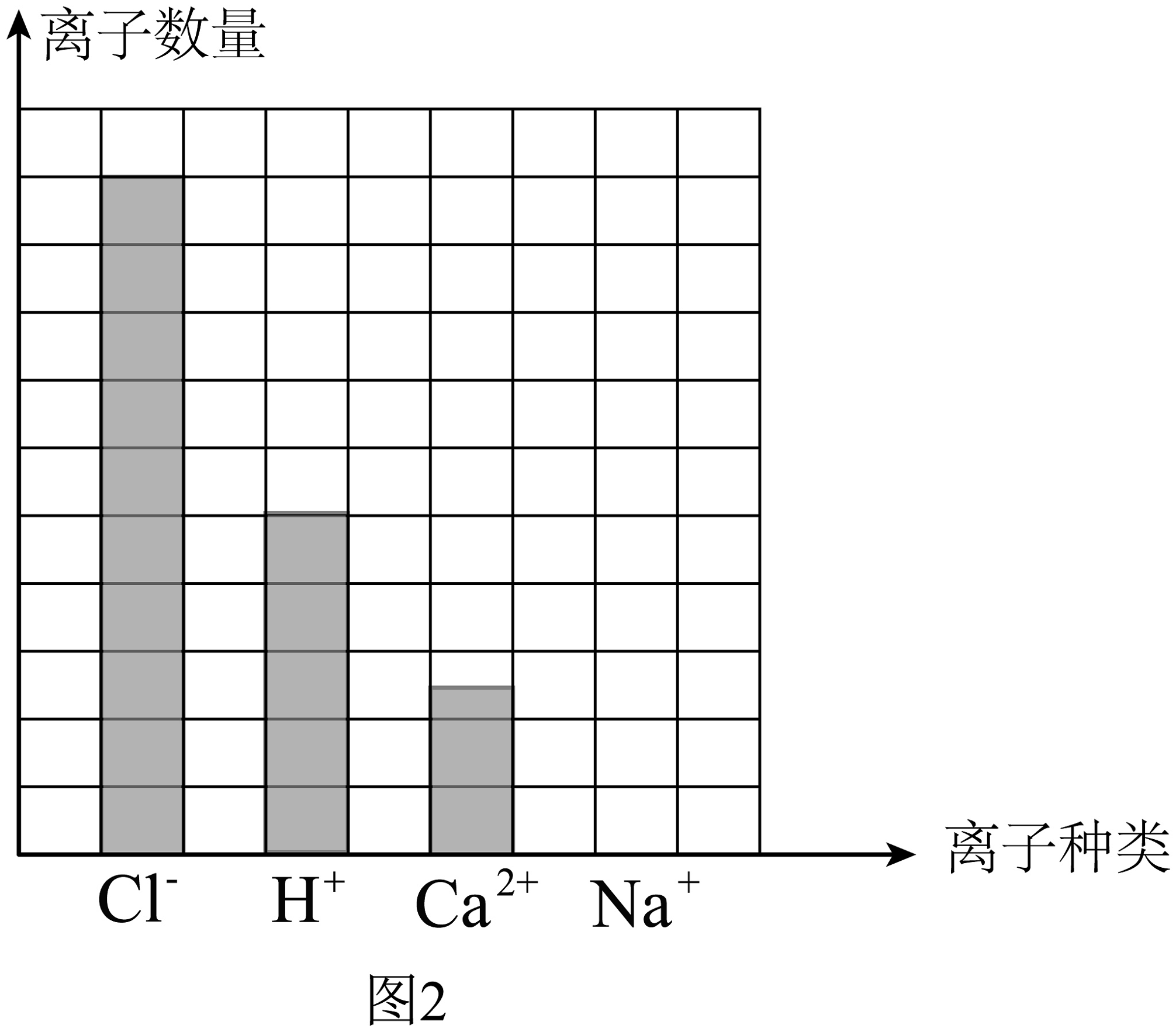 A、
A、 B、
B、 C、
C、
-
15、将铁粉和稀硫酸先后加入到一定量的硫酸铜溶液中,搅拌使之充分反应,实验过程中加入物质的质量与烧杯中剩余固体的质量关系如图所示。
 (1)、m=。(2)、b点剩余固体成分为:。(3)、求c点所得溶质的质量。
(1)、m=。(2)、b点剩余固体成分为:。(3)、求c点所得溶质的质量。 -
16、科学小组参与“铅蓄废电池中硫酸回收”的研学项目,回收时需要测定电池废液中硫酸的质量分数。向装有25g废液的锥形瓶中加入质量分数为8%的氢氧化钠溶液,并充分搅拌,利用pH计等电子设备采集信息并绘制的图像如图,请据图回答相关问题。
 (1)、该反应的微观本质是。(2)、计算该电池废液中H2SO4的质量分数。(3)、若实验所用的氢氧化钠溶液变质,则会导致测定废液中硫酸的质量分数结果(选填“偏大”、“偏小”或“不变”)。
(1)、该反应的微观本质是。(2)、计算该电池废液中H2SO4的质量分数。(3)、若实验所用的氢氧化钠溶液变质,则会导致测定废液中硫酸的质量分数结果(选填“偏大”、“偏小”或“不变”)。 -
17、目前,免拆型手术缝合线广泛应用于手术中,它是用新型生物降解材料——聚乳酸[(C3H4O2)n]制作而成。聚乳酸可以通过以下路径制取。
 (1)、从物质分类角度看,乳酸属于(选填“有机物”或“无机物”)。(2)、聚乳酸中碳元素和氧元素的质量比为。(3)、如果二氧化碳中的碳元素全部进入葡萄糖,则生产2.4千克葡萄糖,消耗二氧化碳的质量为多少千克?
(1)、从物质分类角度看,乳酸属于(选填“有机物”或“无机物”)。(2)、聚乳酸中碳元素和氧元素的质量比为。(3)、如果二氧化碳中的碳元素全部进入葡萄糖,则生产2.4千克葡萄糖,消耗二氧化碳的质量为多少千克? -
18、盐碱地中所含的盐分影响作物的正常生长,对其开发利用是提高农业产能的途径,但也是世界性难题。查阅资料发现盐碱地的土壤中可能含有的物质有KCl、CaCl2、Na2SO4、Na2CO3。
【设计实验】为探究土壤中含有的物质,同学们设计了如图所示的实验。
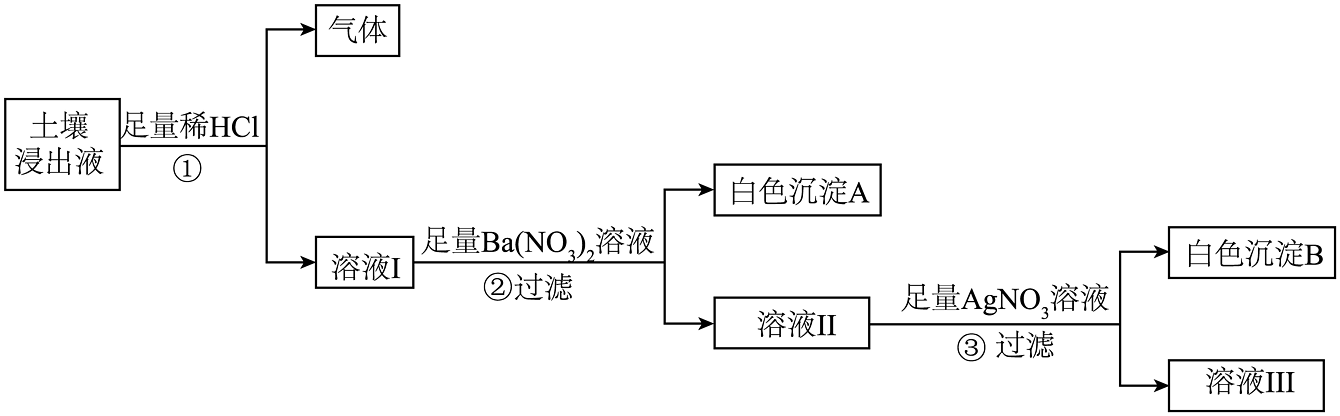
步骤
现象
判断土壤浸出液中所含的物质情况
①
有气泡产生
一定有Na2CO3
②
存白色沉淀A生成
一定有Na2SO4
③
有白色沉淀B生成
KCl、CaCl2中至少含有一种
步骤③中的生成的沉淀是(填化学式)。
【评价改进】
评价指标
优秀
合格
待改进
实验环节与分析的合理性
试剂选用合理且分析结论科学合理
试剂选用合理但分析结论存在错误
试剂选用不合理且分析结论存在错误
结合评价量表,老师对同学们的探究实验进行打分,给出了待改进的评价。其理由为:
Ⅰ.根据步骤①推导出土壤浸出液中一定有Na2CO3 , 就可以判断一定无 , 故存在分析结论错误;
Ⅱ.由于步骤①中加入稀盐酸,对判断KCl是否存在产生干扰,故存在试剂选用不合理的错误。若要能确定KCl是否存在,应如何改进:。
【反思总结】根据原实验方案,可以确定土壤中一定含有:。
-
19、如图是一个趣味变色实验,同学们对混合后溶液变色时间的影响因素进行探究。资料:碘酒为碘(I2)的酒精溶液;淀粉遇I2变蓝,在本实验中作为指示剂,指示I2是否存在。
【进行实验】分别向烧杯A、B中加入相应溶液,然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间。
序号
烧杯A
烧杯B
变色时间/s
3%H2O2溶液体积/mL
水的体积/mL
1%淀粉溶液体积/mL
2%碘酒体积/mL
水的体积/mL
维生素C片/粒
①
10
20
2
2
23
2
595
②
10
20
2
5
20
2
193
③
10
20
2
10
15
2
39
④
5
25
2
5
20
2
399
⑤
20
10
2
5
20
2
78
说明:本实验中,溶液总体积可看作是各液体的体积之和,A烧杯控制溶液总体积为32mL,B烧杯控制溶液总体积为25mL。
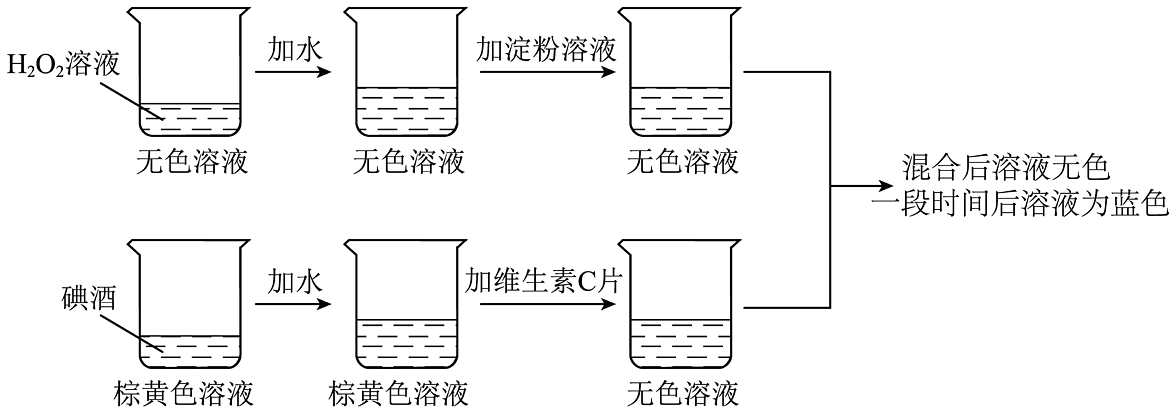 (1)、实验①②③探究对混合后溶液变色时间的影响。(2)、根据实验②④⑤可以得出结论:。(3)、序号④实验组中,若将碘酒溶液体积改为10mL,则混合后溶液的变色时间范围是。(4)、为了证明维生素C的用量对混合后溶液变色时间也有影响,增加实验⑥:向烧杯A中加入20mL3%H2O2溶液、10mL水、2mL1%淀粉溶液,向B烧杯中加入 , 然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间。
(1)、实验①②③探究对混合后溶液变色时间的影响。(2)、根据实验②④⑤可以得出结论:。(3)、序号④实验组中,若将碘酒溶液体积改为10mL,则混合后溶液的变色时间范围是。(4)、为了证明维生素C的用量对混合后溶液变色时间也有影响,增加实验⑥:向烧杯A中加入20mL3%H2O2溶液、10mL水、2mL1%淀粉溶液,向B烧杯中加入 , 然后将两只烧杯中的溶液混合,记录混合后溶液由无色变为蓝色的时间。 -
20、小柯设计了如图装置来探究动能的影响因素,其中所用物块为木块。
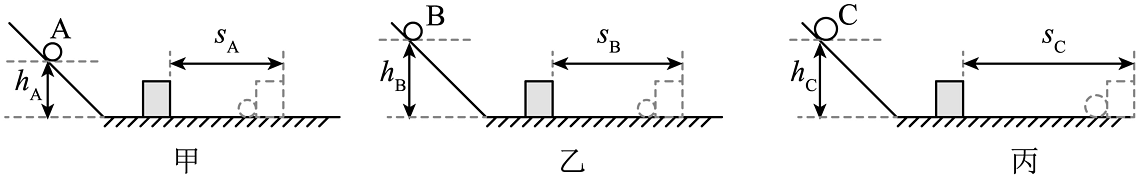 (1)、实验中利用木块被碰撞后移动的距离来比较物体的动能大小。下列实例中与此实验方法相同的有。(填编号)
(1)、实验中利用木块被碰撞后移动的距离来比较物体的动能大小。下列实例中与此实验方法相同的有。(填编号)①认识电流大小时,用水流进行类比
②用红墨水在水中的扩散现象来认识分子是运动的
③用吸引大头针的多少来比较电磁铁的磁性强弱
(2)、小柯通过甲、丙两次实验初步得出“物体动能的大小与质量有关”的结论,小柯得出这个结论是否具有科学性,请说明理由。(3)、做丙图实验时,木块被撞后滑出木板掉落,为防止因此造成木块损坏,需改进实验装置或实验方案。在不改变木板长度的情况下,可以采用以下__________方法。A、适当减小钢球C的质量 B、给丙组水平木板铺上毛巾 C、适当降低钢球C的高度,使hC=hA D、给丙组换用一个较重的木块(4)、实验后,同学们联想到汽车的“超载”与“超速”是造成交通事故的最大安全隐患。为探究“超载”与“超速”,哪个造成的危害更严重?小柯利用上述装置进行了实验测定,得到的数据如表。实验序号
小球的质量m/g
小球自由滚下的高度h/cm
木块被撞后运动的距离s/m
1
30
10
4
2
30
20
16
3
60
20
32
由实验可知:当发生交通事故时,造成的危害更严重。