相关试卷
- 【浙教版2024】(新教材)八年级上册 第一章 对环境的察觉 单元检测卷(基础)
- 浙教版2024(新教材)八上1.5 透镜和视觉(2) 同步练习
- 浙教版2024(新教材)八上1.5 透镜和视觉(1) 同步练习
- 浙教版2024(新教材)八上1.4 光的反射和折射(4) 同步练习
- 浙教版2024(新教材)八上1.4 光的反射和折射(3) 同步练习
- 浙教版2024(新教材)八上1.4 光的反射和折射(2) 同步练习
- 【浙教版2024】七上2.5生物的多样性 同步练习
- 【浙教版2024】七上2.4生物的分类 同步练习
- 【浙教版2024】七上2.3多姿多彩的动物 同步练习
- 【浙教版2024】七上2.2形形色色的植物 同步练习
-
1、以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为m1的金属锡粉。②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2。③打开容器,听到了空气进入容器发出的“丝丝的声响”,称量所得白色物质的质量为m3。④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4。
(1)、根据所学知识判断:锡的燃烧是变化。(2)、罗蒙诺索夫分析数据后发现,生成白色物质的质量m3= , 于是提出了“参加反应的物质的总质量,等于反应后产物的总质量”的观点。 -
2、A-I是初中化学所学的物质,其转换关系如图所示。按单质、氧化物、酸、碱、盐分类,A、B、D、E、F是不同类别的物质,C、G、H、I、F也是不同类别的物质;A、B、C中含有同种元素,B是导致“温室效应”的一种气体。图中“一”表示两端的物质能发生化学反应,“→”表示物质间存在相应的转化关系(部分反应物、生成物和反应条件未标出)。请回答:
 (1)、物质B的化学式:;(2)、反应①的基本反应类型是;(3)、反应②的化学方程式是
(1)、物质B的化学式:;(2)、反应①的基本反应类型是;(3)、反应②的化学方程式是 -
3、易拉罐的主要成分是铝镁合金(已知其他杂质不溶于酸也不与稀硫酸反应),为了测定易拉罐铝镁合金中两种元素的质量比,小明开展了如图甲的实验,实验中生成沉淀的质量与滴入氢氧化钠溶液的质量的关系如图乙所示。
资料:氢氧化铝是一种白色沉淀,可与氢氧化钠反应: , 氢氧化镁不与氢氧化钠反应。


(1)操作①表示的物质分离方法是。
(2)当滴入氢氧化钠溶液为c克时,充分反应后,溶液乙中的溶质为(填化学式)。
(3)根据实验数据,该易拉罐中铝元素和镁元素的质量比为(用和表示)。
-
4、某物质可能由Na2CO3、NaHCO3、NaOH中的一种或二种混合而成,在固体中逐滴滴入盐酸,与盐酸反应图象如图:
 , 且c>2b。已知:Na2CO3+HCl=NaHCO3+NaCl;NaHCO3+HCl=NaCl+H2O+CO2↑;NaHCO3+NaOH=Na2CO3+H2O则该固体的组成可能是。
, 且c>2b。已知:Na2CO3+HCl=NaHCO3+NaCl;NaHCO3+HCl=NaCl+H2O+CO2↑;NaHCO3+NaOH=Na2CO3+H2O则该固体的组成可能是。 -
5、“波尔多液”是一种保护性的杀菌剂,有效成分为碱式硫酸铜,具有杀菌谱广、持效期长、病菌不会产生抗药性、对人和畜低毒等特点,是应用历史最长的一种杀菌剂。如图所示是利用废弃铜料(只含有铜和一定量的铁)和石灰石制备“波尔多液”的流程,请回答下列问题。

(1)反应器1中将硫酸以喷淋方式注入的目的是 , 反应器1的作用是。
(2)反应器4中发生反应的化学方程式是(写一个即可)。
(3)气体B的化学式为。
(4)反应器3和反应器4的内壁不能为铁或铝,原因是。
-
6、化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如表(微溶物视为可溶物):
实验
A+B
A+C
A+D
B+C
现象
产生气体
产生沉淀
产生沉淀
产生沉淀
(1)、写出溶液A与D反应的化学方程式:(2)、将碳酸钠和碳酸氢钠的混合物10g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为(写最简比)。 -
7、往一定量某浓度的CuSO4溶液中逐滴加入Ba(OH)2溶液,溶液的pH随滴入Ba(OH)2溶液体积的变化曲线如图甲,电导率随时间的变化如图乙所示。(电导率越高表示溶液的离子浓度越高,导电性越强)。下列说法不正确的是( )
 A、由图甲可知CuSO4溶液显酸性 B、图乙中B点和D点电导率相同是因为它们溶液的成分相同 C、图乙中的C点表示两种溶液恰好完全反应,液体的pH=7 D、图乙中D点表示滴加Ba(OH)2溶液大于50mL且溶液呈碱性
A、由图甲可知CuSO4溶液显酸性 B、图乙中B点和D点电导率相同是因为它们溶液的成分相同 C、图乙中的C点表示两种溶液恰好完全反应,液体的pH=7 D、图乙中D点表示滴加Ba(OH)2溶液大于50mL且溶液呈碱性 -
8、向装有澄清石灰水的试管中通入CO2 , 澄清石灰水会变浑浊。如果继续通入CO2 , 浑浊的液体又会变成澄清,此时发生的反应是:CO2+H2O+CaCO3=Ca(HCO3)2。然后,向变澄清的溶液中滴加质量分数为10%的稀盐酸,会发生反应:Ca(HCO3)2+2HCl=2CO2↑+2H2O+CaCl2。整个过程沉淀或气体的质量m1与加入物质质量m2关系如图所示。下列说法错误的是( )
 A、澄清石灰水中所含氢氧化钙的质量为7.4g B、反应至A点,反应所需要的CO2质量为8.8g C、反应至B点,溶液的溶质为CaCl2和Ca(HCO3)2 D、反应停止,需要稀盐酸质量总共73g
A、澄清石灰水中所含氢氧化钙的质量为7.4g B、反应至A点,反应所需要的CO2质量为8.8g C、反应至B点,溶液的溶质为CaCl2和Ca(HCO3)2 D、反应停止,需要稀盐酸质量总共73g -
9、小敏称取等质量的铜粉和铁粉,分别加入到25毫升溶质质量分数为12%的硝酸银溶液中(如图所示),充分反应。下列情况可能出现的是( )
 A、铁和铜都有剩余,甲乙生成银的质量比为7:8 B、铁和铜都没有剩余,甲乙生成银的质量比为1:1 C、铁有剩余,铜没有剩余,甲乙生成银的质量比为15:16 D、铜有剩余,铁没有剩余,甲乙生成银的质量比为15:14
A、铁和铜都有剩余,甲乙生成银的质量比为7:8 B、铁和铜都没有剩余,甲乙生成银的质量比为1:1 C、铁有剩余,铜没有剩余,甲乙生成银的质量比为15:16 D、铜有剩余,铁没有剩余,甲乙生成银的质量比为15:14 -
10、取200g一定质量分数的CuSO4溶液,先逐滴滴加100gBa(OH)2溶液至b点,后再逐滴滴加稀HCl溶液至过量,整个过程中加入溶液的质量与沉淀质量关系如图所示。下列说法不正确的是( )
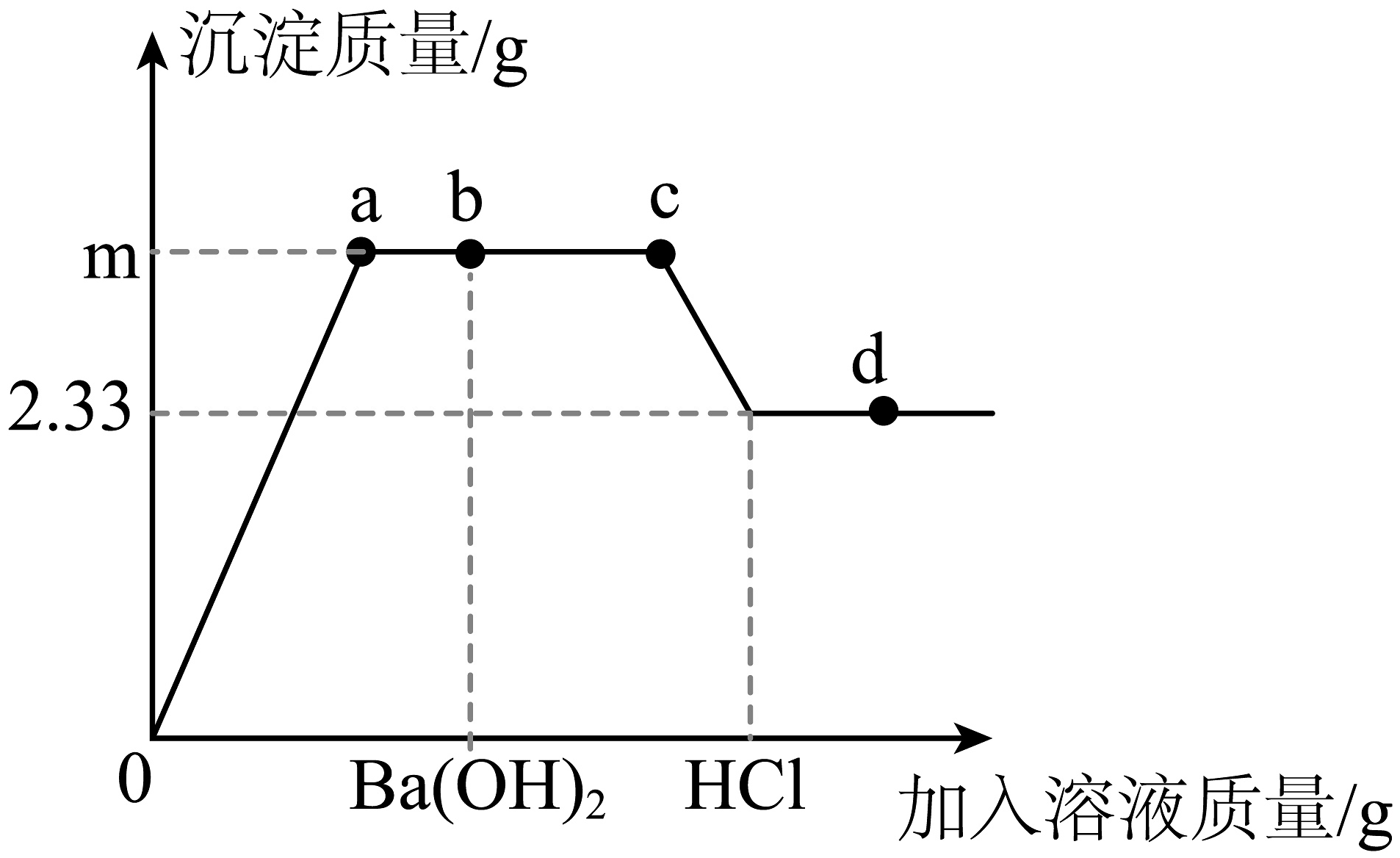 A、0a段溶液的导电性将逐渐减弱 B、至d点时溶液中所含的溶质有BaCl2、CuCl2、HCl C、bc段发生反应的化学方程式2HCl+Ba(OH)2=BaCl2+2H2O D、m的值是3.35g
A、0a段溶液的导电性将逐渐减弱 B、至d点时溶液中所含的溶质有BaCl2、CuCl2、HCl C、bc段发生反应的化学方程式2HCl+Ba(OH)2=BaCl2+2H2O D、m的值是3.35g -
11、向100g稀硫酸中先加入20g的CuO粉末充分反应后再加入20g的铁粉,所得溶液质量与加入粉末总质量之间的关系如图所示,下列分析中不正确的是( )
 A、原稀硫酸的溶质质量分数为19.6% B、m值为16 C、d点对应的溶液质量为111.2g D、当加入固体n克时析出的固体总质量为16.8克
A、原稀硫酸的溶质质量分数为19.6% B、m值为16 C、d点对应的溶液质量为111.2g D、当加入固体n克时析出的固体总质量为16.8克 -
12、某锥形瓶中含有碳酸钠和氢氧化钠的混合液50g,向其中加入溶质质量分数为9.8%的稀硫酸,瓶中溶液质量与加入的稀硫酸质量的关系如图所示。下列说法错误的是( )
 A、反应至B点时,锥形瓶中溶液质量为100g B、反应至C点时,锥形瓶内溶液中硫酸钠的质量为14.2g C、若向D点对应的溶液中滴加紫色石蕊试液,溶液变红色 D、整个过程溶液中氢元素质量的变化大致与溶液质量变化一致
A、反应至B点时,锥形瓶中溶液质量为100g B、反应至C点时,锥形瓶内溶液中硫酸钠的质量为14.2g C、若向D点对应的溶液中滴加紫色石蕊试液,溶液变红色 D、整个过程溶液中氢元素质量的变化大致与溶液质量变化一致 -
13、一定质量的氯酸钾与二氧化锰的混合物,加热一段时间后,二氧化锰的含量由a%增加到b%,则产生的氧气占原混合物质量百分比为( )A、 B、 C、 D、
-
14、某组成为CaHbNc(a、b、c为正整数)的 ABS工程树脂可通过下面的反应制得:

则参加反应的原料中丙烯腈和1,3-丁二烯的分子个数之比为( )
A、 B、 C、 D、无法确定 -
15、下表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃),试回答下列问题:
溶液中溶质的质量分数(%)
4
12
15
24
28
硫酸溶液的密度(克/毫升)
1.02
1.08
1.11
1.17
1.20
氨水的密度(克/毫升)
0.98
0.95
0.94
0.91
0.90
(1)20℃时,随着溶液中溶质的质量分数逐渐增大,氨水溶液的密度逐渐(填增大、减小或不变)。
(2)取100克28%的硫酸溶液配制成4%的溶液,需要加水多少克?
(3)100克24%的氨水加入100克水,摇匀后溶液的体积为多少毫升?
-
16、将体积V=0.2×10–3m3的物块A竖直挂在弹簧测力计下,在空气中静止时弹簧测力计的示数F1=2.6N。将物块A浸没在水中,静止时弹簧测力计的示数为F2 , 如图所示(图中弹簧测力计指针未画出)。已知水的密度ρ水=1.0×103kg/m3 , g取10N/kg。求:(本题要求写出计算过程)
 (1)、求物块A浸没在水中受到的浮力F浮;(2)、求弹簧测力计的示数为F2;(3)、求物块A的密度。
(1)、求物块A浸没在水中受到的浮力F浮;(2)、求弹簧测力计的示数为F2;(3)、求物块A的密度。 -
17、为探究影响浮力大小的因素,小明用量程是0~5N的弹簧测力计做了如图所示的实验:
 (1)、进行实验步骤A、B、C的目的是探究浮力大小与的关系;为研究浮力大小与液体密度是否有关,应选择的实验步骤是;(2)、D中物体受到浮力大小为N。
(1)、进行实验步骤A、B、C的目的是探究浮力大小与的关系;为研究浮力大小与液体密度是否有关,应选择的实验步骤是;(2)、D中物体受到浮力大小为N。 -
18、一块橡皮泥捏成实心球状,轻轻放到烧杯内的水面上,静止之后,实心球橡皮泥沉到容器底部,再把它捏成碗状,轻轻放到该烧杯内的水面上,橡皮泥漂浮在水面上,如图所示。

(1)图甲中橡皮泥所受浮力其重力。(选填“大于”、“等于”或“小于”)
(2)乙图中的橡皮泥做成中空的形状,比甲图能够排开更多的水,橡皮泥所受的浮力(选填“增大”、“减小”或“相同”),使密度大于水的橡皮泥在水中静止时能够漂浮水面,利用这个原理,人们用钢铁制造了轮船。
-
19、某科学兴趣小组的同学进行粗盐提纯实验,请回答下列问题:
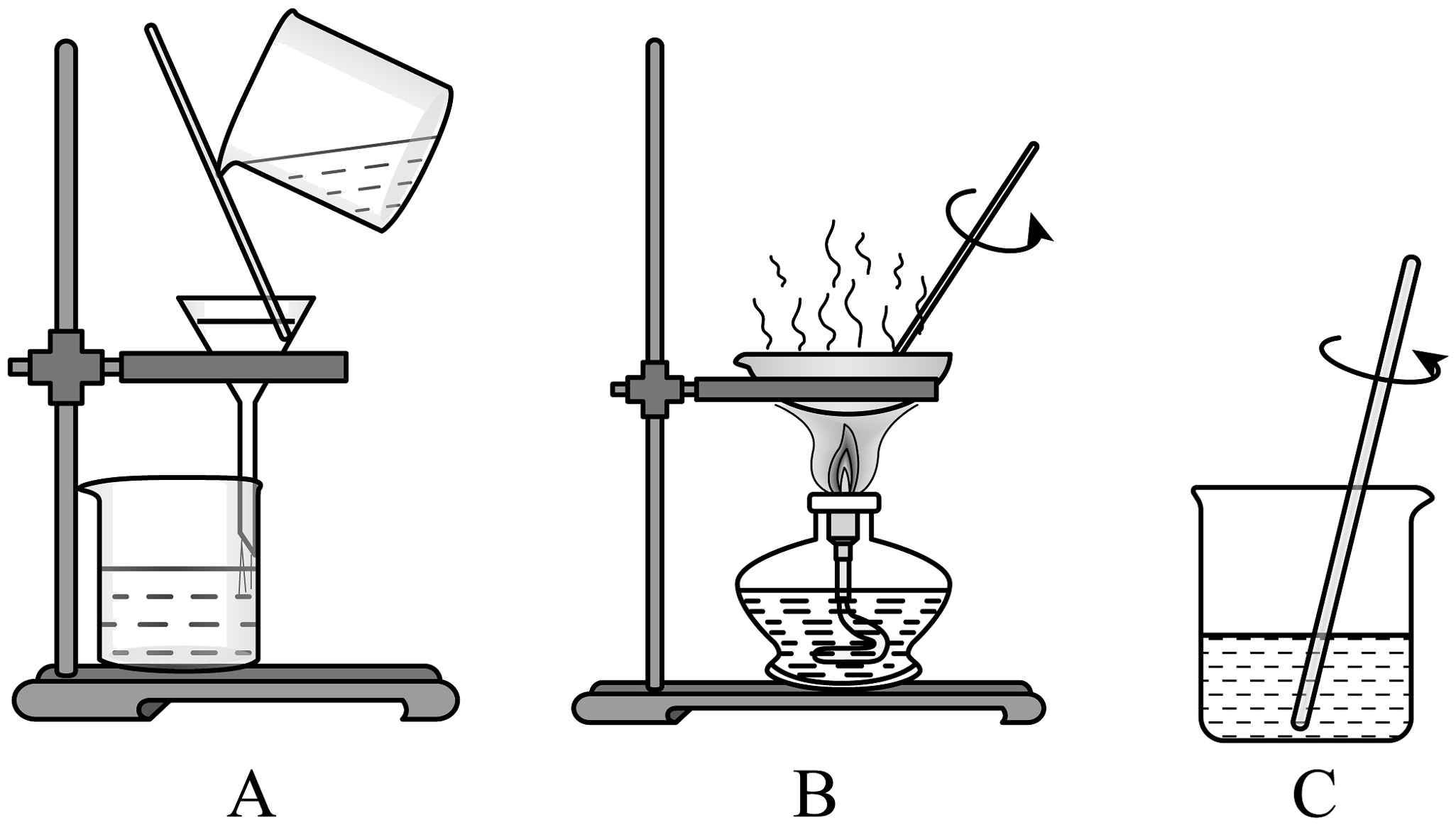
(1)为了除去粗盐中泥沙等不溶性杂质,小组同学设计了如图三个步骤。请给这些步骤排序。(填字母)
(2)玻璃棒在A操作中的作用是。
-
20、溶液在日常生活和工农业生产中具有广泛用途。请回答到问题:(1)、碘酒是医院里常用的消毒药品,碘酒中的溶剂是。(2)、打开汽水的瓶盖后往往有大量的气泡冒出,喝了汽水会打嗝,这两个现象分别说明了气体溶解度与和有关。