相关试卷
- 浙江省宁波市北仑区2017-2018学年九年级上学期科学期末考试试卷
- 浙江省宁波市江北区2017-2018学年九年级上学期科学期末考试试卷
- 浙江省宁波市鄞州区九校2017-2018学年八年级上学期科学期末考试试卷
- 浙江省宁波市东钱湖九校2017-2018学年七年级上学期科学期中联考试卷
- 浙江省宁波市海曙区2017-2018学年九年级上学期科学期中统考试卷
- 浙江省宁波鄞州区九校2017-2018学年九年级上学期科学月考试卷
- 浙江省宁波鄞州区九校2017-2018学年七年级上学期科学第一次月考试卷
- 浙江省宁波鄞州区九校2017-2018学年八年级上学期科学第一次月考试卷
- 2017-2018学年华师大版八年级上学期科学期中模拟试卷
- 2017-2018学年华师大版九年级上学期科学期中模拟试卷
-
1、对比有利于反现事物的共性与个性。为探究酸的性质,同学们进行了如下对比实验。
实验内容
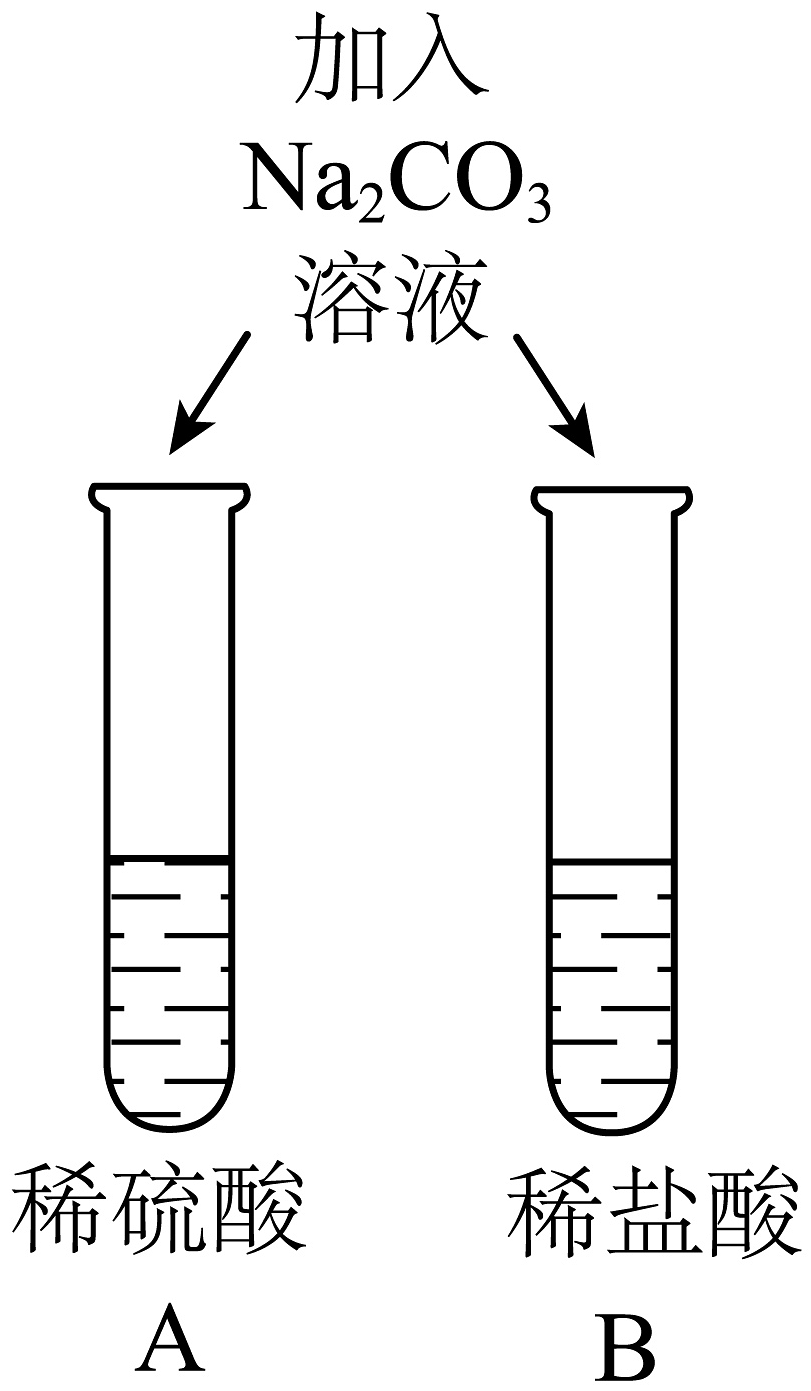
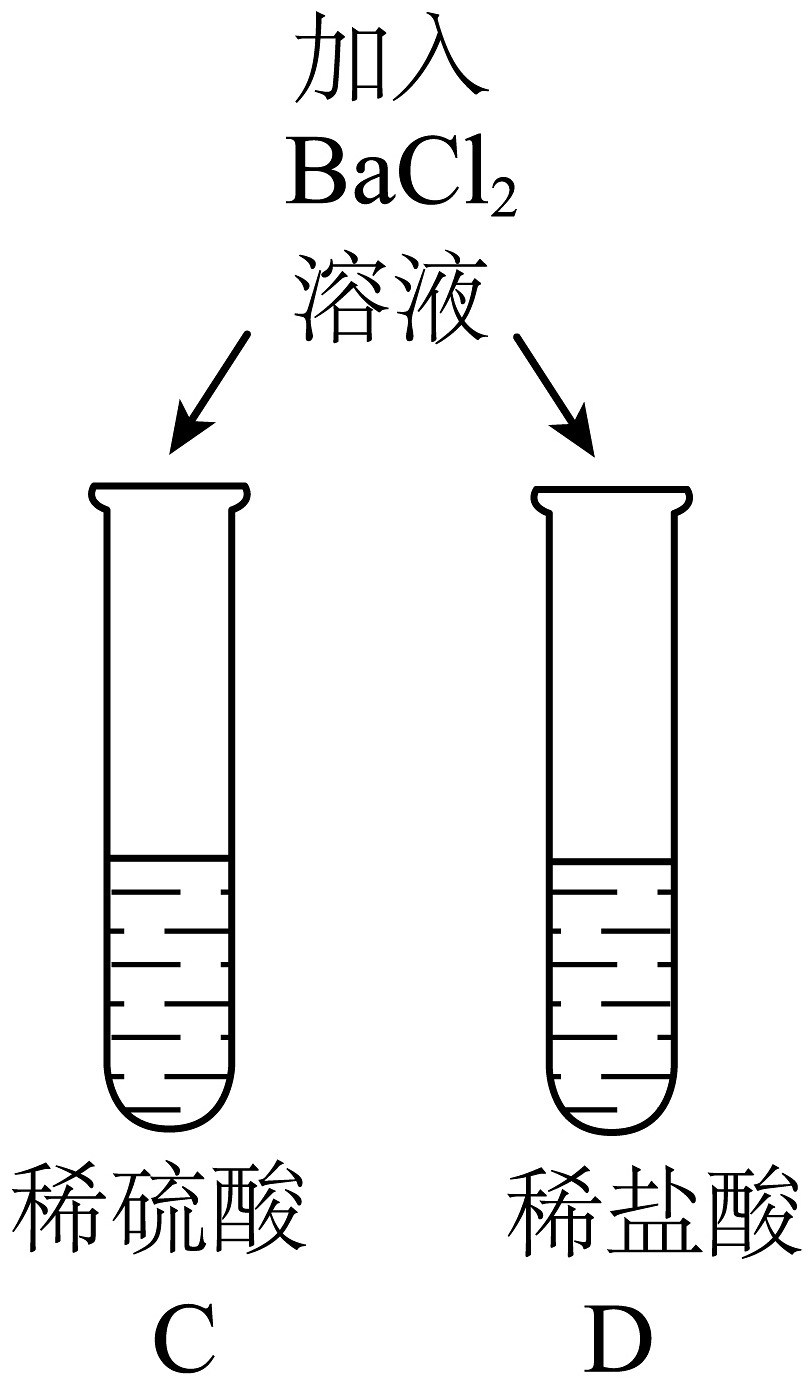
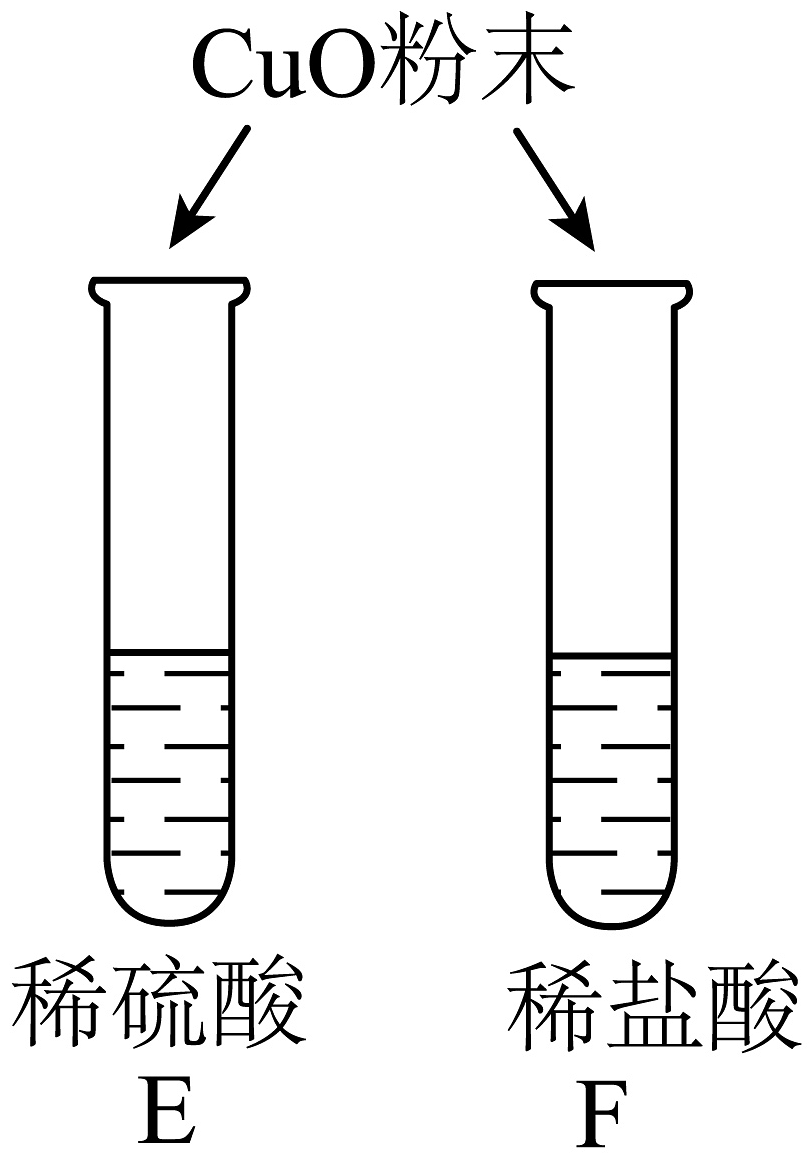
实验现象
两试管中均产生气泡
C试管中产生___________②___________(实验现象),试管中无明显现象
对E、F试管微热反应后,E试管溶液显蓝色,F试管溶液显绿色
实验分析
不同的酸具有相似的性质,这是因为酸的溶液中都含有___________①(填离子符号)。
不同的酸根离子会导致酸的“个性差异”。因此,可用氯化钡溶液鉴别盐酸和硫酸。
试管中的溶液显绿色可能原因是___________③___________。
(1)、请补充完整表格中的内容① , ② , ③。(2)、清洗试管时,小德同学将A、D两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。请写出产生气泡的化学方程式。 -
2、如图所示,小德去德清某户外拓展营地玩滑草项目。小德坐在滑草板上沿斜坡上的滑道下滑,最终停在底部平面上。已知小德及滑草板的总质量为 , 滑道高度为。
 (1)、小德坐在滑草板上从顶部滑到底部过程中小德及滑草板的重力做功为(用字母表示);(2)、小德在下滑过程中滑草板温度升高,这是通过方式改变内能。在下滑过程中小德及滑草板的机械能(选填“增大”、“不变”或“减小”)。
(1)、小德坐在滑草板上从顶部滑到底部过程中小德及滑草板的重力做功为(用字母表示);(2)、小德在下滑过程中滑草板温度升高,这是通过方式改变内能。在下滑过程中小德及滑草板的机械能(选填“增大”、“不变”或“减小”)。 -
3、建立“现象一性质一用途”之间的联系,是科学学习的重要方法,请回答下列问题:(1)、蘸有浓硫酸的小木棍表面呈黑色,体现了浓硫酸的性。(2)、氢氧化钠固体暴露在空气中会表面潮湿而逐步溶解,依据这一现象体现出的性质,氢氧化钠固体可用作某些气体的。
-
4、如图所示为小清家电饭锅的能效标识牌,通过查阅资料可知:热效率值是指将电能转化为热能的效率;保温能耗是指1小时消耗的电能。从节能角度分析我们应选热效率值(选填“高”或“低”)的电饭锅。某次小清煮好饭后保温10分钟,则保温期间消耗电能为焦。内锅材料选用金属而不选非金属材料,主要是利用金属材料的性。

-
5、如图所示为血管关系示意图,请回答:
 (1)、当血液流经图甲中②所示毛细血管时,便会与细胞进行物质交换,请写出一点与毛细血管进行物质交换功能相适应的结构特征:。当血液流经组织细胞处毛细血管时,能为组织细胞提供氧气,使组织细胞能进行有氧呼吸,有氧呼吸与无氧呼吸相比其优点是。(2)、医生常通过血液常规检查来判断病因,抽血时针尖刺入的血管类型是图甲中的(填序号)。某病人血液常规检查结果显示血红蛋白含量低于正常范围参考值,则该病人可能患有病。
(1)、当血液流经图甲中②所示毛细血管时,便会与细胞进行物质交换,请写出一点与毛细血管进行物质交换功能相适应的结构特征:。当血液流经组织细胞处毛细血管时,能为组织细胞提供氧气,使组织细胞能进行有氧呼吸,有氧呼吸与无氧呼吸相比其优点是。(2)、医生常通过血液常规检查来判断病因,抽血时针尖刺入的血管类型是图甲中的(填序号)。某病人血液常规检查结果显示血红蛋白含量低于正常范围参考值,则该病人可能患有病。 -
6、有一包白色粉末,可能是由硫酸铜、氯化钠、碳酸钠、硫酸钠中的一种或几种组成,为检验其中的成分,按以下流程进行实验:

(1)根据实验现象,白色粉末中一定有。(填化学式)
(2)实验中不能用BaCl2溶液代替Ba(NO3)2溶液的理由是。
-
7、秋冬季呼吸道传染病频发,发病患者通常体温会升高。发热期间,要保证足量饮水,出汗多的人可以适当喝点淡盐水。(1)、由上面信息可知,适当喝点淡盐水可以补充水和等营养素,如果补充过量,可通过系统产生更多尿液来调节人体内的平衡。(2)、发烧时消化液中酶的活性减弱,食欲下降,患者的同化作用异化作用(选填“强于”、“等于”或“弱于”)。
-
8、硫酸盐的结晶水合物通常称为“矾”,我国多部古籍都有记载。(1)、东汉《神农本草经》记载,将铁片放入胆矾溶液(即硫酸铜溶液)中能实现“化铁为铜”“化铁为铜”这一过程发生的化学反应属于(填基本化学反应类型名称)。(2)、唐代《千金翼方》记载,明矾可入药用。明矾的化学式为KAl , 属于(选填“纯净物”或“混合物”)将明矾溶于水后,往其中插入镁片,在镁片表面上析出的金属是。
-
9、为了研究电流通过导体产生热量多少的影响因素,小德将两段阻值不同的电阻丝分别密封在两个完全相同的烧瓶中,并设计了如图所示的甲、乙两套装置,已知电源电压相等且保持不变, , 装入烧瓶的煤油质量相等。下列叙述正确的是( )
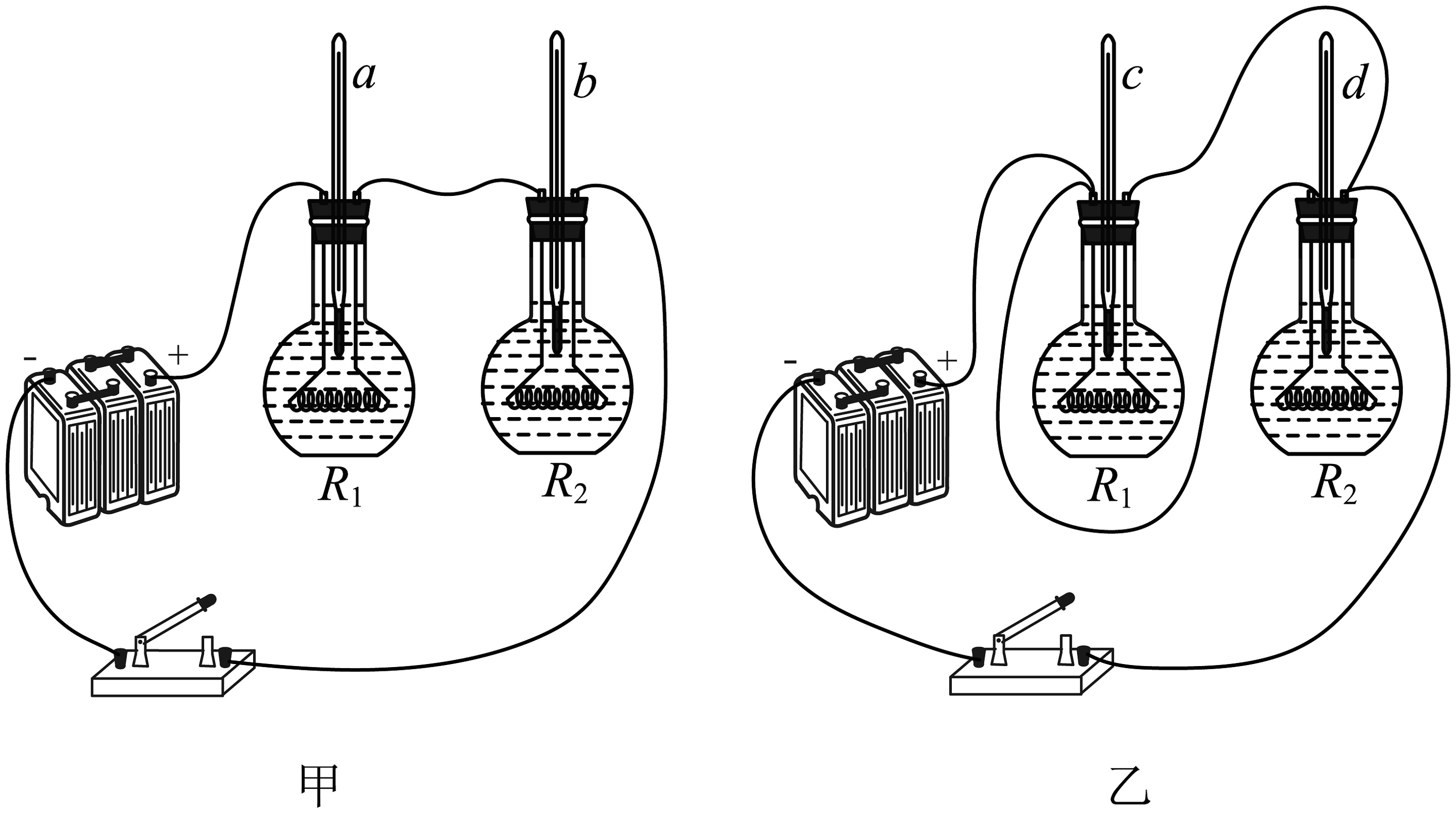 A、若将煤油换成水,实验效果更明显 B、甲装置中a温度计示数变化大 C、乙装置中c温度计示数变化大 D、探究电流产生的热量与电阻大小的关系,可比较两温度计示数变化
A、若将煤油换成水,实验效果更明显 B、甲装置中a温度计示数变化大 C、乙装置中c温度计示数变化大 D、探究电流产生的热量与电阻大小的关系,可比较两温度计示数变化 -
10、向一定量硫酸铜溶液中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的压关系如图所示。下列说法正确的是( )
 A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、点时溶液 D、A点到B点硫酸钠质量不变
A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、点时溶液 D、A点到B点硫酸钠质量不变 -
11、国庆期间德清银泰城隆重开业,其内有图甲所示的直升电梯和图乙所示的楼梯式电梯。若小清通过图甲方式到达三楼克服重力做功为 , 通过图乙方式到达三楼克服重力做功为 , 则两者大小关系正确的是( )
 A、 B、 C、 D、无法判断
A、 B、 C、 D、无法判断 -
12、如图所示是小德自己组装的滑轮组玩具,现通过转动转轴把手拉动绳子来提升重物,在4秒内将重为1牛的物体匀速提升16厘米,忽略绳子和滑轮的质量及摩擦阻力。下列说法中正确的是( )
 A、滑轮A为动滑轮 B、绳子拉力为0.5牛 C、重物的移动速度为4米/秒 D、4秒内提升重物所做的有用功为16焦
A、滑轮A为动滑轮 B、绳子拉力为0.5牛 C、重物的移动速度为4米/秒 D、4秒内提升重物所做的有用功为16焦 -
13、如图表示人体消化吸收过程,①⑤表示消化液。纵向箭头表示消化液对相应物质的消化作用,a、b、c分别表示淀粉、蛋白质和脂肪的最终消化产物。下列分析正确的是( )
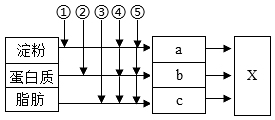 A、为大肠,是被吸收的主要场所 B、①为唾液,能将淀粉分解为葡萄糖 C、②中含的消化酶对脂肪分解起促进作用 D、⑤发挥作用的主要场所是小肠
A、为大肠,是被吸收的主要场所 B、①为唾液,能将淀粉分解为葡萄糖 C、②中含的消化酶对脂肪分解起促进作用 D、⑤发挥作用的主要场所是小肠 -
14、很多同学在课间玩扭转矿泉水瓶的游戏,如图所示,瓶里装有少量的水,盖紧瓶盖,使劲拧瓶的下部,使其严重变形,然后略松开瓶盖(对着没人的方向),瓶盖弹出数米远,观察到瓶口和瓶内有白雾产生。下列分析正确的是( )
 A、用力拧瓶的下部时瓶内气体内能减少,温度升高 B、用力拧瓶的下部时瓶内气体内能增加,温度降低 C、瓶盖弹出时气体内能减小,温度降低,水蒸气液化 D、瓶盖弹出时气体内能增加,温度降低,水蒸气液化
A、用力拧瓶的下部时瓶内气体内能减少,温度升高 B、用力拧瓶的下部时瓶内气体内能增加,温度降低 C、瓶盖弹出时气体内能减小,温度降低,水蒸气液化 D、瓶盖弹出时气体内能增加,温度降低,水蒸气液化 -
15、2024年中国核电发展又驶入了快车道,如图为核电站工作的原理示意图,下列叙述正确的是( )
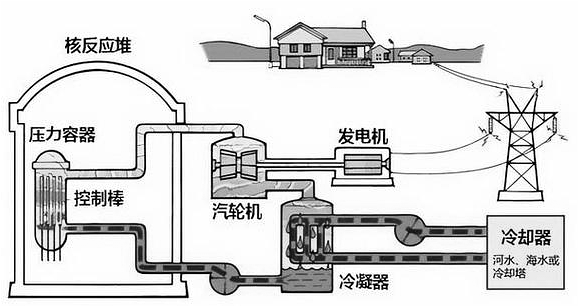 A、核反应堆进行核聚变释放核能 B、汽轮机工作时,使水的内能增加 C、核反应堆将核能直接转化为电能 D、核废料会产生放射性物质,必须合理处理
A、核反应堆进行核聚变释放核能 B、汽轮机工作时,使水的内能增加 C、核反应堆将核能直接转化为电能 D、核废料会产生放射性物质,必须合理处理 -
16、雾霾中的PM2.5颗粒物能通过呼吸道吸入肺后进入血液,如图为心脏结构示意图,PM2.5颗粒在心脏各腔中流经的正确顺序是( )
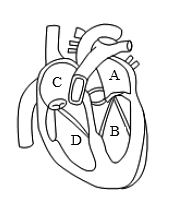 A、A→B→C→D B、C→D→A→B C、B→D→A→C D、D→A→B→C
A、A→B→C→D B、C→D→A→B C、B→D→A→C D、D→A→B→C -
17、实验是学习科学的重要手段。下列实验操作或装置正确的是( )A、
 测溶液的酸碱性
B、
测溶液的酸碱性
B、 稀释浓硫酸
C、
稀释浓硫酸
C、 制作血涂片
D、
制作血涂片
D、 用氢气还原氧化铜
用氢气还原氧化铜
-
18、随着“双减”政策的落实,广大中小学生有了充足的睡眠时间。睡眠不足对学习能力会有怎样的影响?某科研团队以小鼠为实验对象,建立模拟人类睡眠不足状态的模型,并进行了如下实验。

①选取发育状况一致的健康小鼠16只,随机均分为A、B两组。
②采用适当的实验方法,限制B组小鼠的每日睡眠时长,使其睡眠时长为每日3.5小时,持续21天。A组小鼠不限制睡眠时长,其他实验条件均相同。
③在实验的第7天、第14天、第21天,分别对两组中的每只小鼠走出同一迷宫的时间进行四次测量,计算平均值。实验结果如图所示。
(1)在限制睡眠时长的实验中,A组和B组是一组对照实验,组是对照组,该实验中变量是。
(2)每组小鼠选取多只、多次测量且实验数据取平均值,目的是。
(3)对比两组小鼠走出迷宫的平均时间,你认为该科研团队可以得出的结论是。
(4)本实验对你有怎样的启示?(写出一条即可)
-
19、藤壶有着很强的附着能力,常给很多动物带来困扰。它在幼年期可以随意游动,成年之后会附着在海龟、鲸等生物体的体表,跟着它到处“旅行”并在其体表密集繁殖。
 (1)、藤壶体内没有骨骼,但体外有一层保护身体的外骨骼,它属于无脊椎动物中的动物;(2)、藤壶在海龟身上大量繁殖,会导致海龟因负重过大而无法探头伸出水面呼吸,甚至可能会在水中窒息而死,据此判断海龟的呼吸器官是;海龟属于脊椎动物中的动物。(3)、想要清理海龟身上的藤壶,需要用淡水浸泡一段时间,等藤壶死亡之后,才能进行拔除工作。判断藤壶已经死亡的依据可以是。 (写出一点即可)
(1)、藤壶体内没有骨骼,但体外有一层保护身体的外骨骼,它属于无脊椎动物中的动物;(2)、藤壶在海龟身上大量繁殖,会导致海龟因负重过大而无法探头伸出水面呼吸,甚至可能会在水中窒息而死,据此判断海龟的呼吸器官是;海龟属于脊椎动物中的动物。(3)、想要清理海龟身上的藤壶,需要用淡水浸泡一段时间,等藤壶死亡之后,才能进行拔除工作。判断藤壶已经死亡的依据可以是。 (写出一点即可) -
20、学校开运动会,几个同学讨论怎样才能把铅球掷得更远。
实验序号
射出速度v/(m·s-¹)
射出仰角θ/°
射出(水平)距离s/m
1
5
30°
2.9
2
10
30°
9.5
3
10
45°
10.8
4
10
60°
9.1
5
15
30°
20.7
甲同学认为:铅球掷出的距离,可能与掷出铅球时的速度大小有关。
乙同学认为:铅球掷出的距离,可能与掷出铅球时的射出仰角θ(投掷方向与水平方向的夹角)有关。
丙同学说:“我们还是通过实验来探究吧。”
于是,他们制作了一个小球弹射器,它能使小球以不同速度和方向射出。弹射方向与水平方向的夹角,可由固定在铁架台上的量角器读出,他们通过 5 次实验得到下表中的数据。
请你根据上述所收集的信息和相关证据回答下列问题。
(1)、为了验证甲的猜想,应选用序号为的三组实验数据,得出的结论是:在一定时,物体抛出越大,抛出的距离越远;(2)、为了验证乙的猜想,应选用序号为的三组实验数据,射出仰角θ为时,物体抛出的距离最远。