相关试卷
-
1、下列化学用语表示合理的是( )A、氮的基态原子的价电子排布图:
 B、异戊二烯的键线式为:
B、异戊二烯的键线式为: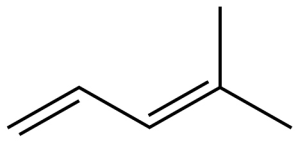 C、乙醛分子空间填充模型为:
C、乙醛分子空间填充模型为: D、中键的电子云轮廓图:
D、中键的电子云轮廓图:
-
2、下列常见物质中,不属于碱性氧化物的是( )A、 B、 C、 D、
-
3、回答下列问题:(1)、观察下列有机物,并按碳骨架把它们分类,完成填空:
①;②
 ;③
;③ ;④;⑤;⑥
;④;⑤;⑥ ;⑦;⑧
;⑦;⑧ ;⑨
;⑨ ;⑩
;⑩ ;
;属于链状化合物的是(填序号,下同),属于脂环化合物的是 , 属于芳香族化合物的是。
(2)、有机化合物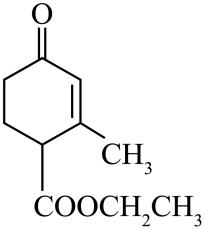 的官能团的名称:、、。 (3)、一种取代有机氯农药DDT的新型杀虫剂,其结构简式如下所示,该物质分子式为:。
的官能团的名称:、、。 (3)、一种取代有机氯农药DDT的新型杀虫剂,其结构简式如下所示,该物质分子式为:。
-
4、钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4 , 含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
金属离子
开始沉淀时的pH
1.9
7.0
3.0
8.1
完全沉淀时的pH
3.2
9.0
4.7
10.1
② , , 远大于。
回答下列问题:
(1)、基态Fe3+的价电子轨道表示式为。(2)、“焙烧”时,V2O3、V2O4都转化为 , 写出转化为的化学方程式:。(3)、“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有:“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3 , 原因是。(列式计算平衡常数分析该反应进行的趋势,一般认为,时反应进行较完全,时反应难以进行)(4)、“离子交换”与“洗脱”可表示为(为强碱性阴离子交换树脂,为VO在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用。(5)、“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是。(6)、下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是____(填字母)。A、高炉炼铁 B、电解熔融氯化钠制钠 C、铝热反应制锰 D、氧化汞分解制汞 -
5、钛的化合物种类繁多。回答下列问题:(1)、的熔点(-25℃)远低于的熔点(377℃),原因是。(2)、常温下呈固态。
①区分是晶体或非晶体最可靠的科学方法是。
②水溶液可制备配合物 , 其配位原子是(用化学符号表示),化学键类型有(填标号)。
A.离子键 B.非极性键 C.配位键 D.金属键
(3)、TiN晶胞结构如图所示。
①如果Ti位于晶胞的棱心和体心,则N位于晶胞的。
②已知A、B原子的坐标参数分别为、 , 则C处Ti原子的坐标为。
③若TiN立方晶胞参数为apm,阿伏加德罗常数的值为 , 则TiN的密度是(列出计算式)。
-
6、Ⅰ.如图是元素周期表的一部分,根据元素在周期表中的位置,回答下列问题:
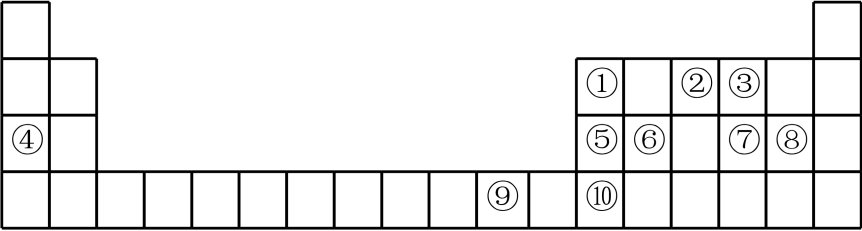 (1)、⑨号元素在周期表中的位置是 , 属于区。(2)、第二周期所有元素中第一电离能介于①②之间的有种。由②③④形成的简单离子半径由小到大顺序是(填化学用语)。(3)、元素⑦⑧可形成原子个数比为1∶1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式 , 该分子为(填“极性分子”或“非极性分子”)。(4)、下列有关性质的比较正确且能用元素周期律解释的是____(填标号)A、电负性:②>③ B、氢化物的稳定性:③>⑦ C、最高价氧化物对应的水化物的碱性:④>⑤ D、氢化物的沸点:③>⑦(5)、Ⅱ.是储氢材料,已知其由和(H为-1价)构成,释放氢气的原理为。
(1)、⑨号元素在周期表中的位置是 , 属于区。(2)、第二周期所有元素中第一电离能介于①②之间的有种。由②③④形成的简单离子半径由小到大顺序是(填化学用语)。(3)、元素⑦⑧可形成原子个数比为1∶1的共价化合物,分子中各原子最外层均达到8电子的稳定结构,试写出其结构式 , 该分子为(填“极性分子”或“非极性分子”)。(4)、下列有关性质的比较正确且能用元素周期律解释的是____(填标号)A、电负性:②>③ B、氢化物的稳定性:③>⑦ C、最高价氧化物对应的水化物的碱性:④>⑤ D、氢化物的沸点:③>⑦(5)、Ⅱ.是储氢材料,已知其由和(H为-1价)构成,释放氢气的原理为。写出的电子式 , 中心原子杂化轨道类型为。
(6)、中不存在的作用力有____。A、离子键 B、极性共价键 C、非极性共价键 D、分子间作用力(7)、氢化锂(LiH)中负离子半径大于正离子半径,其原因是。 -
7、具有下列电子层结构的原子
① 3p轨道上只有一对成对电子的原子 ② 外围电子构型为2s22p5的原子;
③ 其3p轨道为半充满的原子 ④ 正三价的阳离子结构与氖相同的原子。
则下列有关比较中正确的是( )
A、第一电离能:②>③>①>④ B、原子半径:④>③>②>① C、电负性:②>③>①>④ D、最高正化合价:②>③>①>④ -
8、离子液体[Amim]BF4的合成路线为:
 , 下列叙述错误的是( ) A、
, 下列叙述错误的是( ) A、 的中氯原子的价层电子排布式为3S23P5
B、[Amim]Cl中含有共价键和离子键
C、NaBF4的电子式为
的中氯原子的价层电子排布式为3S23P5
B、[Amim]Cl中含有共价键和离子键
C、NaBF4的电子式为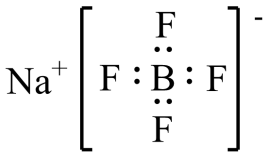 D、[Amim]BF4可作为电解质用于电池中
D、[Amim]BF4可作为电解质用于电池中
-
9、下列化学用语或图示表达正确的是( )A、HClO的电子式为
 B、基态原子的价层电子轨道表示式为
B、基态原子的价层电子轨道表示式为 C、任何晶体中,若含有阳离子就一定有阴离子
D、分子的VSEPR模型为
C、任何晶体中,若含有阳离子就一定有阴离子
D、分子的VSEPR模型为
-
10、设为阿伏加德罗常数的值,下列说法错误的是( )
 A、1 mol 分子中含有的非极性共价键数目为 B、S8分子中S原子采用sp3杂化 C、1 mol 分子中含有的π键数目一定为 D、分子中S原子不满足8电子稳定结构
A、1 mol 分子中含有的非极性共价键数目为 B、S8分子中S原子采用sp3杂化 C、1 mol 分子中含有的π键数目一定为 D、分子中S原子不满足8电子稳定结构 -
11、烷烃一氯代物只有一种的常见有甲烷型、乙烷型。甲烷中氢原子被甲基取代得到的新戊烷一氯代物也是一种。某烃的一种同分异构体只能生成一种一氯代物(不考虑立体异构),该烃的分子式可能是( )A、 B、 C、 D、
-
12、下列反应中,其有机产物含有两个官能团的是( )A、1mol乙炔与2mol溴发生加成反应 B、乙烯与溴发生加成反应 C、1mol苯与3mol氢气发生加成反应 D、甲苯硝化生成三硝基甲苯
-
13、下列化学用语或图示表达正确的是( )A、基态N原子的轨道表示式:
 B、的VSEPR模型:
B、的VSEPR模型: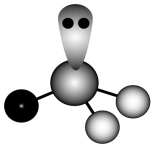 C、的键的形成:
C、的键的形成: D、用电子式表示HCl的形成过程:
D、用电子式表示HCl的形成过程:
-
14、下列各组物质的晶体类型相同的是( )A、和 B、和 C、和 D、和
-
15、下列对一些实验事实的理论解释错误的是( )
选项
实验事实
理论解释
A
熔点:碳化硅<金刚石
C-Si键能小于C-C键能
B
酸性:
氟的电负性大于氯的电负性,F-C的极性大于Cl-C的极性,导致羧基中羟基的极性更大,更易电离出
C
聚四氟乙烯的化学稳定性高于聚乙烯
C-F的键能比C-H的键能大,键能越大,化学性质越稳定
D
对羟基苯甲醛(
 )比邻羟基苯甲醛(
)比邻羟基苯甲醛( )的沸点低
)的沸点低对羟基苯甲醛形成分子内氢键,邻羟基苯甲醛形成分子间氢键
A、A B、B C、C D、D -
16、设NA为阿伏加德罗常数的值,下列说法正确的是( )A、CH3CH2Br中C-H键的极性比C-Br键的极性弱 B、1.8g重水(D2O)中所含质子数为NA C、足量的浓盐酸与8.7g MnO2反应,转移电子的数目小于0.2NA D、1个丙炔分子中含有5个σ键和3个π键
-
17、人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是( )A、1s22s22p63s23p6 B、1s22s22p63s23p63d54s2 C、1s22s22p63s23p63d54s1 D、1s22s22p63s23p63d104s1
-
18、下列分子或离子的空间结构和中心原子的杂化方式均正确的是( )A、 平面三角形杂化 B、平面三角形杂化 C、 V形 杂化 D、 三角锥形 杂化
-
19、已知:元素X、Y、Z、W的电负性数值分别为2.5、3.5、1.2、2.4。你认为上述四种元素中,哪两种最容易形成离子化合物( )A、X与Y B、X与W C、Y与Z D、Y与W
-
20、一个氧原子的电子轨道有几个( )A、8 B、4 C、5 D、6