-
1、下列物质的性质和用途叙述均正确,且有对应关系的是A、具有良好的导电性,可以用于制作高压钠灯 B、硬铝的密度小、强度高,是制造飞机和宇宙飞船的理想材料 C、有氧化性,可作自来水消毒剂 D、铁粉具有还原性,可用作食品抗氧化剂
-
2、下列关于铁及其化合物的说法不正确的是A、美丽的丹霞地貌是由于岩层中含而呈红色,铁在自然界中均以化合态的形式存在 B、钢为铁碳合金,是目前用量最大、用途最广的合金,其硬度比纯铁大 C、实验室保存亚铁盐溶液时,为了防止亚铁盐被氧化为铁盐,常在试剂瓶中加入少量铁粉 D、为避免铁在高温条件下与水蒸气反应产生 , 钢铁厂中的模具需要充分干燥
-
3、分别向下列四种溶液中滴加适量的氯水,现象描述与性质分析均正确的是
选项
现象描述
性质分析
A
紫色石蕊溶液:先变红色后褪色
Cl2具有漂白性,HCl表现酸性
B
含淀粉的KI溶液:溶液变蓝色
氧化性:Cl2>I2
C
AgNO3溶液:生成白色沉淀
HCl表现酸性
D
NaHCO3溶液:产生气泡
Cl2具有强氧化性
A、A B、B C、C D、D -
4、下列说法不正确的是A、和互为同位素 B、核素的中子数是0 C、金刚石和石墨互为同素异形体 D、和互为同素异形体
-
5、关于合金的叙述,不正确的是A、合金的熔沸点一般比组成它们的各成分金属要高 B、合金的硬度可以比原金属更高,化学性质也可能和原成分金属不同 C、非金属和金属之间也可以形成合金 D、合金的用途比纯金属的用途更广
-
6、下列关于金属钠及其化合物的说法中正确的是A、钠着火后,应立即用二氧化碳灭火器灭火 B、NaHCO3和Na2CO3两种溶液分别加入澄清石灰水,均有白色沉淀生成 C、NaHCO3与Na2CO3都能和水反应生成碱,因此它们都是碱性氧化物 D、NaHCO3是发酵粉的主要成分,Na2CO3可以用于治疗胃酸过多
-
7、下列叙述不正确的是A、氯元素在自然界中主要存在于海水、盐湖和盐矿中 B、钠元素在自然界中只以化合态形式存在 C、铁元素是地壳里含量最多的金属元素 D、钠的化学性质比较活泼,少量的钠可以保存在煤油中
-
8、氢化钠(NaH)可在野外用作生氢剂,其中氢元素为-1价。NaH用作生氢剂时的化学反应原理为:。下列有关该反应的说法中,不正确的是A、是氧化剂 B、NaOH是氧化产物 C、还原性大小: D、每生成标准状况下22.4L , 转移1mol电子
-
9、下列化学用语表达正确的是A、水的电子式:
 B、次氯酸的结构式:
C、中子数为7的氮原子:
D、钠离子的结构示意图:
B、次氯酸的结构式:
C、中子数为7的氮原子:
D、钠离子的结构示意图:
-
10、快乐的小熊告诉我们,高中教材认为:凡是有元素化合价升降的化学反应都是氧化还原反应。小熊圆圆的脑袋就代表了氧化还原反应,初中所学的四种基本反应类型就是A、B、C、D四个位置,则下列位置说明正确的是
 A、分解反应 B、复分解反应 C、化合反应 D、置换反应
A、分解反应 B、复分解反应 C、化合反应 D、置换反应 -
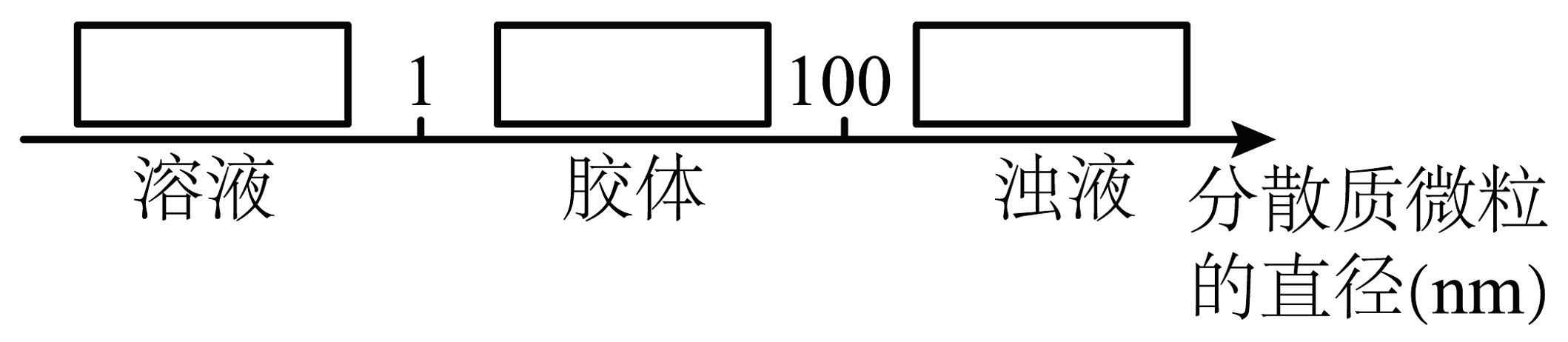
11、溶液、胶体、浊液这三种分散系的本质区别是A、是否都能导电 B、是否有颜色 C、分散质粒子直径的大小 D、能否发生丁达尔效应
-
12、下列物质的俗称与化学式对应不正确的是A、小苏打—— B、明矾—— C、磁性氧化铁—— D、漂白粉有效成分—— Ca(ClO)2
-
13、下列关于物质分类的叙述中,不正确的是A、属于酸 B、石灰水属于碱 C、属于碱 D、属于酸性氧化物
-
14、从不同的角度对物质进行分类有利于研究物质的组成与性质。
现有以下5种物质:①Cu ②NaCl ③饱和硫酸铁溶液 ④ ⑤干冰
回答下列问题:
(1)、以上物质能导电的有(填序号)。(2)、以上物质属于电解质的有(填序号)。(3)、分别写出②、④在水中的电离方程式、。(4)、①可溶解在③中,产物中金属元素均为+2价,该反应的离子方程式为。(5)、将少量③分别滴加到下列物质中,得到三种分散系a、b、c。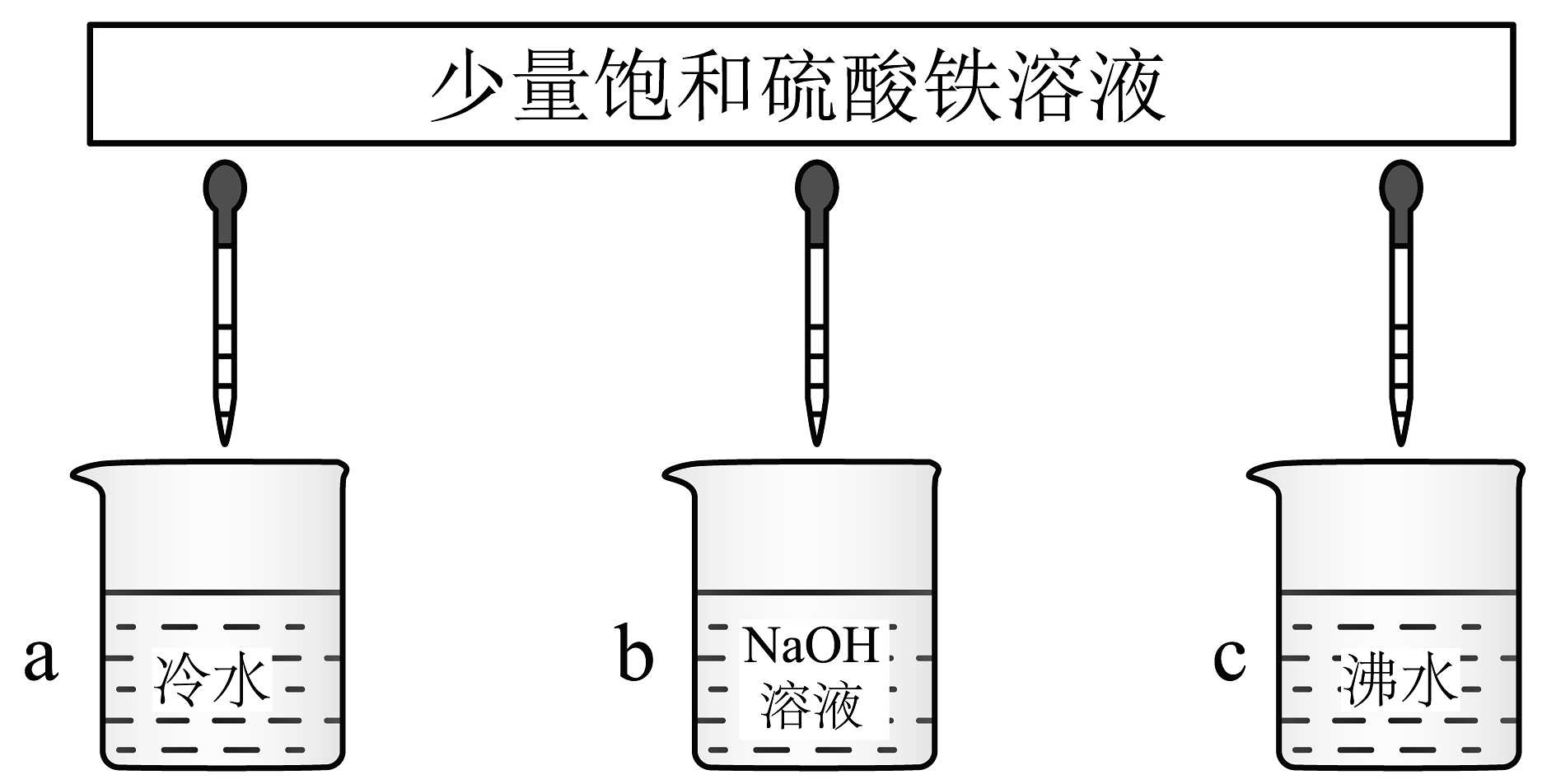
试将a、b、c符号以及对应的分散质具体的化学式填入下列方框中:。
 (6)、将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。
(6)、将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。 -
15、某体系中发生的一个反应,反应物和生成物共六种微粒:Fe3+、Mn2+、MnO、H2O、Fe2+、H+ , 已知MnO为其中一种反应物,下列说法正确的是A、只有MnO和Fe2+是反应物 B、被还原的元素是Fe C、发生氧化反应的物质是MnO D、氧化剂与还原剂的个数比为1∶5
-
16、在反应3Cl2+6KOH(浓)KClO3+5KCl+3H2O中,氧化剂与还原剂的物质的量之比为A、5∶1 B、4∶1 C、1∶5 D、1∶4
-
17、下列各组微粒中,一定条件下均可以作氧化剂的是A、、、 B、、、 C、、、 D、、、
-
18、下列离子方程式的书写正确的是A、铝与盐酸反应:Al + 6H+= Al3++ 3H2↑ B、CO2通入NaOH溶液中:CO2+ OH-= CO+H2O C、澄清石灰水与盐酸反应:Ca(OH)2+ 2H+= Ca2++ 2H2O D、碳酸钠与氯化钙混合: CO+Ca2+= CaCO3↓
-
19、下列说法正确的是A、熔融NaCl能导电,是因为通电时NaCl发生了电离 B、NaCl固体不导电,因为NaCl固体中无带电微粒 C、NH4NO3电离时产生了NH、NO , 无金属离子,所以NH4NO3不是盐 D、NaHSO4在水溶液中电离生成了Na+、H+、SO三种离子
-
20、实验小组用如下流程探究含氮化合物的转化。为阿伏加德罗常数的值,下列说法正确的是
 A、“反应1”中,每消耗 , 在下得到 B、“反应2”中,每生成0.1molNO,转移电子数为 C、在密闭容器中进行“反应3”,充分反应后体系中有个 D、“反应4”中,为使完全转化成 , 至少需要个
A、“反应1”中,每消耗 , 在下得到 B、“反应2”中,每生成0.1molNO,转移电子数为 C、在密闭容器中进行“反应3”,充分反应后体系中有个 D、“反应4”中,为使完全转化成 , 至少需要个