-
1、下面是某地市场上销售的一种加碘食盐包装袋上的部分文字说明。
配料
氯化钠()、碘酸钾()
含碘量
保质期
18个月
食用方法
勿长时间炖炒
贮藏指南
避热、避光、密封、防潮
(1)、中“I”的化合价为。(2)、加碘盐不能长时间炖炒,且应避热、避光保存,你认为可能的原因是。(3)、实验分析发现,某批加碘盐中的含量为。则每千克该加碘盐中的物质的量为。(4)、若成人每天需摄入碘元素才能满足人体健康的需要,试通过计算说明成人平均每天食用含量为的加碘盐(填“能”或“不能”)获得所需要的碘元素。(5)、已知碘酸钾()在酸性条件下能和碘化钾(KI)反应生成单质碘。又知单质碘能使淀粉变蓝。现有碘化钾淀粉试纸,请选用家庭中的日常用品,证明加碘盐中含碘元素。请写出实验方案。 -
2、碳量子点(CQDs)是一种新型碳纳米材料(颗粒直径为)。我国化学家研制出一种碳量子点(CQDs)/氮化碳()复合光催化剂,可实现利用太阳光高效分解水,原理如图所示。下列说法不正确的是
 A、CQDs与水形成的分散系具有丁达尔效应 B、是过程I、II的催化剂 C、总反应方程式为: D、属于氧化物
A、CQDs与水形成的分散系具有丁达尔效应 B、是过程I、II的催化剂 C、总反应方程式为: D、属于氧化物 -
3、室温下,通过下列实验探究一定浓度Na2CO3溶液的性质。
实验1:将一块沾有油污的铜片浸入Na2CO3溶液,静置2分钟,用镊子将铜片从溶液中取出,用水冲洗,可清除铜片表面的油污;
实验2:向Na2CO3溶液中滴几滴酚酞,溶液显红色,再继续缓慢滴加几滴稀盐酸,溶液红色变浅,无气体产生;
实验3:向Na2CO3溶液中通入过量的CO2 , 无明显现象;
实验4:向实验3所得溶液中滴加少量Ba(OH)2溶液,产生白色沉淀。
下列有关说法正确的是
A、由实验1可知Na2CO3溶液呈碱性 B、实验2中溶液红色变浅的原因是:CO+2H+=H2O+CO2↑ C、由实验3可以推测Na2CO3与CO2没有发生反应 D、实验4中发生反应的离子方程式为:CO+Ba2+=BaCO3↓ -
4、如下有关实验操作,现象,结论正确的是
选项
操作
现象
结论
A
滴加溶液
生成白色沉淀
原溶液中有
B
将溶于水,观察氯水颜色,再滴加石蕊试液
氯水为淡黄绿色,且滴加石蕊试液先变红后褪色
不能完全与水反应
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
原溶液中有 , 无
D
滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口
试纸不变蓝
原溶液中无
A、A B、B C、C D、D -
5、物质类别和核心元素的价态是学习元素及其化合物性质的两个重要认识视角。氯元素的“价类二维图”如图所示,下列说法不正确的是
 A、物质a可由在b中点燃得到 B、b不能使干燥的有色布条褪色 C、物质d是漂白粉的有效成分 D、f到e的转化属于氧化还原反应
A、物质a可由在b中点燃得到 B、b不能使干燥的有色布条褪色 C、物质d是漂白粉的有效成分 D、f到e的转化属于氧化还原反应 -
6、阅读下列材料,完成下面小题。
侯德榜制碱法将制碱技术发展到一个新的水平,主要流程如图所示(部分物质已略去)。沉淀池中的反应为 , 将析出的固体灼烧获取纯碱,向析出固体后的母液中加入食盐可获得副产品氯化铵。
 (1)、下列说法正确的是A、操作1的名称为分液 B、煅烧炉中反应的化学方程式为: C、物质X可循环利用,其化学式为 D、沉淀池中先通入 , 再通入(2)、下列关于物质的类别及离子方程式正确的是A、属于盐,可与稀盐酸发生反应: B、纯碱属于碱,可与氯化钡发生反应: C、碳酸钙属于盐,可用于实验室制 D、烧碱属于碱,可与稀硫酸反应:(3)、下列有关和的叙述中,不正确的是
(1)、下列说法正确的是A、操作1的名称为分液 B、煅烧炉中反应的化学方程式为: C、物质X可循环利用,其化学式为 D、沉淀池中先通入 , 再通入(2)、下列关于物质的类别及离子方程式正确的是A、属于盐,可与稀盐酸发生反应: B、纯碱属于碱,可与氯化钡发生反应: C、碳酸钙属于盐,可用于实验室制 D、烧碱属于碱,可与稀硫酸反应:(3)、下列有关和的叙述中,不正确的是 A、同浓度下和溶液的碱性: , 都可以治疗胃酸过多 B、用如上图可证明热稳定性: C、在一定的条件下,与之间可以相互转化 D、等质量的和与足量盐酸反应,放出的更多
A、同浓度下和溶液的碱性: , 都可以治疗胃酸过多 B、用如上图可证明热稳定性: C、在一定的条件下,与之间可以相互转化 D、等质量的和与足量盐酸反应,放出的更多 -
7、硫酸是一种重要的化工产品,接触法制硫酸中的关键工序是的催化氧化:。下列有关说法正确的是A、的摩尔质量为64 B、22.4L中的物质的量为1mol C、等质量的与中氧原子数之比为 D、中含有氧原子的物质的量为1mol
-
8、下列物质的转化在给定条件下能实现的是A、 B、 C、 D、NaCl(溶液)漂白粉
-
9、下列说法正确且具有因果关系的是A、氢氧化铁胶体具有吸附性,可用于自来水的杀菌消毒 B、吸收产生 , 可用作呼吸面具供氧剂 C、钠和钾合金常温下呈液态,可用作快中子反应堆的热交换剂 D、NaCl熔点高,可用于制取钠
-
10、反应可用于检验氯气管道是否泄漏。下列说法正确的是A、中子数为8的N原子: B、属于酸 C、的结构示意图:
 D、的电离方程式:
D、的电离方程式:
-
11、新泽茉莉醛是一种名贵的香料,其合成路线如图:

已知:①
 ;
;②
 。(1)、甲的相对分子质量为30,甲的名称为。(2)、反应①的化学方程式为。(3)、D中含氧官能团的名称为;E的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
。(1)、甲的相对分子质量为30,甲的名称为。(2)、反应①的化学方程式为。(3)、D中含氧官能团的名称为;E的结构简式为。(4)、E的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中含有4种不同化学环境的氢原子;
②碱性条件下水解,酸化后得到2种产物,其中一种含苯环且有2种含氧官能团,2种产物均能被银氨溶液氧化。
(5)、结合已知①,设计以乙醇和苯甲醛( )为原料制备
)为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。 -
12、月桂烯(
 )是重要的化工原料,广泛用于香料行业。 (1)、月桂烯与足量氢气完全加成后生成A,A的名称是。(2)、以月桂烯为原料制取乙酸香叶酯的流程如图:
)是重要的化工原料,广泛用于香料行业。 (1)、月桂烯与足量氢气完全加成后生成A,A的名称是。(2)、以月桂烯为原料制取乙酸香叶酯的流程如图:
①B中含有的官能团的名称为。
②乙酸香叶酯的化学式为。
③反应I的反应类型为。
④反应II的化学方程式为。
(3)、烯烃臭氧化还原水解反应生成羰基化合物:
一定条件下,月桂烯可实现如图所示转化(图中部分产物已略去):
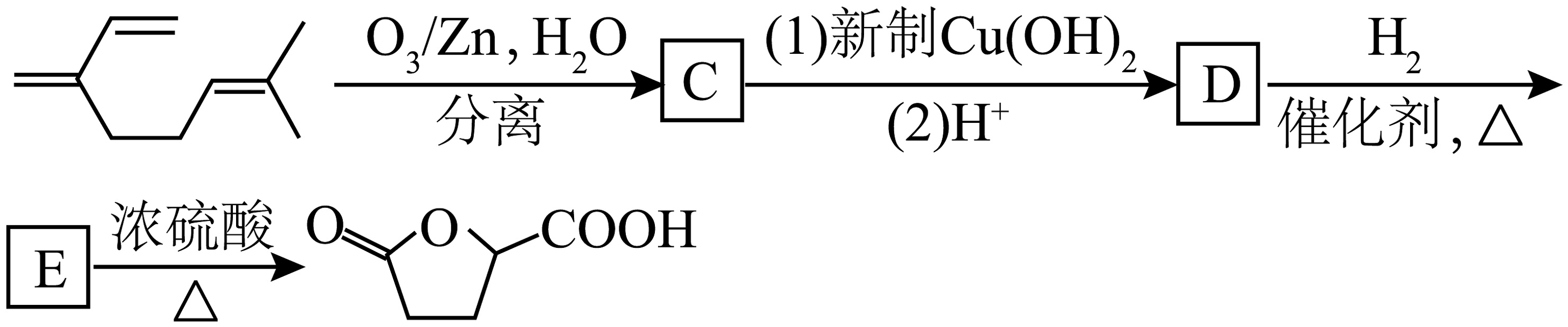
C与新制反应的化学方程式为。
-
13、溴苯是一种化工原料,实验室合成溴苯的装置示意图如下所示。在分液漏斗中加入含有无水苯和液态溴的混合物,在烧瓶中加入少量溴化铁。
 (1)、在该实验中,圆底烧瓶a的容积最适合的是________(填入正确选项前的字母)。A、 B、 C、 D、(2)、向圆底烧瓶中滴加苯和溴的混合液前需先打开;圆底烧瓶a中有白色雾状物产生是因为生成了气体;装置c中碳酸钠溶液的作用是;其发生反应的离子方程式是。(3)、实验过程中,装置b中液体的颜色会逐渐变为色;产生这一现象的原因是。(4)、某兴趣小组设计了如图流程提纯制得的粗溴苯。
(1)、在该实验中,圆底烧瓶a的容积最适合的是________(填入正确选项前的字母)。A、 B、 C、 D、(2)、向圆底烧瓶中滴加苯和溴的混合液前需先打开;圆底烧瓶a中有白色雾状物产生是因为生成了气体;装置c中碳酸钠溶液的作用是;其发生反应的离子方程式是。(3)、实验过程中,装置b中液体的颜色会逐渐变为色;产生这一现象的原因是。(4)、某兴趣小组设计了如图流程提纯制得的粗溴苯。
已知:液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。
a.操作I、II、III用到的主要玻璃仪器是。
b.操作Ⅳ、V分别是。
c.加入溶液的目的是除去有机层①中的。
d.向分出的粗苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是。
e.若水层③中加入溶液后仍然显红色,说明溴化铁未被完全除尽。以简短的文字说明未被除去的溴化铁是否会影响溴苯提纯的纯度?。
-
14、环丙烷可作为全身麻醉剂,环己烷是重要的有机溶剂。已知:某些有机化合物的反应方程式如下(其中、是催化剂且催化性能相当):
①
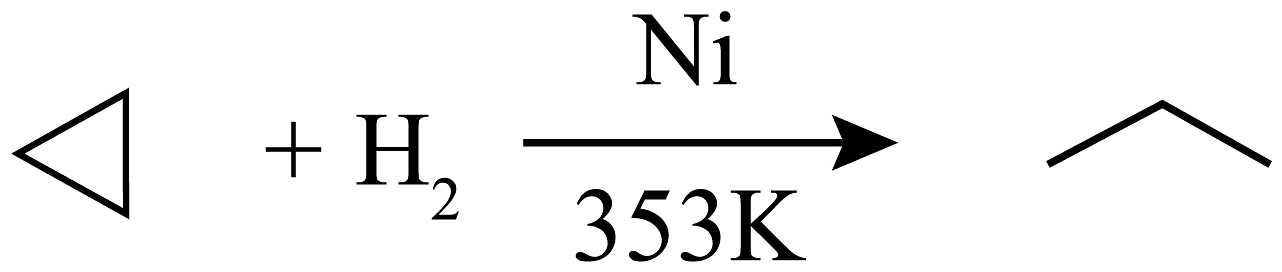 ;
;②
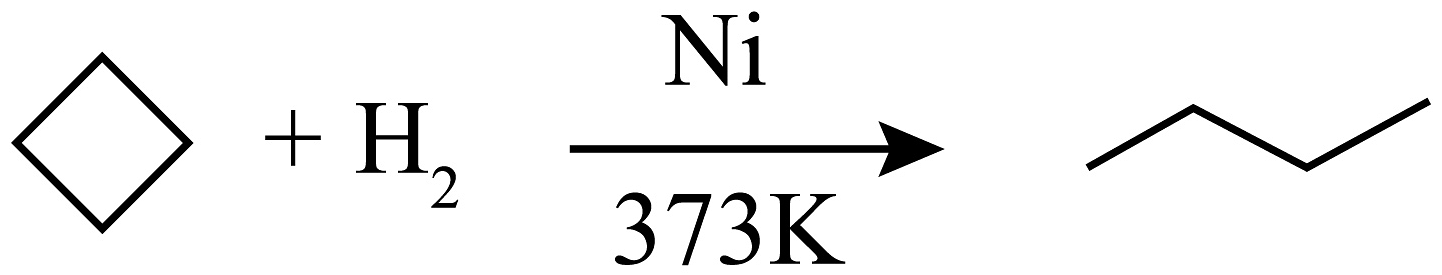 ;
;③
 ;
;④
 。
。回答下列问题:
(1)、从反应①~③可以看出,最容易发生开环加成反应的环烷烃是(填名称),判断依据为。(2)、环烷烃还可与卤素单质、卤化氢发生类似的开环加成反应,如环丁烷与在一定条件下反应,其化学方程式为(不需注明反应条件)。(3)、写出鉴别环丙烷与丙烯的一种方法,试剂:;现象与结论:。(4)、已知:某烯烃在酸性溶液的作用下只产生一种有机物 , 其产物物质的量是原烯烃的2倍且其核磁共振氢谱图上只有一组峰,则该烯烃的结构简式为 , 用系统命名法其名称为。 -
15、有机物和苯通过反应合成的过程如图所示(无机小分子产物略去)。

下列说法错误的是
A、该反应是取代反应 B、若为烃基,则一定是苯的同系物 C、若为 , 则有4种同分异构体 D、若为 , 中所有碳原子可能都共平面 -
16、根据乙烯的性质推测丙烯的性质。下列说法不正确的是A、丙烯能使酸性溶液褪色 B、聚丙烯可以用
 来表示
C、丙烯与的加成产物是
D、等质量的乙烯与丙烯完全燃烧,所消耗的的质量相等
来表示
C、丙烯与的加成产物是
D、等质量的乙烯与丙烯完全燃烧,所消耗的的质量相等
-
17、取一支硬质大试管,通过排饱和溶液的方法先后收集半试管甲烷和半试管氯气(如图所示)。下列关于试管内发生的反应及现象的说法不正确的是
 A、和完全反应后试管内的液面会上升 B、为加快化学反应速率,应在强光照射下完成 C、甲烷和反应后试管内壁的油状液滴含有、、 D、若与足量在光照下反应,如果生成相同物质的量的四种有机物,则消耗的物质的量为
A、和完全反应后试管内的液面会上升 B、为加快化学反应速率,应在强光照射下完成 C、甲烷和反应后试管内壁的油状液滴含有、、 D、若与足量在光照下反应,如果生成相同物质的量的四种有机物,则消耗的物质的量为 -
18、在圆底烧瓶中加入乙醇和浓硫酸(体积之比约为)的混合液 , 放入几片碎瓷片。加热混合液,使液体温度迅速升到170℃,将气体分别通入酸性溶液和溴水中,观察实验现象。下列说法正确的是
 A、可用排水法收集乙烯气体 B、制备乙烯的反应可用如上图所示的发生装置 C、在本实验中,浓硫酸仅起了催化剂和脱水剂的作用 D、观察到酸性溶液褪色,证明了产物乙烯的生成
A、可用排水法收集乙烯气体 B、制备乙烯的反应可用如上图所示的发生装置 C、在本实验中,浓硫酸仅起了催化剂和脱水剂的作用 D、观察到酸性溶液褪色,证明了产物乙烯的生成 -
19、分析以下反应,下列推论不正确的是
①

②

产物物质的量分数依次为58%、4%、38%。
③

产物物质的量分数依次为6%、93%、1%。
A、甲苯比苯容易硝化,硝基苯比苯难硝化 B、甲基为吸电子基、硝基为推电子基,对苯环产生不同影响 C、甲基使苯环上与甲基处于邻、对位的氢原子活化而易被硝基取代 D、硝基使苯环上与硝基处于邻、对位的氢原子比间位的更难被硝基取代 -
20、已知某有机物的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
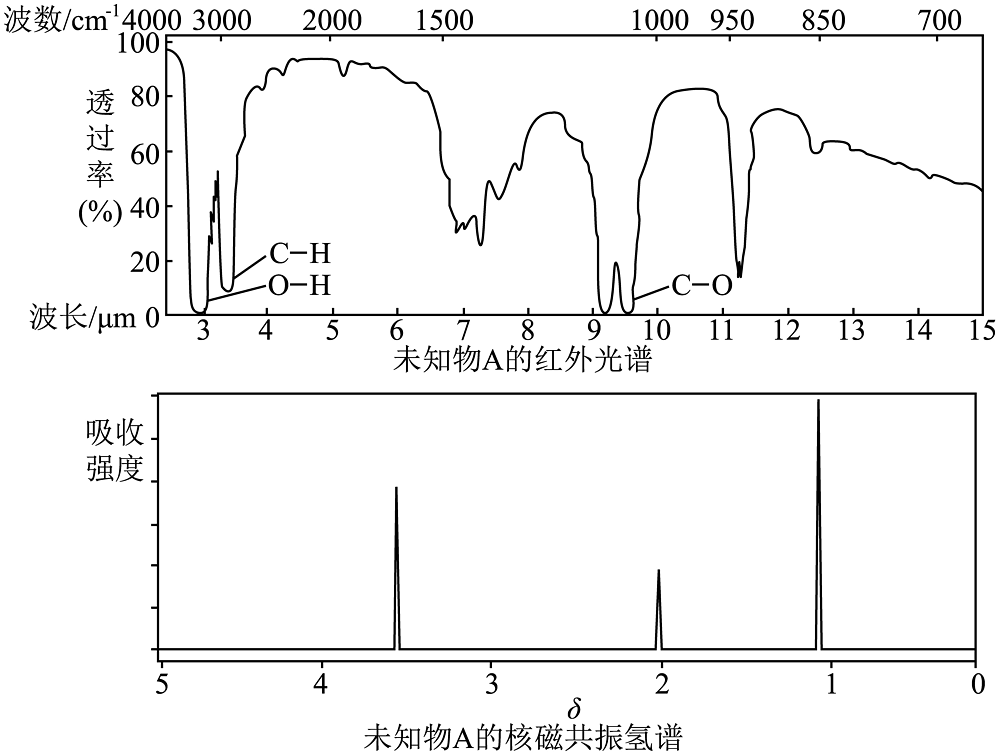 A、仅由其核磁共振氢谱可知其分子中的氢原子总数 B、若的化学式为 , 则其结构简式为 C、由红外光谱可知,该有机物中至少含有三种不同的化学键 D、由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为
A、仅由其核磁共振氢谱可知其分子中的氢原子总数 B、若的化学式为 , 则其结构简式为 C、由红外光谱可知,该有机物中至少含有三种不同的化学键 D、由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为