-
1、氯元素是非常重要的非金属元素,某化学活动社团为了探究氯气的制法、性质和用途,设计了如下实验装置。
 (1)、实验室制备氯气的反应的化学方程式。(2)、B中饱和食盐水的作用是。(3)、广口瓶C、E中,有色布条褪色的是(填“C”或“E”)。(4)、装置F可用于制漂白粉,漂白粉的有效成分是_____。A、 B、 C、 D、和(5)、烧杯G的作用是 , 请写出中反应的离子方程式(6)、写出装置Ⅰ中反应的化学方程式。
(1)、实验室制备氯气的反应的化学方程式。(2)、B中饱和食盐水的作用是。(3)、广口瓶C、E中,有色布条褪色的是(填“C”或“E”)。(4)、装置F可用于制漂白粉,漂白粉的有效成分是_____。A、 B、 C、 D、和(5)、烧杯G的作用是 , 请写出中反应的离子方程式(6)、写出装置Ⅰ中反应的化学方程式。 -
2、
完成下列填空。
Ⅰ.已知铜在常温下可以与浓硝酸发生氧化还原反应:。
(1)请将上述化学方程式改写成离子方程式________。
(2)被还原的和未被还原的质量比为________。
(3)浓硝酸在该反应中体现出来的性质有_______(填字母)。
A. 氧化性 B. 还原性 C. 酸性 D. 碱性 Ⅱ.黑火药是中国四大发明之一,当黑火药发生爆炸时,发生如下
(4)该反应中,氧化剂是________,(填化学式,下同)被氧化的元素是________,每生成2个分子,转移电子的个数为________。
Ⅲ.产生的可以用溶液吸收,化学方程式为:。
(5)请用双线桥法标出该反应电子转移情况:________。
-
3、科学家在研究化学物质常对其进行分类,以便对同类物质的性质进行深入研究,物质分类及转化思想贯穿整个化学学科学习的始终。
下列物质:①纯硫酸;②硝酸钾溶液;③铜;④固体;⑤固体;⑥固体;⑦二氧化碳;⑧熔融;⑨氨气。
(1)、能导电的是(填序号,下同),属于电解质的是 , 属于非电解质的是。(2)、写出⑧在水溶液中的电离方程式:。(3)、从物质的组成看、、都属于盐。(4)、检验④中金属阳离子的实验方法是(填实验操作的名称)。(5)、向⑤的水溶液中通入过量的⑦反应的离子方程式:。 -
4、某溶液X中可能含有下列离子中的若干种Cl-、、、Na+、Mg2+、Cu2+。为了确定该溶液的组成,取一定体积的上述溶液,进行了如下实验,下列说法正确的是
 A、白色沉淀1是硫酸钡 B、溶液2中滴入硝酸酸化了的硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl- C、溶液X中可能存在Mg2+ , 一定不存在Cu2+ D、溶液X中存在Na+、、
A、白色沉淀1是硫酸钡 B、溶液2中滴入硝酸酸化了的硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl- C、溶液X中可能存在Mg2+ , 一定不存在Cu2+ D、溶液X中存在Na+、、 -
5、利用数字传感器对氯水的光照实验进行数据采集与分析,下图显示的是
 A、氯离子的浓度 B、氧气的体积分数 C、氯水的pH值 D、氯水的导电能力
A、氯离子的浓度 B、氧气的体积分数 C、氯水的pH值 D、氯水的导电能力 -
6、1943年侯德榜发明联合制碱法,其生产流程可简要表示为

下列说法错误的是
A、纯碱分类属于盐不属于碱 B、流程中先通入再通入可达同样效果 C、若实验室进行第③步操作需要用到的玻璃仪器有烧杯、漏斗和玻璃棒 D、侯氏制碱法制备利用了物质溶解度差异 -
7、下列指定反应的离子方程式正确的是A、石灰乳与稀盐酸反应: B、与溶液反应: C、向氢氧化钡溶液中加入稀硫酸: D、碳酸镁与稀反应:
-
8、下列转化过程需要加入氧化剂才能实现的是A、 B、 C、 D、
-
9、下列物质在给定条件下的转化均能一步实现的是A、 B、 C、溶液 D、
-
10、下表中关于物质的分类正确的是
酸
碱
盐
碱性氧化物
酸性氧化物
混合物
A
波尔多液
B
冰水混合物
C
氢氧化铁胶体
D
石墨和金刚石
A、A B、B C、C D、D -
11、在日常生活中,金属腐蚀的现象普遍存在,金属腐蚀常常是自发进行的。回答下列问题:(1)、钢铁腐蚀分为析氢腐蚀和吸氧腐蚀:
①在酸性环境中,主要发生的腐蚀称为(填“析氢”或“吸氧”)腐蚀,此时正极上的电极反应式为。
②发生吸氧腐蚀时,每转移0.2mol电子,消耗气体的体积为mL(标准状况下)。
(2)、钢铁的保护法如图所示:
①图1为(填“牺牲阳极保护法”或“外加电流法”),此时锌板上发生的电极反应为。
②图2中,a为电源的(填“正”或“负”)极,判断的理由为。
-
12、下列反应方程式正确的是A、溶液中的水解方程式: B、铅酸蓄电池放电时正极电极反应: C、氢硫酸的电离方程式: D、甲烷燃烧热的热化学方程式:
-
13、Burns和Dainton研究了反应Cl2(g)+CO(g)COCl2(g)的动力学,获得其速率方程v=k[c(Cl2)]3/2[c(CO)]m , k为速率常数(只受温度影响),m为CO的反应级数。该反应可认为经过以下反应历程:下列表述错误的是
第一步:Cl22Cl 快速平衡
第二步:Cl+COCOCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
A、COCl属于反应的中间产物 B、第一步和第二步的活化能较低 C、决定总反应快慢的是第三步 D、第三步的有效碰撞频率较大 -
14、下列通过制取硫酸铝、氢氧化铝,获得氧化铝的装置和原理能达到实验目的的是
A
B
C
D



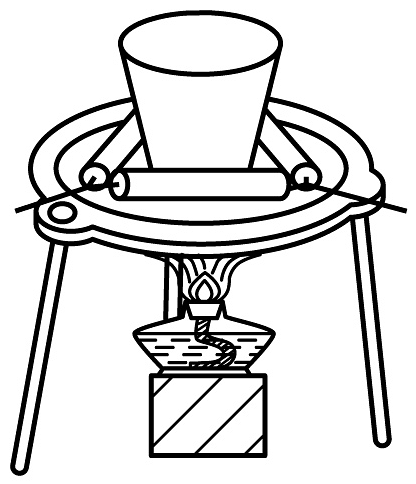
制硫酸铝
制氢氧化铝
过滤氢氧化铝
灼烧制氧化铝
A、A B、B C、C D、D -
15、乙硫醇()的综合利用及治理是当前环境领域关注的焦点之一。(1)、家用煤气中可掺入微量具有难闻气味的乙硫醇。
已知: kJ·mol
kJ·mol
kJ·mol
的。
(2)、是一种高效多功能的新型绿色水处理剂,可用于除去废水中的。已知水溶液中的物种分布分数如图所示。
①已知 , 比较和酸性强弱并从结构的角度说明理由:。
②写出工业废水时,氧化生成和的离子方程式:。
③一种采用电化学方法制取的装置原理如图所示。阳极使用的是易被氧化的活性铁电极。电解池阳极室中KOH溶液的浓度为14 mol·L、电解60 min,调节不同的电压,测得反应后溶液中的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图所示。
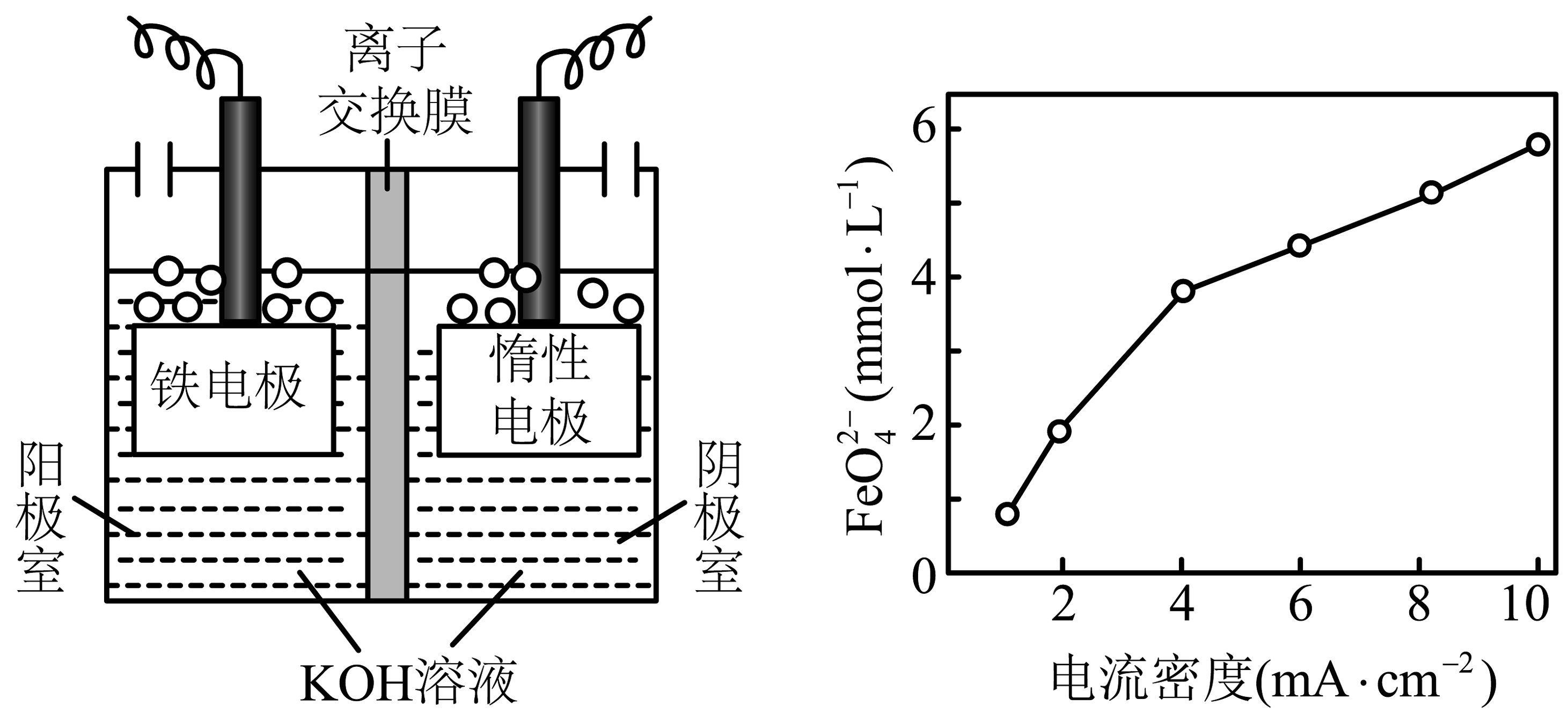
I 写出制取的电极反应式:。
II 电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是。
-
16、
草酸亚铁晶体( FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。
I.采用如下装置(可重复选用)进行实验探究纯净草酸亚铁晶体受热分解的产物。
 (1)装置D的名称为 , 作用是。(2)按照气流从左到右的方向,上述装置的连接顺序为a→→d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。(3)能证明分解产物中存在CO的现象是。
(1)装置D的名称为 , 作用是。(2)按照气流从左到右的方向,上述装置的连接顺序为a→→d→e→b→c→尾气处理装置(填仪器接口的小字母编号)。(3)能证明分解产物中存在CO的现象是。II.将54.0g草酸亚铁晶体在氮气的氛围中加热分解,得到分解产物的热重曲线(样品质量随温度的变化情况)如图所示:
 (4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为。
(4)B点时,固体只含有一种铁的氧化物,则所得固体的化学式为。Ⅲ.文献表明:相同条件下,草酸根(C2O)的还原性强于Fe2+。为检验这一结论进行以下实验。
资料:ⅰ.草酸(H2C2O4)为二元弱酸。
ⅱ.三水三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O为翠绿色晶体,光照易分解。其水溶液中存在:[Fe(C2O4)3] 3−Fe3++ 3C2O K=6.3×10−21
通过Fe3+和C2O在溶液中的反应比较Fe2+和C2O的还原性强弱
操作
现象
在避光处,向10mL0.5mol∙L-1FeCl3溶液中缓慢加入0.5mol∙L-1K2C2O4溶液至过量,搅拌,充分反应后,冰水浴冷却,过滤
得到翠绿色溶液和翠绿色晶体
(5)取实验中的少量晶体洗净,配成溶液,滴加KSCN溶液,不变红。继续加入硫酸,溶液变红。加硫酸后溶液变红的原因是。(6)经检验,翠绿色晶体为K3[Fe(C2O4)3]·3H2O。请设计实验,确认实验中没有发生氧化还原反应的操作和现象是。 -
17、一种化合物的合成路线如图:
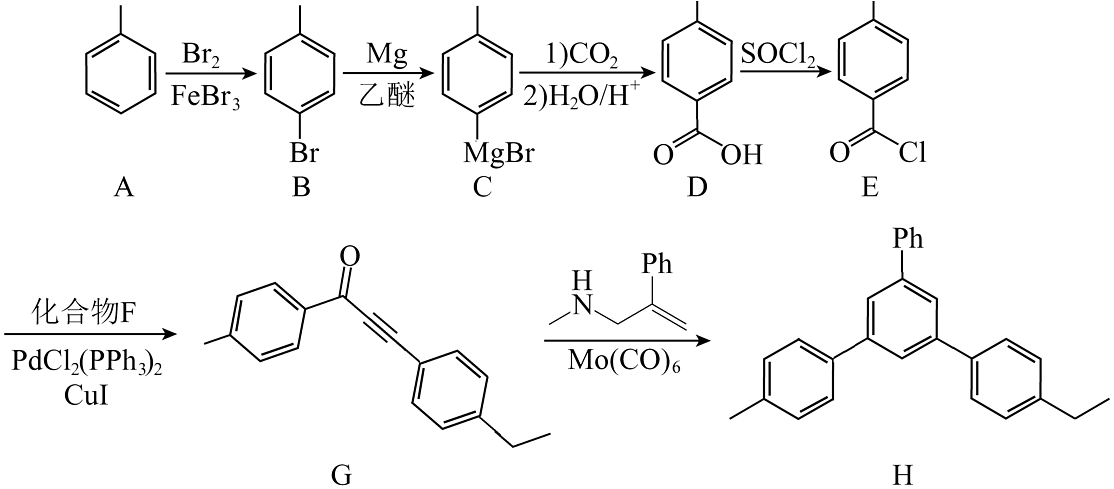
(代表苯基)。
(1)、化合物中含有的官能团名称是。(2)、有机物F的分子式为 , 则其结构简式为。(3)、D和乙二醇以物质的量比为完全酯化的产物有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式:。①分子中含有3种不同化学环境的氢原子;
②能发生银镜反应;
③能发生水解反应,且该分子水解时消耗。
(4)、的过程中,第一步反应C与反应生成物的结构简式为。(5)、写出以苯乙烯、苯甲酸、 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。 -
18、根据实验操作和现象,下列得出的结论正确的是
选项
实验操作和现象
实验结论
A
某待测溶液中先加入Ba(NO3)2溶液,产生白色沉淀,再加足量的盐酸,仍有白色沉淀
该待测溶液含有
B
向FeCl3溶液中滴加KI-淀粉溶液,溶液变蓝
氧化性:Fe3+>I2
C
将体积大小相同的镁片和铝片用导线连接好,同时插入盛有浓NaOH溶液的烧杯中。镁片表面有大量气泡,铝片逐渐溶解
金属性Al比Mg强
D
将乙醇和浓硫酸的混合液加热,将生成的气体通入溴水中,溴水褪色
乙醇只发生了消去反应
A、A B、B C、C D、D -
19、利用硝酸工业的尾气(含、)获得的部分工艺流程如图:
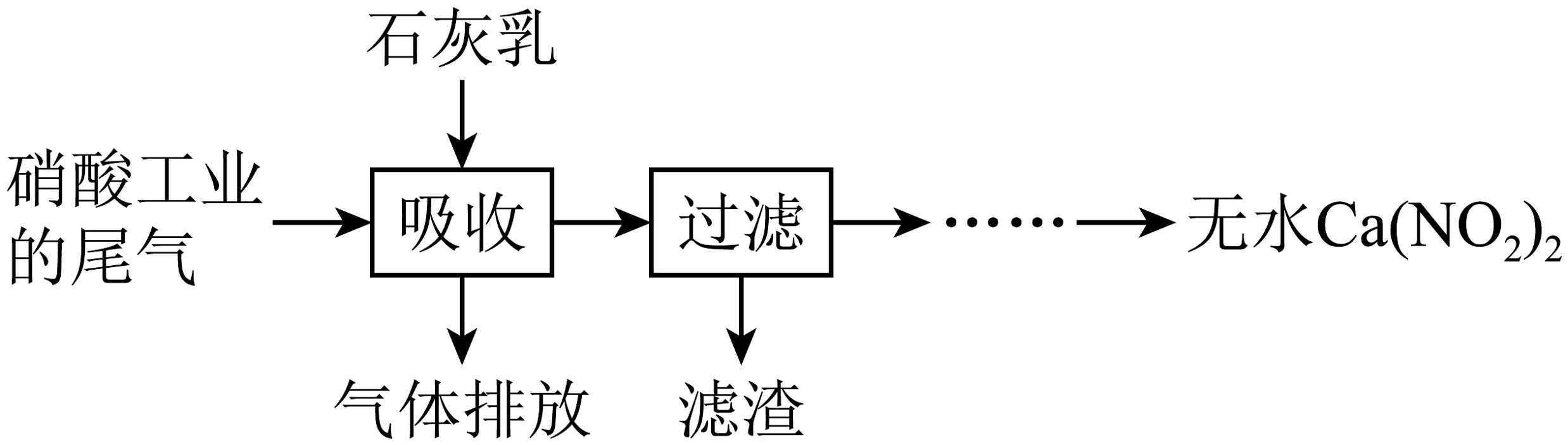
下列说法不正确的是
A、反应的 B、若尾气中产品中含量升高 C、为使尾气中被充分吸收,尾气与石灰乳采用气液逆流接触吸收 D、在酸性溶液中分解的离子方程式为 -
20、下列化学反应表示正确的是A、少量通入溶液中: B、向饱和食盐水中通入氨气和过量二氧化碳: C、用惰性电极电解饱和溶液: D、稀硫酸与稀氢氧化钾溶液发生反应: