相关试卷
- 2017-2018学年九年级下学期科学开学考试模拟卷
- 2017-2018学年浙教版科学九年级下学期第三章第6节 健康生活 同步练习
- 2017-2018学年浙教版科学九年级下学期第一章第5节 遗传与进化 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第5节 生态系统的稳定性 同步练习
- 2017-2018学年浙教版科学九年级下学期第三章第5节 人的运动系统和保健 同步练习
- 2017-2018学年浙教版科学九年级下学期 第四章第4节 实现可持续发展 同步练习
- 2017-2018学年浙教版科学九年级下学期第一章第4节 生物的进化 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第4节 生态系统的结构和功能 同步练习
- 2017-2018学年浙版科学九年级下学期 第三章第4节 非传染性疾病 同步练习
- 2017-2018学年浙教版科学九年级下学期第二章第3节 生物群落 同步练习
-
1、苦瓜在种植生产中对种子的活力要求较高,赤霉素能使种子提早结束休眠,提高发芽率。某科研小组对此进行了研究,实验步骤如下:
步骤1:选择一定数量、大小相近、用清水浸泡过的苦瓜种子,用滤纸吸干种子表面的水分,随机平均分为5组, 标为A、B、C、D、E。
步骤2: 将B、C、D、E4组种子分别浸泡在浓度为50毫克/升、100毫克/升、500毫克/升、1000毫克/升的赤霉素溶液中4小时,A组种子用清水浸泡4 小时,均放置在温度为30℃的环境中。
步骤3:取出苦瓜种子,用清水洗净,置于铺好湿润滤纸的培养皿中,于30℃的培养箱中进行培养。48小时后检查种子发芽情况,并统计发芽数。
 (1)、步骤1中用滤纸吸干种子表面水分的目的是:。(2)、下表是科研小组获得的有关赤霉素溶液对苦瓜种子萌发影响的数据。小明从数据分析得出:
(1)、步骤1中用滤纸吸干种子表面水分的目的是:。(2)、下表是科研小组获得的有关赤霉素溶液对苦瓜种子萌发影响的数据。小明从数据分析得出:组别
赤霉素浓度(毫克/升)
发芽种子数(权)
发芽率(4)
A
0
103
68.6
B
50
105
70.0
C
100
116
78.6
D
500
122
81.3
E
1000
120
80.0
处理苦瓜种子最佳赤霉素溶液浓度一定在500~1000毫克/升范围内。你赞同吗?并说明理由。。
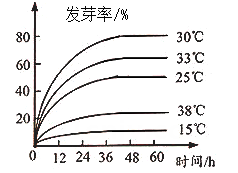
(3)、苦瓜种子种皮厚且硬,直接播种后出土困难。某科研小组统计了不同时间、不同温度下苦瓜种子的发芽率(如图)。结合图像信息可知,为了提高苦瓜种子的发芽率,在播种前除了用赤霉素处理外,还需对种子进行如何处理?。 -
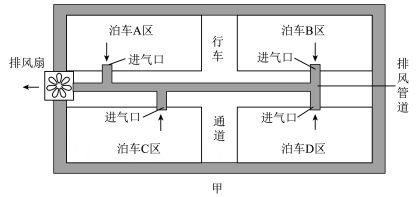
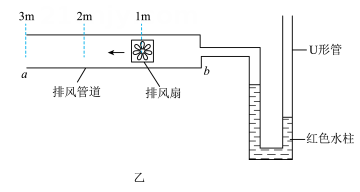
2、某地下车库安装了如图甲所示的管道式新风系统,该系统内包含有排风机和管道配件,通过排风扇将不同停车区的空气经管道排出室外。为了研究管道进气口的气体流速与管道长度(进气口与排风扇之间的距离)的关系,项目化小组设计了如图乙实验装置,并进行了如下实验:
实验组别
排风扇离 b端距离/米
U 形管两侧液面平均高度差/厘米
1
1
4.0
2
2
2.2
3
3
1.4
①取一根长为3米的排风管道 ab,在距离管口b端1米、2米和3米处标注刻度。
②将盛有红色水柱的U形管与排风管管口b端连接。
③将排风扇置于排风管1 米刻度处,调节排风扇以一功率工作,当U形管两侧液面稳定时,记录液面高度差,并重复3次取平均值。
④改变排风扇在排风管内位置,使其分别处于2米、3米刻度处,重复步骤③,并整理数据如表。
(1)、该实验是通过观察来比较管道进气口的气体流速大小。(2)、分析本实验的数据,可以得出的结论是:。(3)、若要进一步探究排风扇风力大小对管道进气口的气体流速的影响,需要增加实验步骤⑤,请简要写出该实验步骤:。 -
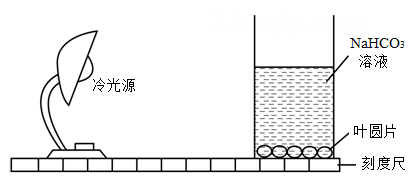
3、科学兴趣小组成员探究“光照强度对菠菜叶光合作用强度的影响”,设计了如下实验步骤:
步骤1:取生长旺盛的菠菜绿叶,用打孔器打出直径为6mm的叶圆片40片,并用注射器抽去叶圆片内的气体(抽气处理使叶圆片内几乎没有气体,在溶液中会下沉)。
步骤2:取4只相同规格的烧杯编号甲、乙、丙、丁,配制浓度为0.50%的NHCO,溶液(可使溶液中的CO2浓度保持恒定),4只烧杯中各加入20L:再向各烧杯中放入10片抽气后的叶圆片(均沉底)。
步骤3:取4盏相同规格的冷光源(不会引起温度变化),将盛叶圆片的4 只烧杯置于距光源不同远近的位置,如图所示。
步骤4:10分钟后统计各烧杯中叶圆片浮起的数目。重复多次实验,计算各组叶圆片浮起数目的平均值。
组织
烧杯与LED灯的距离/cn
叶圆片浮起数目的平均值/片 甲
6
7.5
乙
10
5.0
因
15
4.2
T
20
0.4
(1)、该实验通过调整来改变光照强度。(2)、该实验通过叶圆片浮起数量来判断光合作用强弱,试分析其中的原理。。(3)、通过实验,小组得出的结论是:在CO2浓度等其他条件相同时,植物光合作用的强度随光照强度的增强而增强,请你对该结论作出评价:。 -
4、下列框图中的物质均为初中科学常见的物质,其中A是建筑材料的主要成分,B是金属氧化物,C是能使澄清石灰水变浑浊的气体,下图是它们之间的相互转化关系,请回答下列问题。
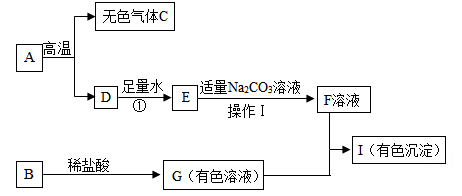 (1)、写出C物质的化学式。(2)、 操作Ⅰ的名称为。(3)、若I是红褐色沉淀,请写出G+F→I的化学方程式。
(1)、写出C物质的化学式。(2)、 操作Ⅰ的名称为。(3)、若I是红褐色沉淀,请写出G+F→I的化学方程式。 -
5、用高能粒子轰击原子是研究微观粒子内部结构的一种方法。
资料1:1909年,英国科学家卢瑟福用带正电荷的高速α粒子流轰击一片很薄的金箔(如图甲),并根据实验现象和人类已有的科学知识,在1911年提出了原子的有核模型。
资料2:1938年末,德国科学家哈恩用慢中子来轰击铀核,反应迅速并释放大量能量,铀分裂成一些原子核更小的元素,模型如图乙。
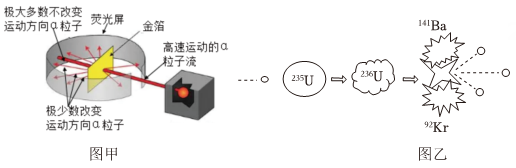 (1)、要解释卢瑟福实验中少量α粒子方向偏转的原因,不需要用到的知识是 。A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因(2)、哈恩的实验中核分裂的过程不属于化学反应,请结合图乙说明理由。。(3)、哈恩发现的现象,后来被应用在核电站发电。民众对核电站的建设存在很多争议,下列观点中属于支持核能发电的是。(可多选)
(1)、要解释卢瑟福实验中少量α粒子方向偏转的原因,不需要用到的知识是 。A、同种电荷相互排斥 B、电荷的定向移动形成电流 C、力是改变物体运动状态的原因(2)、哈恩的实验中核分裂的过程不属于化学反应,请结合图乙说明理由。。(3)、哈恩发现的现象,后来被应用在核电站发电。民众对核电站的建设存在很多争议,下列观点中属于支持核能发电的是。(可多选)① 核能发电无二氧化碳排放,不会加重温室效应
②核废料具极强放射性,且残留时间长、毒性剧烈
③核能发电厂热效率较低,会排放更多废热到环境里
④核能发电的成本中,燃料费用所占的比例较低,经济效应明显
⑤核燃料能量密度比化石燃料高几百万倍,燃料体积小,便于运输
-
6、在学习了酸碱知识后,某科学兴趣小组用黑枸杞提取液作了以下实验:
实验一:室温时,将蒸馏水和不同pH的硫酸,氢氧化钠溶液,分別装在14支试管中、并向每支试管中滴加3滴黑枸杞提取液。实验结果如下表:
试行
A
B
C
D
E
F
G
11
1
J
K
L
M
N
pH
1
2
3
4
5
6
7
8
9
10
11
12
13
14
颜色
粉红
粉红
粉红
浅紫
浅紫
浅紫
紫
蓝
蓝
深蓝
深蓝
灰绿
黄
黄棕
实验二:室温时,向4支试管中分别加入相同体积的以下4种物质,各滴加3滴黑枸杞提取液。实验结果如右表所示,根据实验,回答下列问题:
物质
稀盐酸
稀硫酸
牛奶
炉具清洁剂
颜色
粉红
浅紫
紫
黄
(1)、实验一试管中所装的为蒸馏水(选填字母)。(2)、根据实验现象分析,炉具清洁剂适合消除类污渍 (选填“酸性“或”碱性”)。(3)、小科认为黑枸杞提取液也可以作为酸碱指示剂的理由是。 -
7、甲醇等液体燃料被形象地称为“液态阳光”,以作为新型燃料来代替传统的煤、石油和天然气,工业上制取甲醇的原理如图所示。
 (1)、已知甲醇的化学式为CH3OH,则甲醇中碳元素与氢元素的质量比为。(2)、 甲醇燃烧的化学方程式为2CH3OH+3O22CO2+4X,则X的化学式为。(3)、通过这种“液态阳光技术”可将太阳能转化为化学能贮存在甲醇中,请你说出它的一个优点:。
(1)、已知甲醇的化学式为CH3OH,则甲醇中碳元素与氢元素的质量比为。(2)、 甲醇燃烧的化学方程式为2CH3OH+3O22CO2+4X,则X的化学式为。(3)、通过这种“液态阳光技术”可将太阳能转化为化学能贮存在甲醇中,请你说出它的一个优点:。 -
8、如图是稀盐酸滴入装有氢氧化钠溶液的试管中,恰好完全反应的微观示意图,图中小球代表反应前后溶液中的离子种类。
 (1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、 微粒“0”代表的是(用符号表示) 。(3)、氢氧化钠与盐酸反应的化学方程式为: 该反应属于复分解反应,判断其为复分解反应的依据是。
(1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、 微粒“0”代表的是(用符号表示) 。(3)、氢氧化钠与盐酸反应的化学方程式为: 该反应属于复分解反应,判断其为复分解反应的依据是。 -
9、启动“瓯江引水工程”后,温州市区将建成多水源供水格局。瓯江引水工程是通过凿穿山体隧洞,连接河道将鹿城区山福镇渡船头村的水源引入鹿城区西片水域,提升该区域水体品质。(1)、瓯江引水工程主要影响水循环中的____环节。A、植物蒸腾 B、降水 C、地表径流 D、蒸发(2)、瓯江引水工程有效提升我市台风季节防汛排涝能力。7-8月份是我市台风高发季节,如图是地球绕日公转示意图,我市台风高发季节在图中大致范围是在图中的哪两个数字之间。
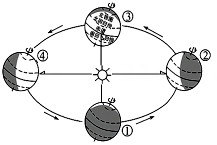 (3)、3月22日是 “世界水日”。水是一种重要的自然资源,节约用水、防治水污染应成为我们的自觉行为。下列做法不正确的是____。A、随手关闭水龙头 B、往河流里倾倒垃圾 C、农业上采用滴灌技术 D、工业废水经处理达标后排放
(3)、3月22日是 “世界水日”。水是一种重要的自然资源,节约用水、防治水污染应成为我们的自觉行为。下列做法不正确的是____。A、随手关闭水龙头 B、往河流里倾倒垃圾 C、农业上采用滴灌技术 D、工业废水经处理达标后排放 -
10、19世纪初,电灯尚未发明,煤矿工人在矿井中只能借助煤油灯照明。矿井中通常存在大量的甲烷气体,遇火极易发生爆炸。1815年,化学家戴维设计出一种安全矿灯——戴维灯(如图)。采用一种网眼很小的普通金属网罩住火焰,火焰只会在网中燃烧而不会引燃外界的甲烷气体。
 (1)、甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的。(2)、用戴维灯照明,不会引燃矿井中的甲烷,原因是金属网可以把火焰的热量迅速传递出去,矿井中甲烧气体的温度达不到。
(1)、甲烷与空气混合,遇火易发生爆炸,是因为甲烷燃烧释放大量的。(2)、用戴维灯照明,不会引燃矿井中的甲烷,原因是金属网可以把火焰的热量迅速传递出去,矿井中甲烧气体的温度达不到。 -
11、下列电路图中,R是滑动变阻器,R0是定值电阻。将图中的电表改装成质量表,可以直接从电表上读出待测货车的质量。现要求地磅工作时,货车质量越大,电表的示数也越大且表盘刻度均匀增加,下列电路设计符合要求的是( )A、
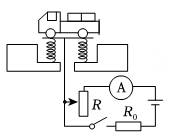 B、
B、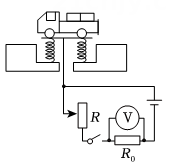 C、
C、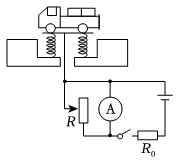 D、
D、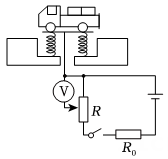
-
12、小明学习了常见的四种盐类:氯化钠(NaCl)、碳酸钠(Na2CO3)、碳酸氢钠碳酸钙 后,对它们的部分性质进行归纳整理并编制了检索表(如图)。检索表中M代表的是( )
检索表
1a⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯⋯P
10可溶于水 2
2↵ 加热不稳定 a
20加热不分解 3
3d与酸反应产生气泡 M
3b不与酸发生反应 N
A、NaCl B、Na2CO3 C、 D、 -
13、某校科学兴趣小组利用数字化传感器探究稀硫酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
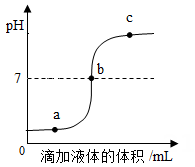 A、图中a 点所示溶液呈酸性 B、该实验是将稀硫酸逐滴滴入到盛有氢氧化钠溶液的烧杯中 C、b点表示稀硫酸与氢氧化钠恰好完全反应 D、图中b 点所示溶液中所含的溶质有 NaCl 和NaOH
A、图中a 点所示溶液呈酸性 B、该实验是将稀硫酸逐滴滴入到盛有氢氧化钠溶液的烧杯中 C、b点表示稀硫酸与氢氧化钠恰好完全反应 D、图中b 点所示溶液中所含的溶质有 NaCl 和NaOH -
14、跑步是常见的运动方式。为了便于运动数据记录,许多跑者使用了可穿戴“智能手环”。为保证“智能手环”用电,我国研发的“柔性、可裁剪碲化铋纤维素复合热点薄膜电池”(简称“薄膜电池”),它能充分贴合人体体表,实现体表散热为智能手环供电。请回答8-10题。(1)、碲化铋的化学式为Bi2Te3 , 其中铋元素(Bi)的化合价+3,则碲元素(Te)的化合价为( )A、+2 B、- 3 C、- 2 D、+3(2)、如图手环应用了电磁感应原理,其主体部分是一段内置有一小块磁铁的密闭的空心塑料管,管外缠绕着线圈。戴着这种手环运动时塑料管跟着手一起运动,磁铁则在管内反复运动产生电流,液晶上就会显示出运动的步数。下列与其原理相似的是( )
 A、
A、 B、
B、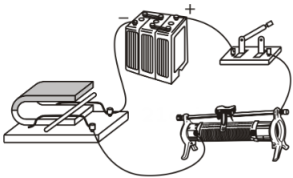 C、
C、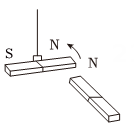 D、
D、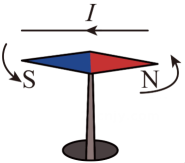 (3)、跑步时,人体会呼吸加速以满足对氧气的需求。如图是人体气体交换示意图,以下说法不正确的是( )
(3)、跑步时,人体会呼吸加速以满足对氧气的需求。如图是人体气体交换示意图,以下说法不正确的是( ) A、图甲中②处氧气浓度小于①处 B、图甲的气体交换是通过扩散作用实现的 C、图甲中①为人体的组织细胞,图乙中③为肺泡 D、图乙中③获得的氧气主要用于呼吸作用提供能量
A、图甲中②处氧气浓度小于①处 B、图甲的气体交换是通过扩散作用实现的 C、图甲中①为人体的组织细胞,图乙中③为肺泡 D、图乙中③获得的氧气主要用于呼吸作用提供能量 -
15、氢氧化钠是实验室一种常见的碱,在研究氢氧化钠性质实验中的部分实验及现象记录如下,其中现象不合理的选项是( )
选项
实 验
现 象
A
将 NaOH固体放在表面皿上,放置一会儿
固体受潮,逐渐溶解
B
向盛有NaOH 溶液的试管中滴入无色酚酞试液
溶液变红
C
向盛有 NaOH 溶液的试管中滴加稀HCl
有NaCl生成
D
向盛有NaOH溶液的试管中滴加 CuSO4溶液
产生蓝色(絮状)沉淀
A、A B、B C、C D、D -
16、下列选项中,物质的俗称,化学式和物质类别不一致的是( )A、水银———— Hg————单质 B、生石灰——CaO——氧化物 C、消石灰———— Ca(OH):————碱 D、小苏打————Na2CO3————盐
-
17、规范操作是科学实验成功的关键。下列实验操作规范的是( )A、溶解物质
 B、测液体 pH
B、测液体 pH C、取化学药品
C、取化学药品 D、稀释浓硫酸
D、稀释浓硫酸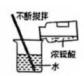
-
18、小柯想测定实验室制二氧化碳的石灰石中碳酸钙的质量分数,采用了如下方法:称取该石灰石样品20g,把100g稀盐酸分五次加入,测量过程所得数据见下表(已知石灰石样品中的杂质不溶于水,不与稀盐酸反应)。请计算:
序号
1
2
3
4
5
加入稀盐酸的质量/g
20
20
20
20
20
剩余固体的质量/g
15
a
5
2.8
2.8
(1)、上表中a的数值为。(2)、样品中碳酸钙的质量分数。(3)、第3次实验结束时所得溶液溶质质量分数。(计算结果精确到0.1%) -
19、航母舰体需要定期除锈维护,为实现对除锈废液(溶质主要成分为HCl、FeCl3 , 其他杂质忽略)的综合利用,需测定废液中HCl的质量分数。取200g废液样品,依次加入100g溶质质量分数相同的NaOH 溶液,过滤,称重,相关数据如图。回答下列问题。
 (1)、第③次过滤后,滤液中溶质的成分为 (用化学式表示)。(2)、所用NaOH 溶液溶质的质量分数(写出计算过程)。(3)、废液样品中 HCl的质量。
(1)、第③次过滤后,滤液中溶质的成分为 (用化学式表示)。(2)、所用NaOH 溶液溶质的质量分数(写出计算过程)。(3)、废液样品中 HCl的质量。 -
20、已知某测电笔内部电阻为5×105欧,人体电阻为4000欧。如图所示家庭照明电路中,闭合开关S,电灯L发光。
 (1)、此时人拿到测电笔测试A 点时,测电笔的氖管(填“发”或“不发”)光。(2)、如此时将零线保险盒盖拔掉(断路),人拿测电笔测试A点时(A点在灯泡右边),测电笔的氖管(填“发”或“不发”)光。通过他的电流是毫安?(写出计算过程)
(1)、此时人拿到测电笔测试A 点时,测电笔的氖管(填“发”或“不发”)光。(2)、如此时将零线保险盒盖拔掉(断路),人拿测电笔测试A点时(A点在灯泡右边),测电笔的氖管(填“发”或“不发”)光。通过他的电流是毫安?(写出计算过程)