-
1、甲、乙两烧杯内盛有等质量、等质量分数的盐酸.小金同学将镁逐渐加入甲烧杯,铁逐渐加入乙烧杯,测量加入的金属质量m和相应的烧杯内物质质量变化量△m,画出△M-m曲线oac和obc的示意图,如图所示.根据图中信息,曲线oac表示的是烧杯中△M与m的变化关系(填“甲”或“乙”),当乙烧杯内加入铁的质量为m1时,溶液中溶质还有。

-
2、已知A、B、C、D、E、F为常见物质,其中A、B含有相同的元素,B、E为氧化物,C、D、F都为单质。它们相互转化的关系如图所示(图中反应条件去)。

【已知氢气与氧化铜(或氧化铁)在加热的条件下,会发生反应,生成金属铜单质(或金属铁单质)和水】
(1)、X在反应①中起作用。(2)、写出有关物质的化学式:A;C。(3)、若F不溶于稀硫酸,写出F可能的化学式 , 请写出和反应③基本反应类型相同的化学方程式。 -
3、在实验室用如图所示装置进行CO和的分离和干燥。甲、乙、丙中分别盛有氢氧化钠溶液、浓硫酸、稀盐酸,其操作过程为先关闭b,再打开a,此时甲中发生反应的化学方程式为 , 乙中排出(填化学式)气体。若要获得另一种气体,则关闭a,打开b,此时甲中发生反应的化学方程式为。

-
4、绿矾()和胆矾()两者都是含结晶水的盐,均为蓝绿色晶体.
(1)能鉴别出这两种盐溶液的物质是(选填字母).
A.铁丝 B.铜丝 C.硫酸 D.氢氧化钠
(2)《图经本草》中描述了加热绿矾制取稀硫酸的过程:取此一物(绿矾),置于铁板上,聚炭封之,囊袋吹令火炽,其矾沸流出,色赤如融金汁.发生的化学方程式:
, .
X的化学式是 .
-
5、地震发生的原因很复杂。据部分研究,孕震过程中比较活泼的物质有、氢等。孕震过程中在地壳的岩层中碳酸盐受热发生反应: , 。(1)、当地应力(压力)增大时,在地下水中的溶解度增大,同时使得水的pH(填“增大”“减小”或“不变”)。(2)、氢在目前的地震预测中被公认为是一种灵敏元素。一般认为,地壳中水蒸气和氧化亚铁作用会产生氢气和氧化铁,该反应的化学方程式为。
-
6、往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中错误的是
 A、bc段(不含两端点)析出的金属是Cu B、ab段(不含两端点)对应溶液中含有四种金属阳离子 C、线段bc和cd相比,会略“陡”一些,但不一定会更长 D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , m1>m2
A、bc段(不含两端点)析出的金属是Cu B、ab段(不含两端点)对应溶液中含有四种金属阳离子 C、线段bc和cd相比,会略“陡”一些,但不一定会更长 D、若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2 , m1>m2 -
7、下列实验方案能达到实验目的的是( )
选项
实验目的
实验方案
A
鉴别稀盐酸和稀硫酸溶液
加入硝酸银溶液,观察现象
B
检验氢氧化钠溶液变质程度
先加过量的氯化钡,过滤后向滤液中加入酚酞
C
除去二氧化碳中混有的氯化氢
将气体通过足量的氢氧化钠溶液
D
除去中混有的KCl
加水溶解、蒸发结晶
A、A B、B C、C D、D -
8、中国科学家已实现由CO2到淀粉的全人工合成,其中一步重要反应的物质转化如图所示(反应a中,各物质分子个数比为1:1:1:1)。下列说法不正确的是( )
 A、是反应a、b中可循环利用的物质 B、反应a、b中均有元素化合价的改变 C、由反应a可推测甲醛中含氢量高于甲醇 D、为使甲醇持续转化为甲醛,反应b需补充
A、是反应a、b中可循环利用的物质 B、反应a、b中均有元素化合价的改变 C、由反应a可推测甲醛中含氢量高于甲醇 D、为使甲醇持续转化为甲醛,反应b需补充 -
9、化学兴趣小组在某密闭容器中用传感器和湿度传感器探究某有机物R的组成,实验装置如图所示。实验前R的质量为0.62g,燃烧后经过数据换算可得装置中0.88g和0.54g(本实验条件空气中和含量忽略不计)。下列说法错误的是( )
 A、物质R中C与H的元素质量比为4:1 B、本实验可推算出R中含有碳、氢、氧元素 C、物质R的组成元素中O质量分数最高 D、R可能为且实验中可能有剩余
A、物质R中C与H的元素质量比为4:1 B、本实验可推算出R中含有碳、氢、氧元素 C、物质R的组成元素中O质量分数最高 D、R可能为且实验中可能有剩余 -
10、盛有溶液的试管中逐滴滴溶液至恰好完全反应,反应前后溶液中存在的主要离子模型如图所示,则下列分析错误的是( )
 A、试管中能观察到有白色沉淀生成 B、反应后试管中溶质的质量比反应前大 C、“”表示的离子是 D、试管中发生的化学反应属于复分解反应
A、试管中能观察到有白色沉淀生成 B、反应后试管中溶质的质量比反应前大 C、“”表示的离子是 D、试管中发生的化学反应属于复分解反应 -
11、小乐利用如图所示实验装置,选用氯酸钾和二氧化锰制取氧气。实验结束后,通过溶解、过滤、洗涤和干燥等操作从剩余固体中回收二氧化锰。下列对装置或操作分析正确的是( )
 A、发生装置:试管口略向下倾斜的目的是利于氧气排出 B、收集装置:瓶口向上放置时,氧气从导管a通入 C、过滤操作:用到的玻璃仪器只有烧杯和漏斗 D、洗涤操作:可向最后一次洗涤液中滴加硝酸银溶液来检测二氧化锰是否洗涤干净
A、发生装置:试管口略向下倾斜的目的是利于氧气排出 B、收集装置:瓶口向上放置时,氧气从导管a通入 C、过滤操作:用到的玻璃仪器只有烧杯和漏斗 D、洗涤操作:可向最后一次洗涤液中滴加硝酸银溶液来检测二氧化锰是否洗涤干净 -
12、下列图像能正确反映其对应的实验操作的是( )
 A、向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量 B、相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应 C、向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量 D、用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量
A、向稀硫酸和硫酸铁的混合溶液中滴加氢氧化钠溶液直至过量 B、相同质量的铁和锌分别与质量分数相同的足量稀盐酸反应 C、向一定量氯化钡与盐酸的混合溶液中逐滴加入碳酸钠溶液至过量 D、用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量 -
13、现有的固体混合物,与100g9.8%的稀恰好完全反应,形成不饱和溶液。则原固体混合物中镁元素的质量为( )A、1.2g B、1.6g C、2.4g D、4.8g
-
14、取稀盐酸与氢氧化钠反应后的溶液进行实验,下列能说明两者恰好完全反应的是( )A、滴入硫酸铜溶液,生成蓝色沉淀 B、滴入酚酞试液,溶液显无色 C、加入氧化铜粉末,溶液变蓝色 D、测得溶液中Na+与Cl-的个数比为1:1
-
15、实验室用4.9g氯酸钾和放在试管里加热,反应后称得剩余物质的质量为4.98g,那么剩余物质是( )A、和 B、KCl和 C、KCl和 D、
-
16、为实现“碳达峰”促进碳中和,对的转化和利用技术的研究备受关注。利用催化剂将二氧化碳转化为甲醇是一种理想的转化方向。其变化前后的微观示意图如图所示。下列说法正确的是( )
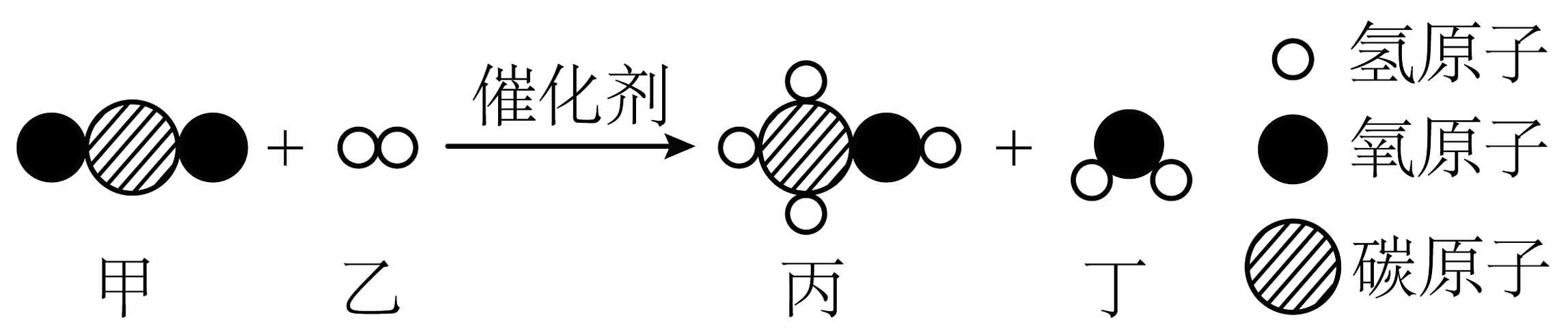 A、甲分子模型代表的是水分子 B、丙分子中碳、氢原子质量比为1:4 C、参加反应的甲、乙分子的个数比为1:1 D、组成甲醇的三种元素中氧元素的质量分数最大
A、甲分子模型代表的是水分子 B、丙分子中碳、氢原子质量比为1:4 C、参加反应的甲、乙分子的个数比为1:1 D、组成甲醇的三种元素中氧元素的质量分数最大 -
17、下列实验操作正确的是( )A、
 除去CO中的水蒸气
B、
除去CO中的水蒸气
B、 点燃酒精灯
C、
点燃酒精灯
C、 稀释浓硫酸
D、
稀释浓硫酸
D、 测溶液pH
测溶液pH
-
18、喷泉是一种常见的自然现象,其产生的原因是存在压强差。在化学实验中经常也可以形成美丽的喷泉。

(1)在甲图的装置中,倒置于铁架台的圆底烧瓶中充满干燥的O2气体,连接在瓶塞上的导管伸入到装有水的烧杯中(此时止水夹关闭)。不久即可看到白磷自己燃烧起来。待白烟消失,烧瓶冷却后,打开止水夹,可以观察到的现象:。
(2)某同学积极思考后,设计了如图乙的装置,也同样形成了喷泉。已知该同学在广口瓶中装入的是稀盐酸和另一种固体物质,待它们反应完全后,打开止水夹,在上方的烧瓶内也形成喷泉。该同学加入的固体物质不可能是
A.锌粒(Zn) B.碳酸钙(CaCO3) C.木炭(C) D.镁(Mg)
(3)比较甲、乙两套装置,从产生喷泉的原理来分析,甲装置是(填“增大”或“减小”)上部烧瓶内气体压强;乙装置是(填“增大”或“减小”)下部广口瓶内气体压强。
(4)城市中常见的人造喷泉以及自然界的火山爆发原理与上述(填“甲”或“乙”)装置的原理相似。
-
19、某公司生产出的纯碱产品中经检测只含有氯化钠杂质。为测定产品中碳酸钠的质量分数,20℃时,称取该产品样品26.5g,加入盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程用精密仪器测得烧杯内混合物的质量(m)与反应时间(t)关系如下图所示。

求:(1)生成CO2的质量
(2)该纯碱样品中Na2CO3的质量分数。
(3)求出反应后NaCl溶液的质量分数。
-
20、“摇摇杯”是一类深受学生喜爱的饮水杯,市面上的“摇摇杯”工作原理也不尽相同。现有某种摇摇杯,它是利用特殊装置将摇动水杯的能量收集并转化为电能用于加热杯子里的水。已知该摇摇杯可装500g的水,水的比热容为 , 氢气的热值为。试计算:
(1)如果上述摇摇杯中装满25℃的水,要使水温升高至30℃,杯中水需要吸收多少能量?
(2)假设上述水升温所需能量都来自摇动杯子所做的功,水平摇动杯子的力平均为50N,水平摇动一次的幅度为0.5m。(水平摇动来、回分别算一次)则至少需要水平摇动多少次才能达到上述水温?
版本: