北京版化学九年级下册第八章 溶液 单元测试(提升卷)
试卷更新日期:2026-01-06 类型:单元试卷
一、选择题(每题3分,共45分)
-
1. 下列各溶液中,溶质对应错误的是
选项
溶液名称
溶质
A
生理盐水
氯化钠
B
75%的医用酒精
乙醇
C
泥水
泥
D
过氧化氢溶液
过氧化氢
A、A B、B C、C D、D2. 夏日里想随时喝到凉爽的饮料,可以自制化学“冰箱”,即把一种固体物质放入一定量的水中,就可以形成低温小环境。这种固体可以是( )A、食盐 B、硝酸铵 C、氧化钙 D、氢氧化钠3. 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是
①石灰石和稀盐酸;②镁和稀盐酸;③氢氧化钠和水;④硝酸铵和水
A、①②③④ B、①②③ C、①②④ D、②③④4. 下列关于溶液的说法正确的是A、溶液都是无色透明的液体 B、气体、液体、固体都可以作为溶液的溶质 C、溶液由溶质和溶剂组成,所以溶液的质量和体积等于溶质和溶剂的质量和体积 D、溶液具有均一性、稳定性,所以具有均一性、稳定性的液体都是溶液5. 一定温度下,从100g硝酸钾的饱和溶液中倒出20g该溶液,对剩余溶液的相关描述正确的有①溶质的质量减少、②溶剂的质量不变、③溶液的浓度变大、④溶液的质量减少、⑤溶液的密度不变
A、①②③ B、②③④ C、①②⑤ D、①④⑤6. t3℃时,将相同质量的a和b两种固体分别加入盛有等质量水的甲、乙烧杯中,充分溶解后温度不变,现象如图一所示,图二为两种物质的溶解度曲线。以下说法不正确的是 A、甲烧杯中的溶质为a物质 B、乙烧杯中的溶质为b物质 C、甲烧杯中形成的溶液一定是不饱和溶液 D、t2℃时,a、b两物质的溶解度相等7. 为探究物质溶解过程中的能量变化,某同学设计图Ⅰ所示装置.在盛有水的烧杯中放入一装有饱和硝酸钾溶液的试管,向水中加入足量物质X,搅拌.结合图Ⅱ硝酸钾溶解度曲线,对硝酸钾溶液变化的推断,合理的是( ).
A、甲烧杯中的溶质为a物质 B、乙烧杯中的溶质为b物质 C、甲烧杯中形成的溶液一定是不饱和溶液 D、t2℃时,a、b两物质的溶解度相等7. 为探究物质溶解过程中的能量变化,某同学设计图Ⅰ所示装置.在盛有水的烧杯中放入一装有饱和硝酸钾溶液的试管,向水中加入足量物质X,搅拌.结合图Ⅱ硝酸钾溶解度曲线,对硝酸钾溶液变化的推断,合理的是( ).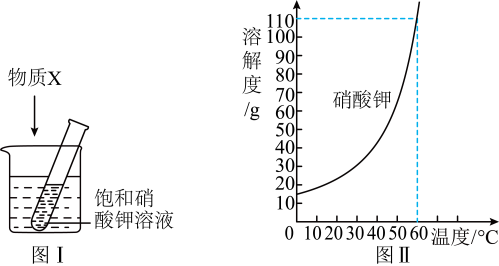
①X 为 NaCl 固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
②X为 NaOH 固体,试管中无晶体析出,硝酸钾溶液仍是饱和溶液
③X为 NH4NO3晶体,试管中有晶体析出,硝酸钾溶液仍是饱和溶液
④X 为浓 H2SO4 , 试管中无晶体析出,硝酸钾溶液为不饱和溶液
A、①②③ B、①③④ C、①②④ D、②③④8. 实验室欲配制20g溶质质量分数为10%的NaCl溶液,配制过程如图所示。下列叙述错误的是 A、配制该溶液的顺序为C→B→D→E→A B、配制该溶液需要2g氯化钠固体 C、将配制的20g溶液倒出一半,剩余溶液的溶质质量分数为5% D、量取水的过程中仰视读数,所得溶液的溶质质量分数小于10%9. 将某碳酸饮料拧开,倒入装有冰块的杯中,如图。下列分析合理的是
A、配制该溶液的顺序为C→B→D→E→A B、配制该溶液需要2g氯化钠固体 C、将配制的20g溶液倒出一半,剩余溶液的溶质质量分数为5% D、量取水的过程中仰视读数,所得溶液的溶质质量分数小于10%9. 将某碳酸饮料拧开,倒入装有冰块的杯中,如图。下列分析合理的是 A、拧开瓶盖后,二氧化碳溶解度变大 B、产生气泡的原因是饮料与冰发生化学反应 C、冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液 D、图中现象能说明二氧化碳溶解度与压强、温度的关系10. 甲、乙两种物质的溶解度曲线如图所示.下列说法错误的是( )
A、拧开瓶盖后,二氧化碳溶解度变大 B、产生气泡的原因是饮料与冰发生化学反应 C、冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液 D、图中现象能说明二氧化碳溶解度与压强、温度的关系10. 甲、乙两种物质的溶解度曲线如图所示.下列说法错误的是( ) A、甲、乙两种物质的溶解度均随温度升高而增大 B、时,将甲加入到水中,只能得溶液 C、时的甲、乙两种饱和溶液,降温至时浓度相等 D、可用蒸发结晶的方法提纯含有少量杂质的甲物质11. 用溶质质量分数为30%的KNO3溶液和溶质质量分数为10%的KNO3溶液配制溶质质量分数为20%的KNO3溶液,则需溶质质量分数为30%和溶质质量分数为10%的溶液质量比为( )。A、1:1 B、2:1 C、1:3 D、1:412. 20℃时,有甲、乙、丙三瓶质量相等的KNO3饱和溶液,若将甲溶液降低温度至10℃;将乙蒸发掉10g水,使之成为高温下的不饱和溶液;从丙中取出一半溶液.此时,甲、乙、丙三瓶溶液的KNO3质量分数的数值关系是( )A、丙>乙>甲 B、乙>甲=丙 C、乙>甲>丙 D、乙>丙>甲13. 工业上用Mg(NO3)2作为浓缩HNO3的吸水剂,向m1g溶质质量分数为65%的硝酸溶液中加入m2g溶质质量分数为72 %的Mg (NO3)2溶液,蒸馏,分别得到97.5%硝酸溶液和60%硝酸镁溶液,若蒸馏过程中,硝酸、硝酸镁和水均无损耗,则投料质量比 为()A、0.3 B、0.4 C、0.5 D、0.614. 25℃时向一定量饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )A、
A、甲、乙两种物质的溶解度均随温度升高而增大 B、时,将甲加入到水中,只能得溶液 C、时的甲、乙两种饱和溶液,降温至时浓度相等 D、可用蒸发结晶的方法提纯含有少量杂质的甲物质11. 用溶质质量分数为30%的KNO3溶液和溶质质量分数为10%的KNO3溶液配制溶质质量分数为20%的KNO3溶液,则需溶质质量分数为30%和溶质质量分数为10%的溶液质量比为( )。A、1:1 B、2:1 C、1:3 D、1:412. 20℃时,有甲、乙、丙三瓶质量相等的KNO3饱和溶液,若将甲溶液降低温度至10℃;将乙蒸发掉10g水,使之成为高温下的不饱和溶液;从丙中取出一半溶液.此时,甲、乙、丙三瓶溶液的KNO3质量分数的数值关系是( )A、丙>乙>甲 B、乙>甲=丙 C、乙>甲>丙 D、乙>丙>甲13. 工业上用Mg(NO3)2作为浓缩HNO3的吸水剂,向m1g溶质质量分数为65%的硝酸溶液中加入m2g溶质质量分数为72 %的Mg (NO3)2溶液,蒸馏,分别得到97.5%硝酸溶液和60%硝酸镁溶液,若蒸馏过程中,硝酸、硝酸镁和水均无损耗,则投料质量比 为()A、0.3 B、0.4 C、0.5 D、0.614. 25℃时向一定量饱和KNO3溶液中逐渐加入KNO3固体,则下列图象中能正确表示此过程溶质质量变化规律的是( )A、 B、
B、 C、
C、 D、
D、 15. 某化学兴趣小组在研究碳酸钠的过程中,通过观察与实验(不考虑水分的蒸发),得出的结论正确的一项是
15. 某化学兴趣小组在研究碳酸钠的过程中,通过观察与实验(不考虑水分的蒸发),得出的结论正确的一项是温度/℃
20
30
40
50
60
80
100
溶解度/g
21.8
39.7
48.8
47.3
46.4
45.1
44.7
在不同温度时的溶解度
 A、①中溶液的溶质质量分数为21.8% B、降温时,碳酸钠溶液不一定有晶体析出 C、②中加入氧化钙前、后均为碳酸钠饱和溶液 D、30℃时,碳酸钠饱和溶液的质量一定是139.7g
A、①中溶液的溶质质量分数为21.8% B、降温时,碳酸钠溶液不一定有晶体析出 C、②中加入氧化钙前、后均为碳酸钠饱和溶液 D、30℃时,碳酸钠饱和溶液的质量一定是139.7g二、填空题(共7分)
-
16. 如图为氯化钠和硝酸钾的溶解度曲线,根据图示回答以下问题:
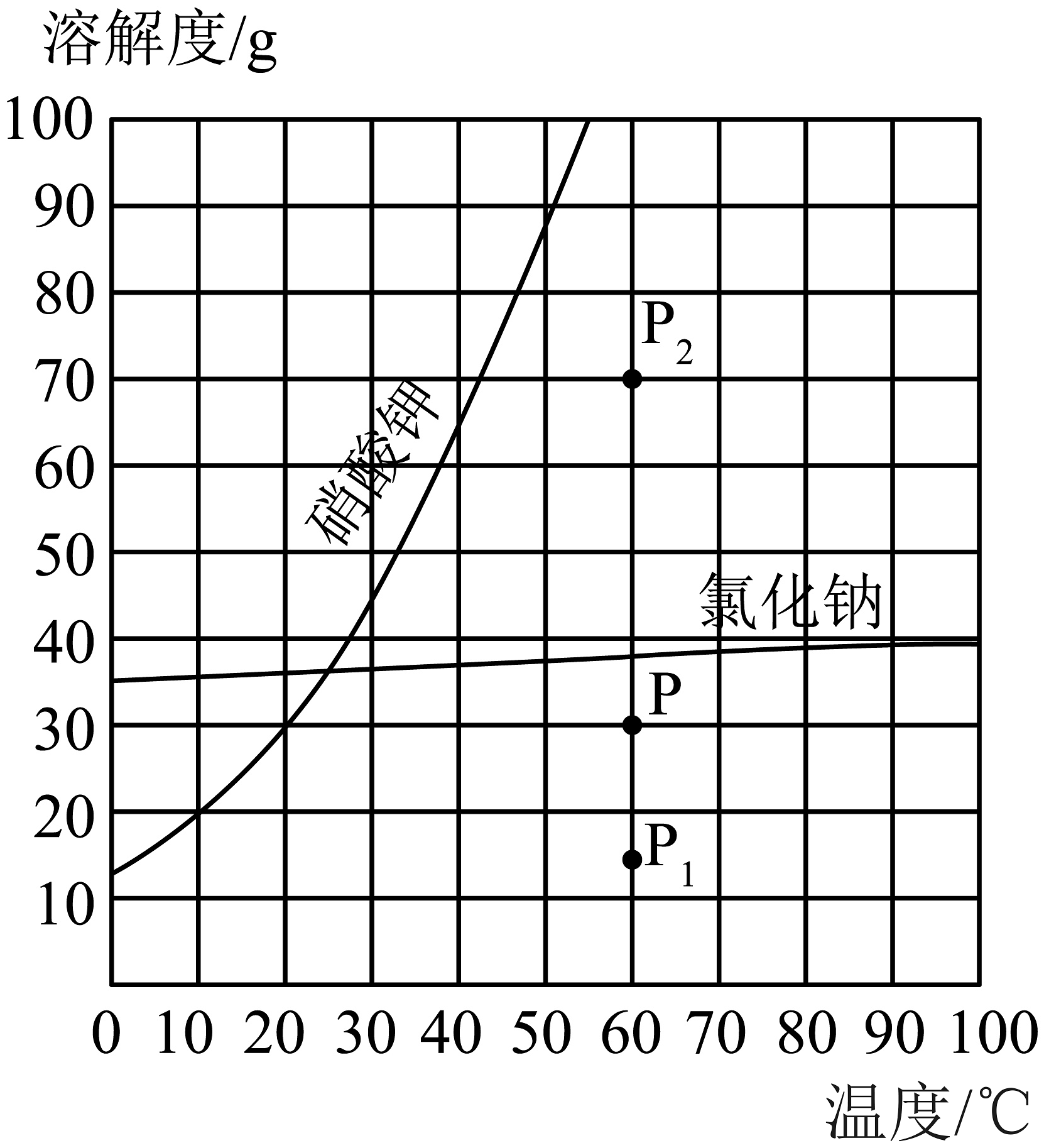 (1)、图中P点表示氯化钠的(填“饱和”或“不饱和”)溶液,保持温度不变,蒸发部分溶剂后,溶液的状态可能是(填“P1”或“P2”);某氯化钠饱和溶液中混有少量硝酸钾,提纯氯化钠时宜选用的结晶方法是。(2)、20℃,NaCl的溶解度为36g。该温度下,将gNaCl固体完全溶解于50g水配得饱和溶液,此溶液的溶质质量分数为(结果精确到0.1%)。从微观角度分析,如图中最接近NaCl溶液真实情况的是(填字母序号)。
(1)、图中P点表示氯化钠的(填“饱和”或“不饱和”)溶液,保持温度不变,蒸发部分溶剂后,溶液的状态可能是(填“P1”或“P2”);某氯化钠饱和溶液中混有少量硝酸钾,提纯氯化钠时宜选用的结晶方法是。(2)、20℃,NaCl的溶解度为36g。该温度下,将gNaCl固体完全溶解于50g水配得饱和溶液,此溶液的溶质质量分数为(结果精确到0.1%)。从微观角度分析,如图中最接近NaCl溶液真实情况的是(填字母序号)。 (3)、如图所示,小烧杯中是底部有未溶解固体的硝酸钾溶液,若使其固体继续溶解,在大烧杯的水中可以加入的物质是___________(填字母序号)。
(3)、如图所示,小烧杯中是底部有未溶解固体的硝酸钾溶液,若使其固体继续溶解,在大烧杯的水中可以加入的物质是___________(填字母序号)。 A、NH4NO3固体 B、NaCl固体 C、NaOH固体
A、NH4NO3固体 B、NaCl固体 C、NaOH固体三、推断题(共6分)
-
17. 甲是三种固体在水中的溶解度曲线, 图乙是小明同学所做的有关硝酸钾实验, 请根据要求回答下列问题:

图甲中硝酸钾曲线上点的坐标信息分别为: , 结合图乙的操作回答:
(1)、①的溶液中溶质质量分数为 (计算结果精确至。(2)、①、②、③中, 属于饱和溶液的是 (填数字序号)。(3)、③中析出晶体的质量是g。四、流程题(10分)
-
18. 肼(N2H4)是氮和氢形成的一种化合物,易溶于水.工业上利用尿素法生产肼,同时得到出副产品十水合碳酸钠,其工艺流程如下:

制肼过程的反应为:CO(NH2)2(尿素)+NaClO+2NaOH═N2H4+Na2CO3+NaCl+H2O.
(1)、实验室若配制30%烧碱溶液,所需的玻璃仪器除玻璃棒外,还有(填编号).A漏斗 B烧杯 C烧瓶 D量筒
(2)、已知:Cl2+H2O═HCl+HClO,请推测Cl2与NaOH溶液发生反应的化学方程式: . 从后续反应过程来看,若要使原料不浪费,合成次氯酸钠时投入的液氯与烧碱的质量之比为71: .(3)、在实验室中,欲从母液中分离出十水合碳酸钠晶体.可采用的操作依次为(填编号).A蒸馏 B蒸发 C灼烧 D过滤 E冷却结晶
(4)、肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等.请写出肼除氧时发生反应的化学方程式: .五、实验探究题(共22分)
-
19. 溶液在生产生活中有重要的用途。(1)、稀盐酸可用于除铁锈。稀盐酸中的溶质是(填名称)。(2)、甲、乙是两种不含结晶水的固体物质,请结合图1、图2,回答下列问题。

①t1℃时,乙饱和溶液中溶质和溶液的质量比为(填最简整数比)。
②将t2℃时甲、乙两种物质的饱和溶液分别升温至t3℃,所得两种溶液的溶质质量分数的关系为(填字母)。
A.甲 > 乙 B.甲 = 乙 C.甲 < 乙 D.无法比较
③某同学按图2所示步骤进行实验。下列说法正确的是(填字母)。
A.I中溶液是t2℃时甲的不饱和溶液 B.I中甲的质量分数为15%
C.Ⅱ中溶液是t3℃时甲的不饱和溶液 D.Ⅲ中有10 g甲的晶体析出
(3)、某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,共消耗氢氧化钠溶液40 g,洗涤后的溶液呈中性。这一定量石油产品中含硫酸的质量是?20.“圆梦”化学兴趣小组在老师的指导下开展了以“制作叶脉书签”为主题的项目式学习,实验小组按照以下流程开展了探究活动。

请结合任务回答下列问题。
【任务一】配制氢氧化钠溶液
兴趣小组的同学用氢氧化钠固体和水分别配制1%、5%和10%的氢氧化钠溶液(水的密度为)。
(1)为完成实验,除药匙、烧杯、托盘天平、量筒、胶头滴管、细口瓶外,还须用到的仪器是________(填名称)。
(2)配制的氢氧化钠溶液,需要氢氧化钠固体________g。该同学用量筒量取实验所用的蒸馏水,读数视线如图所示,实际量取水的体积下________(选填“”“”或“”);若其他操作均正确,该同学所配NaOH溶液中溶质的质量分数________(选填“偏大”、“偏小”或“不变”)。

(3)将氢氧化钠固体溶于水,用手触摸烧杯,感觉发烫,说明________。
(4)若用100g溶质质量分数为10%的氢氧化钠溶液配制溶质质量分数为5%的氢氧化钠溶液,需要加水的质量为________g。
【任务二】探究制作“叶脉书签”的最佳条件
实验Ⅰ:相同煮沸时间内,将树叶放入不同浓度的氢氧化钠溶液,处理后叶片变化如下表。
NaOH
1%
5%
10%
叶片变化
留有很多叶肉
留有较多叶肉
残留很少叶肉
实验Ⅱ:在10%的氢氧化钠溶液里,将树叶进行不同时间的煮沸,处理后叶片变化如下表。
煮沸时间
叶片变化
留有较多叶肉
残留很少叶肉
叶片卷起来,叶肉与叶脉不易分离
(5)实验Ⅰ的探究目的是________。
(6)通过实验Ⅰ、Ⅱ可知,制作“叶脉书签”的最佳条件是___________(填字母序号)。
A. 1%、 B. 5%、 C. 10%、 D. 10%、 六、计算题(共10分)
-
21. 学习小组的同学想测定一瓶失去标签的稀盐酸中溶质的质量分数。取大理石样品25g,逐渐缓慢向其中加入150g待测稀盐酸(杂质难溶于水,且不与酸反应),测得剩余固体的质量与加入稀盐酸的质量关系如图所示。请完成下列问题与计算:
 (1)、25g大理石样品中碳酸钙的质量为g。(2)、计算该稀盐酸中溶质的质量分数。(写出计算过程)(3)、用37%的盐酸配置150g上述溶质质量分数稀盐酸的实验步骤为计算、量取、和装瓶贴标签。(4)、当向上述25g大理石样品中加入150g稀盐酸充分反应后,所得溶液中的溶质是。
(1)、25g大理石样品中碳酸钙的质量为g。(2)、计算该稀盐酸中溶质的质量分数。(写出计算过程)(3)、用37%的盐酸配置150g上述溶质质量分数稀盐酸的实验步骤为计算、量取、和装瓶贴标签。(4)、当向上述25g大理石样品中加入150g稀盐酸充分反应后,所得溶液中的溶质是。
-
-
-