北京版化学九年级下册第八章 溶液 单元测试(基础卷)
试卷更新日期:2026-01-06 类型:单元试卷
一、选择题(每题3分,共45分)
-
1. 生活中难免会遇到各种污渍,下列过程中,有一个去污原理与其他三个不同的是A、用洗洁精洗去餐具上的油脂 B、用汽油除去衣服上的油污 C、用水冲洗杯子内壁的糖 D、用热水洗去附着在碗底部的食盐2. 如图所示,向小试管中分别加入下列一定量的物质,下侧形管中的液面左高右低,该物质是( )
 A、浓硫酸 B、氢氧化钠固体 C、硝酸铵固体 D、氧化钙固体3. 农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是( )
A、浓硫酸 B、氢氧化钠固体 C、硝酸铵固体 D、氧化钙固体3. 农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法错误的是( ) A、实验操作顺序为④②①⑤③ B、选用100mL量筒量取所需水的体积 C、需称量NaCl的质量为16.0g D、②中游码在6g处,则食盐实际质量为16g4. 生活中处处有化学,下列情境的解释,错误的是A、空气中的氖气可制作霓虹灯 B、二氧化硫是计入空气质量评价的主要污染物之一 C、家用煤气泄漏时扩散出来的CO是有刺激性气味的有毒气体 D、汽水等碳酸型饮料的生产过程中,用增大压强的方法使更多的CO2溶解到水中5. 在家务劳动中感悟化学原理。下列家务劳动涉及的化学知识正确的是
A、实验操作顺序为④②①⑤③ B、选用100mL量筒量取所需水的体积 C、需称量NaCl的质量为16.0g D、②中游码在6g处,则食盐实际质量为16g4. 生活中处处有化学,下列情境的解释,错误的是A、空气中的氖气可制作霓虹灯 B、二氧化硫是计入空气质量评价的主要污染物之一 C、家用煤气泄漏时扩散出来的CO是有刺激性气味的有毒气体 D、汽水等碳酸型饮料的生产过程中,用增大压强的方法使更多的CO2溶解到水中5. 在家务劳动中感悟化学原理。下列家务劳动涉及的化学知识正确的是选项
家务劳动
化学知识
A
用天然气作燃料生火做饭
天然气的成分是CO和H2
B
用洗洁精清洗餐具
洗洁精与油污发生中和反应
C
用食盐调节汤的咸淡
食盐和水的比例影响NaCl的浓度
D
用扇子扇煤炉火
提高煤的着火点
A、A B、B C、C D、D6. 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( ).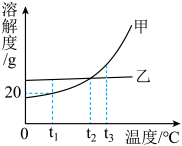 A、甲的溶解度比乙大 B、t2℃时,甲、乙的溶液中溶质的质量分数相等 C、t1℃时,将50g水加入15g甲物质中,可得到65g溶液 D、要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法7. 下列事实用化学观点解释正确的是A、修车师傅用汽油清洗手上油污——利用乳化原理 B、现代工业生产使用催化剂——催化剂能提高总产量 C、烧火时将木柴架空燃烧会更旺——增大氧气的浓度 D、氧气加压液化可以装入钢瓶中——加压后,分子间间隔变小8. 如图所示:能够使气球先膨胀,过一段时间又恢复到原状的一组固体和液体是(该装置气密性良好)
A、甲的溶解度比乙大 B、t2℃时,甲、乙的溶液中溶质的质量分数相等 C、t1℃时,将50g水加入15g甲物质中,可得到65g溶液 D、要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法7. 下列事实用化学观点解释正确的是A、修车师傅用汽油清洗手上油污——利用乳化原理 B、现代工业生产使用催化剂——催化剂能提高总产量 C、烧火时将木柴架空燃烧会更旺——增大氧气的浓度 D、氧气加压液化可以装入钢瓶中——加压后,分子间间隔变小8. 如图所示:能够使气球先膨胀,过一段时间又恢复到原状的一组固体和液体是(该装置气密性良好) A、固体:硝酸铵;液体:水 B、固体:氢氧化钠;液体:水 C、固体:二氧化锰;液体:双氧水 D、固体:氯化钠;液体:水9. 某同学用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,下列说法错误的是A、需要6%的氯化钠溶液的质量为25g B、实验中用到的玻璃仪器有量筒、细口瓶、玻璃棒、烧杯和胶头滴管 C、向烧杯内加入水时,有水洒出,会导致所配制溶液的质量分数偏大 D、量取6%的氯化钠溶液时仰视读数,会导致所配制的溶液溶质质量分数偏小10. 将200 g 10%的氯化钠溶液变成20%的溶液,需要蒸发掉水的质量为A、10g B、20g C、50g D、100g11. 学校某兴趣小组的同学,在实验室配制溶质质量分数为的氯化钠溶液来选种。下列有关说法正确的是
A、固体:硝酸铵;液体:水 B、固体:氢氧化钠;液体:水 C、固体:二氧化锰;液体:双氧水 D、固体:氯化钠;液体:水9. 某同学用6%的氯化钠溶液配制50g溶质质量分数为3%的氯化钠溶液,下列说法错误的是A、需要6%的氯化钠溶液的质量为25g B、实验中用到的玻璃仪器有量筒、细口瓶、玻璃棒、烧杯和胶头滴管 C、向烧杯内加入水时,有水洒出,会导致所配制溶液的质量分数偏大 D、量取6%的氯化钠溶液时仰视读数,会导致所配制的溶液溶质质量分数偏小10. 将200 g 10%的氯化钠溶液变成20%的溶液,需要蒸发掉水的质量为A、10g B、20g C、50g D、100g11. 学校某兴趣小组的同学,在实验室配制溶质质量分数为的氯化钠溶液来选种。下列有关说法正确的是 A、②中称量的为 , 若药品与砝码放反,溶质质量分数会偏大 B、④中量筒的规格是 , 若量取水时俯视读数,溶质质量分数会偏小 C、⑥的实验步骤是溶解,其中玻璃棒搅拌的目的是加快的溶解速率 D、用溶液选种时,干瘪、虫蛀的种子会沉底,饱满的种子会上浮12. 如图为MgCl2、KCl和MgSO4溶解度曲线。下列说法正确的是
A、②中称量的为 , 若药品与砝码放反,溶质质量分数会偏大 B、④中量筒的规格是 , 若量取水时俯视读数,溶质质量分数会偏小 C、⑥的实验步骤是溶解,其中玻璃棒搅拌的目的是加快的溶解速率 D、用溶液选种时,干瘪、虫蛀的种子会沉底,饱满的种子会上浮12. 如图为MgCl2、KCl和MgSO4溶解度曲线。下列说法正确的是 A、三种物质的溶解度都随温度升高而增大 B、三种物质的饱和溶液从80℃降温到20℃,都有晶体析出 C、只有在80℃时,KCl和MgSO4的溶解度才相等 D、80℃时,三种物质的溶液中,MgCl2溶液溶质质量分数最大13. “天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:
A、三种物质的溶解度都随温度升高而增大 B、三种物质的饱和溶液从80℃降温到20℃,都有晶体析出 C、只有在80℃时,KCl和MgSO4的溶解度才相等 D、80℃时,三种物质的溶液中,MgCl2溶液溶质质量分数最大13. “天气瓶”是一个瓶内晶体可发生变化的装饰品。“天气瓶”内的液体主要成分是:
①硝酸钾、氯化铵和水的混合溶液
②溶质质量分数为24 %的樟脑的酒精溶液
下列说法中,不正确的是
A、溶液中的溶质可以为多种 B、樟脑的酒精溶液中酒精是溶剂 C、溶质质量分数为24 %的含义是指每100 g的溶剂中,溶质是24 g D、“天气瓶”中晶体量变化的原因可能是物质的溶解度随温度改变而变化14. ℃时,将相同质量的和KCl分别加入盛有相等质量水的甲、乙烧杯中,充分搅拌后现象如图Ⅰ所示,图Ⅱ为两物质的溶解度曲线,以下说法不正确的是( ) A、乙烧杯中的溶质为 B、将温度升高到℃时,乙烧杯中没有固体剩余 C、若中混有少量KCl、可采用降温结晶的方法提纯 D、若℃时取相等质量的两溶液降温至℃时,析出晶体较多的是15. 硝酸钾的溶解度随温度升高而增大.如图是有关硝酸钾溶液的实验操作及变化情况.下列说法正确的是( ).
A、乙烧杯中的溶质为 B、将温度升高到℃时,乙烧杯中没有固体剩余 C、若中混有少量KCl、可采用降温结晶的方法提纯 D、若℃时取相等质量的两溶液降温至℃时,析出晶体较多的是15. 硝酸钾的溶解度随温度升高而增大.如图是有关硝酸钾溶液的实验操作及变化情况.下列说法正确的是( ). A、操作Ⅰ一定是降温 B、操作Ⅰ一定是加溶质 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等
A、操作Ⅰ一定是降温 B、操作Ⅰ一定是加溶质 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等二、填空题(共6分)
-
16. 天气瓶可用来预测天气变化,瓶内液体结晶的形态会随温度而发生改变。制作天气瓶需用到硝酸钾和氯化铵固体,下图是两种物质的溶解度曲线。
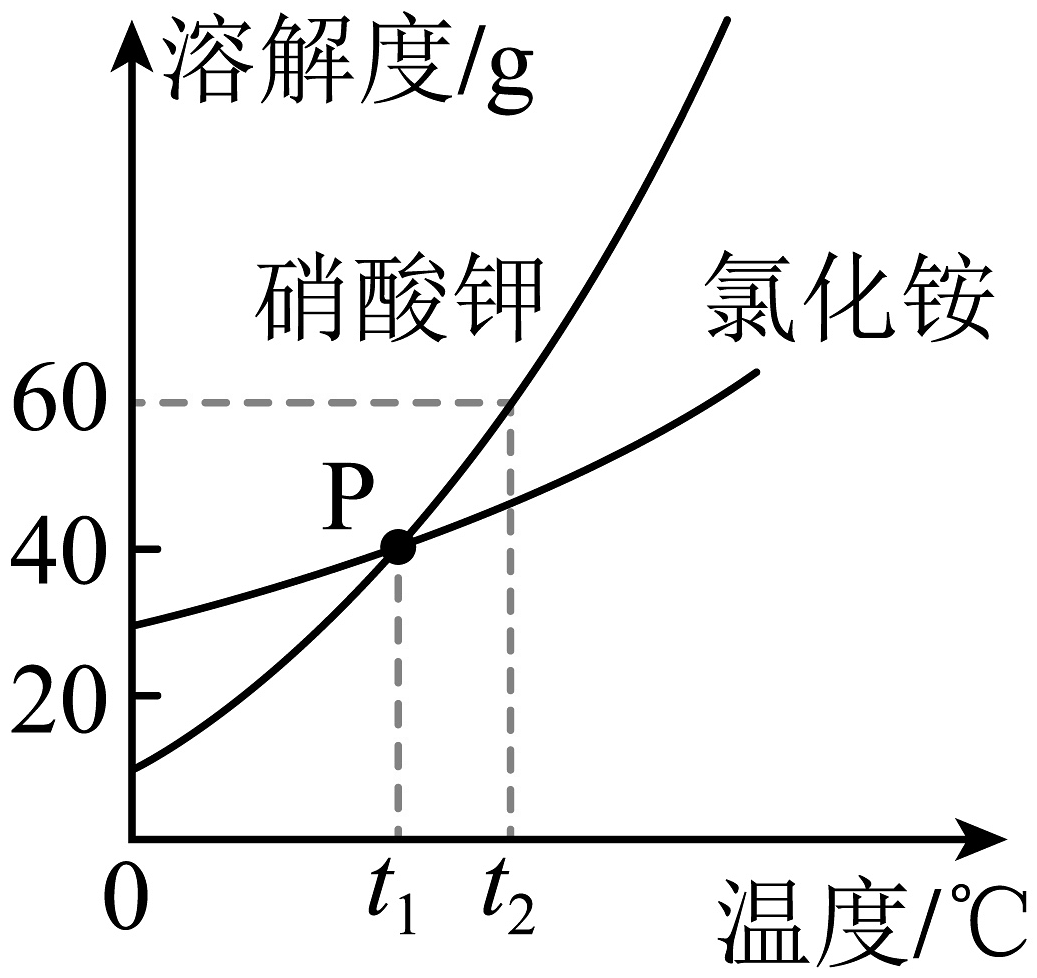 (1)、当温度小于________℃时,氯化铵的溶解度大于硝酸钾。(2)、时,50g硝酸钾加入到50g水中,充分溶解后所得溶液的质量为________g。(3)、时,分别将等质量的硝酸钾、氯化铵的饱和溶液升温到 , 硝酸钾溶液中溶质的质量________(填“大于”“等于”或“小于”)氯化铵溶液中溶质的质量。
(1)、当温度小于________℃时,氯化铵的溶解度大于硝酸钾。(2)、时,50g硝酸钾加入到50g水中,充分溶解后所得溶液的质量为________g。(3)、时,分别将等质量的硝酸钾、氯化铵的饱和溶液升温到 , 硝酸钾溶液中溶质的质量________(填“大于”“等于”或“小于”)氯化铵溶液中溶质的质量。三、推断题(共10分)
-
17. 废弃金属是重要的可再生资源。从废旧电器的某些部件中可以回收铜和银,其操作流程如图所示。按要求填空。
 (1)、在预处理的产品中,四种金属里最活泼的金属是。(2)、步骤I中溶液A呈色。(3)、步骤Ⅱ中发生反应的化学方程式是。(4)、步骤Ⅲ中反应结束后溶液C的质量溶液B(填“大于”“小于”或“等于”)。(5)、设计步骤IV的目的是。
(1)、在预处理的产品中,四种金属里最活泼的金属是。(2)、步骤I中溶液A呈色。(3)、步骤Ⅱ中发生反应的化学方程式是。(4)、步骤Ⅲ中反应结束后溶液C的质量溶液B(填“大于”“小于”或“等于”)。(5)、设计步骤IV的目的是。四、流程题(共8分)
-
18. 氢氧化钠是重要的化工原料,在生产过程中常含少量的杂质氯化钠。提纯NaOH样品。某同学进行如图实验:

氯化钠和氢氧化钠的部分溶解度数据如表:
温度(℃)
0
20
60
80
NaCl
35.7
36.0
37.1
38.4
NaOH
42
109
174
314
(1)、20℃时,5g水中最多溶解NaClg。(2)、滤液B中含NaOH的质量g。溶液A中,NaOH(填达到”或“未达到”)饱和状态。(3)、运用数据分析说明:不能省略步骤III,因为若不蒸发95g水,则20℃时,会比前方案少析出g氢氧化钠。五、实验探究题(共16分)
-
19. 实验室里,配制100g溶质的质量分数为10%的KMnO4溶液。回答下列问题:(1)、配制该溶液时,需称取KMnO4。(2)、配制溶液的过程中,下列仪器中不需要的是(填写仪器名称)。
 (3)、按下列实验步骤进行:①计算;②称量;③量取;④(填写步骤名称);⑤装瓶贴签。(4)、该同学用100mL量筒量取实验所用的蒸馏水,读数视线如图所示,量筒中水的实际体积为mL;若其他操作均正确,该同学所配KMnO4溶液中溶质的质量分数(填“>”、“<”或“=”)10%。(水的密度为1g/cm3)
(3)、按下列实验步骤进行:①计算;②称量;③量取;④(填写步骤名称);⑤装瓶贴签。(4)、该同学用100mL量筒量取实验所用的蒸馏水,读数视线如图所示,量筒中水的实际体积为mL;若其他操作均正确,该同学所配KMnO4溶液中溶质的质量分数(填“>”、“<”或“=”)10%。(水的密度为1g/cm3) (5)、若将20g溶质的质量分数为5%的KMnO4溶液,加热蒸干所得固体的质量小于1g,原因可能是(用化学方程式解释)。
(5)、若将20g溶质的质量分数为5%的KMnO4溶液,加热蒸干所得固体的质量小于1g,原因可能是(用化学方程式解释)。六、计算题(共15分)
-
20. 硫代硫酸钠(Na2S2O3)为氰化物的解毒剂之一,在酶的参与下能使氰化物变为无毒的硫氰酸盐排出体外而解毒。某硫代硫酸钠的样品中混有少量硫酸钠,现取18g该样品,加入适量稀硫酸,发生反应的化学方程式为:。充分反应后,得到只含有一种溶质的不饱和溶液,其溶质质量分数为10%,同时生成6.4gSO2。计算:(1)、所得溶液中溶质的质量;(2)、所用稀硫酸的溶质质量分数(计算结果精确到 0.1%);(3)、若要将得到的10%溶液稀释成质量分数为5%的溶液,加水的质量为g。
-
-
-
-