浙教版科学 七年级下册 第二章 物质的微观结构 单元检测卷(提高)
试卷更新日期:2026-01-04 类型:单元试卷
一、选择题(每小题3分,共45分)
-
1. 模型是人们为了某种特定的目的,对认识对象(系统)所做的一种简化的概括性的描述或模拟。下列不属于模型建构的是( )A、
 画校园平面图
B、
画校园平面图
B、 做小型地球仪
C、
做小型地球仪
C、 搭细胞结构
D、
搭细胞结构
D、 看蜡烛熄灭顺序
2. 天宫课堂中,航天员王亚平用视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验,锆原子核外电子数为40,中子数为51,相对原子质量为91,元素符号为 Zr。模仿图甲,将该元素对应信息编写到图乙中相应位置,则“①”处应填( )
看蜡烛熄灭顺序
2. 天宫课堂中,航天员王亚平用视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验,锆原子核外电子数为40,中子数为51,相对原子质量为91,元素符号为 Zr。模仿图甲,将该元素对应信息编写到图乙中相应位置,则“①”处应填( ) A、40 B、51 C、91 D、锆3. 已知钠离子带一个单位正电荷,其结构示意图如图所示。下列说法正确的是( )
A、40 B、51 C、91 D、锆3. 已知钠离子带一个单位正电荷,其结构示意图如图所示。下列说法正确的是( ) A、图中a的值为9 B、钠离子符号为Na+ C、钠离子是钠原子得到一个电子形成的 D、氧化钠的化学式为NaO4. 我国已启动“嫦娥工程”探月计划,该计划的一个重要目标是开发月球新能源“氦-3”。已知“氦-3”原子的原子核内有1个中子、2个质子。若以“◯”代表电子、“ ”代表质子、“●”代表中子,则下列各微粒结构模型图中,能表示“氦-3”原子结构的是( )A、
A、图中a的值为9 B、钠离子符号为Na+ C、钠离子是钠原子得到一个电子形成的 D、氧化钠的化学式为NaO4. 我国已启动“嫦娥工程”探月计划,该计划的一个重要目标是开发月球新能源“氦-3”。已知“氦-3”原子的原子核内有1个中子、2个质子。若以“◯”代表电子、“ ”代表质子、“●”代表中子,则下列各微粒结构模型图中,能表示“氦-3”原子结构的是( )A、 B、
B、 C、
C、 D、
D、 5. 研究发现,苍蝇体内能够产生抗细菌感染的过氧化氢 下列关于过氧化氢(H2O2) 和水(H2O) 的叙述正确的是()A、是同种物质 B、具有相同的化学性质 C、都是由氢元素和氧元素组成的 D、都是由氢分子和氧分子构成的6. 科学上用符号“”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 和 的核外电子数相等。则下列关系正确的是 ( )A、b-a=d-c B、 C、 D、7. 美国《Science》杂志曾报道,有人合成和分离出含有高能量阳离子 N5+的化合物N5AsF6 , 下列叙述错误的是( )A、原子团 AsF6的化合价为-1 B、N5+得到一个电子后可变成单质 C、已知F为-1价, 则 As为+5价 D、Ns+的性质很稳定,不易和其他物质发生化学反应8. 原子结构模型的建立是经过一代代科学家不断地发现和提出新的原子结构模型的过程。下列有关图①②③所示的三种原子结构模型的叙述不正确的是
5. 研究发现,苍蝇体内能够产生抗细菌感染的过氧化氢 下列关于过氧化氢(H2O2) 和水(H2O) 的叙述正确的是()A、是同种物质 B、具有相同的化学性质 C、都是由氢元素和氧元素组成的 D、都是由氢分子和氧分子构成的6. 科学上用符号“”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知 和 的核外电子数相等。则下列关系正确的是 ( )A、b-a=d-c B、 C、 D、7. 美国《Science》杂志曾报道,有人合成和分离出含有高能量阳离子 N5+的化合物N5AsF6 , 下列叙述错误的是( )A、原子团 AsF6的化合价为-1 B、N5+得到一个电子后可变成单质 C、已知F为-1价, 则 As为+5价 D、Ns+的性质很稳定,不易和其他物质发生化学反应8. 原子结构模型的建立是经过一代代科学家不断地发现和提出新的原子结构模型的过程。下列有关图①②③所示的三种原子结构模型的叙述不正确的是 A、汤姆生认为图①模型中正电荷均匀分布在整个面包内,电子像葡萄干镶嵌其中 B、图②模型道尔顿认为原子是一个不可再分的实心球,原子是构成物质的最小微粒 C、卢瑟福在实验基础上提出带负电的电子绕带正电且体积很小的原子核运动的图③模型 D、三种模型按提出的时间先后,正确的排列顺序为①②③9. 如图表示四种原子的结构模型,下列说法正确的是( )
A、汤姆生认为图①模型中正电荷均匀分布在整个面包内,电子像葡萄干镶嵌其中 B、图②模型道尔顿认为原子是一个不可再分的实心球,原子是构成物质的最小微粒 C、卢瑟福在实验基础上提出带负电的电子绕带正电且体积很小的原子核运动的图③模型 D、三种模型按提出的时间先后,正确的排列顺序为①②③9. 如图表示四种原子的结构模型,下列说法正确的是( ) A、甲、丙的核电荷数不同 B、乙、丁不属于同一种元素 C、甲、丁相对原子质量相同 D、甲、乙互为同位素原子10. 钯是航天、航海等高科技领域的关键材料。钯的相对原子质量为106,核外电子数46,则其质子数为( )A、46 B、60 C、106 D、15211. 下图是元素周期表的一部分,其排列有一定的规律,甲、乙、丙、丁四种元素中与碳元素化学性质相似的是( )
A、甲、丙的核电荷数不同 B、乙、丁不属于同一种元素 C、甲、丁相对原子质量相同 D、甲、乙互为同位素原子10. 钯是航天、航海等高科技领域的关键材料。钯的相对原子质量为106,核外电子数46,则其质子数为( )A、46 B、60 C、106 D、15211. 下图是元素周期表的一部分,其排列有一定的规律,甲、乙、丙、丁四种元素中与碳元素化学性质相似的是( ) A、甲 B、乙 C、丙 D、丁12. 小科他利用凹角和凸角的模型作为教具,如图所示。甲、乙模型分别NaCl、MgCl2的形成,下列物质可以用丙模型表示的是()
A、甲 B、乙 C、丙 D、丁12. 小科他利用凹角和凸角的模型作为教具,如图所示。甲、乙模型分别NaCl、MgCl2的形成,下列物质可以用丙模型表示的是() A、CO2 B、Mg3N2 C、Al2O3 D、CaCO313. 已知一个NO2分子的质量为 m 千克,一个N2O5分子的质量为 n 千克(假设NO2、N2O5分子中氮原子和氧原子分别具有相同的中子数),若以一个氮原子质量的 作为标准,则计算出的N2O5相对分子质量(用m、n表示)为( )A、 B、 C、 D、14. 以下为三种不同原子(如下表所示),则下列说法正确的是( )
A、CO2 B、Mg3N2 C、Al2O3 D、CaCO313. 已知一个NO2分子的质量为 m 千克,一个N2O5分子的质量为 n 千克(假设NO2、N2O5分子中氮原子和氧原子分别具有相同的中子数),若以一个氮原子质量的 作为标准,则计算出的N2O5相对分子质量(用m、n表示)为( )A、 B、 C、 D、14. 以下为三种不同原子(如下表所示),则下列说法正确的是( )A原子
B原子
C原子
质子数
6个
6个
7个
中子数
6个
8个
7个
A、A和B是同一种元素 B、A和B的核电荷数不同 C、B和C核外电子数相等 D、B和C互为同位素15. 1个¹2C原子(含6个质子、6个中子)的质量为 akg、1个¹8O原子(含8个质子, 10个中子)的质量为 bkg,则下列有关说法错误的是( )A、¹8O的相对原子质量为 B、¹2C与¹8O的相对原子质量之比为2∶3 C、18g ¹8O中质子的质量约为9g D、1个由¹2C和¹8O组成的CO2分子含22个电子、26个中子二、填空题(共7题,共42分)
-
16. 用元素符号或化学式填空:(1)、3个钠离子;(2)、2个铝原子;(3)、4个二氧化硫分子;(4)、四氧化三铁。17. 氨气(NH3)是一种无色、有强烈刺激性气味的气体,常用于制氨水、硝酸、氮肥等。氨气的合成过程如图所示。
 (1)、合成氨气的原料是氮气和(填化学式);(2)、氨气(NH3)中氮元素的化合价是价;(3)、1个氨气分子是由构成的。18. 下表是元素周期表的一部分,请回答下列问题:
(1)、合成氨气的原料是氮气和(填化学式);(2)、氨气(NH3)中氮元素的化合价是价;(3)、1个氨气分子是由构成的。18. 下表是元素周期表的一部分,请回答下列问题:
H
He
Be
N
①
Ne
②
Si
③
Ar
(1)、如右图所示,为三种原子A、B、C的原子核,则它们是否属于同位素(选填“是”或“不是”)。请指出A 原子代表的元素在元素周期表中的位置(选填“①”、“②”或“③”)。(2)、Si是一种元素(选填“金属”或“非金属”)。写出表中②和③两种元素组成的化合物的化学式。19. 原子的核外电子排布规律是元素周期表中元素排列的主要依据。
根据以上微粒核外电子排布结构示意图回答下列问题:
(1)、E元素位于元素周期表第周期。(2)、上图中,一共涉及种元素。(3)、C微粒的符号为。20. 研究物质既要从宏观层面分析现象,又要从微观层面探析本质。请据图回答下列问题: (1)、宏观角度辨识水的组成:在电解水实验中,两个电极上都会产生气泡。如图甲所示,正、负极产生气体的体积比约为 , 经验证正极产生的气体是氧气,负极产生的气体为氢气。此实验可证明水是由组成的。(2)、微观角度探析水的分解:由图乙中水分子的示意图可知,1个水分子由构成。21. 2024年10月,中国科学院化学研究所李永舫院士等团队研发出光电转化率高的钙钛矿-有机叠层太阳能电池。
(1)、宏观角度辨识水的组成:在电解水实验中,两个电极上都会产生气泡。如图甲所示,正、负极产生气体的体积比约为 , 经验证正极产生的气体是氧气,负极产生的气体为氢气。此实验可证明水是由组成的。(2)、微观角度探析水的分解:由图乙中水分子的示意图可知,1个水分子由构成。21. 2024年10月,中国科学院化学研究所李永舫院士等团队研发出光电转化率高的钙钛矿-有机叠层太阳能电池。 (1)、钙钛矿的主要成分是CaTiO3其中钛元素的化合价为 。(2)、图为简易的元素周期表,则钛元素大概位于 (填“A”或“B”) 区域。(3)、钛-46,钛-47,钛-48是三种不同的原子,在元素周期表中( )。A、只有钛-46占位置 B、占三个不同的位置 C、同占一个位置22. 由元素R和氢元素、氧元素所组成的化合物为H3RO4 , 则R的化合价为;如果这化合物的相对分子质量为98,则R 的相对原子质量为。
(1)、钙钛矿的主要成分是CaTiO3其中钛元素的化合价为 。(2)、图为简易的元素周期表,则钛元素大概位于 (填“A”或“B”) 区域。(3)、钛-46,钛-47,钛-48是三种不同的原子,在元素周期表中( )。A、只有钛-46占位置 B、占三个不同的位置 C、同占一个位置22. 由元素R和氢元素、氧元素所组成的化合物为H3RO4 , 则R的化合价为;如果这化合物的相对分子质量为98,则R 的相对原子质量为。三、实验与探究题(共5题,共38分)
-
23. 人类的日常生活和工农业生产离不开水。为探究水的组成及变化,某小组同学设计下图装置进行电解水实验,先在电解器玻璃管里加满水(含少童氢氧化钠),再接通直流电源。已知:水中加入的氢氧化钠只起增强导电性作用,本身不参与反应。回答下列问题:
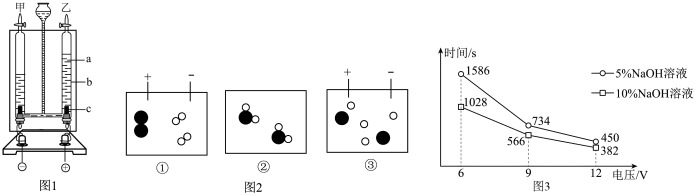 (1)、图1中,电解时乙玻璃管中产生气泡的位置在(填“a” “b”或“c”)处,将带火星的木条放置在乙玻璃管口,打开气体活塞,能看到的实验现象是。(2)、请给如图2所示水电解过程中的微粒运动变化排序。(填序号)(3)、电解纯水速率较慢,为探究不同电压和不同浓度氢氧化钠溶液对电解水速率的影响,小组同学进行多次实验,测得产生20mL 氢气所需时间如上图:
(1)、图1中,电解时乙玻璃管中产生气泡的位置在(填“a” “b”或“c”)处,将带火星的木条放置在乙玻璃管口,打开气体活塞,能看到的实验现象是。(2)、请给如图2所示水电解过程中的微粒运动变化排序。(填序号)(3)、电解纯水速率较慢,为探究不同电压和不同浓度氢氧化钠溶液对电解水速率的影响,小组同学进行多次实验,测得产生20mL 氢气所需时间如上图:①电解浓度为 5%的氢氧化钠溶液时,电压越大,电解水速率越(填“快”或“慢”)。
②上述实验中,电解水速率最快的条件是。
a.5%氢氧化钠溶液, 电压为12V b.5%氢氧化钠溶液, 电压为6V
c.10%氢氧化钠溶液, 电压为12V d.10%氢氧化钠溶液, 电压为6V
24. 科学家对相对原子质量的认识经历了漫长的时间。材料一:19世纪初,有化学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。化学家测定出的元素相对原子质量是其不同原子相对原子质量的平均值。
材料三:1961年8月,国际上采用碳-12原子的1/12作为相对原子质量的标准,确定各个同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素中所占的百分比之和。
(1)、下列元素的相对原子质量不支持材料一的是____。A、O-16 B、Cl-35.5 C、Ag-108(2)、在克鲁克斯假设中,同种元素的原子,相对原子质量却不同,是因为原子结构中的某种微粒数量不同,该微粒的名称是。(3)、根据材料三,现发现氖的同位素在自然界中分布如图,根据上述资料,列出氖元素的相对原子质量的计算式子:。 (4)、结合以上材料及所学知识,判断下列说法正确的是____。A、19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值 B、只要方法正确、仪器精确,实验结果就不会存在误差 C、若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准 D、元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子25. 为了了解原子结构的奥秘,人类经历了漫长的探索过程。英国科学家卢瑟福为原子结构模型的建立作出了巨大贡献,他于1911年进行了著名的α粒子轰击金箔实验。
(4)、结合以上材料及所学知识,判断下列说法正确的是____。A、19世纪初,以氢为母体的相对原子质量标准是错误的,它对科学的发展没有价值 B、只要方法正确、仪器精确,实验结果就不会存在误差 C、若干年后,科学家有可能更改现在国际上采用的相对原子质量的标准 D、元素周期表中很多元素的相对原子质量都不是整数,可推测很多元素有多种同位素原子25. 为了了解原子结构的奥秘,人类经历了漫长的探索过程。英国科学家卢瑟福为原子结构模型的建立作出了巨大贡献,他于1911年进行了著名的α粒子轰击金箔实验。

【实验装置】如图甲所示,①α粒子源————放射性物质放出α粒子束(带正电荷),质量是电子质量的7000倍;②金箔————作靶子,厚度1μm;③荧光屏————α粒子打在上面,显微镜上发出闪光。
【实验现象】如图乙所示,绝大多数α粒子穿过金箔后仍沿原来的方向前进,有少数α粒子却发生了偏转,有极少数α粒子发生较大的偏转。
【分析解释】
(1)、根据实验现象,不能获得的结论是____。A、原子核体积很小 B、原子核质量较大 C、原子核带正电荷 D、核外电子带负电荷(2)、卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”,文中“很小的结构”指的是。(3)、1932年,查德威克用α粒子(内含2个质子)轰击铍原子核(内含4个质子),微观示意图如图丙所示,生成的微粒C是原子的原子核(填写名称)。26. 为破解原子内部结构的奥秘,一代又一代科学家进行了不懈地探索。史料一:1897年,英国科学家汤姆生通过实验发现了带负电的电子,并推测原子中还有带正电的粒子。
史料二:1909年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,发现如下现象,从而建立了原子核式结构模型。
①绝大多数α粒子能穿透金箔而不改变原来的运动方向;
②有小部分α粒子改变了原来的运动方向;
③有极少部分α粒子被弹了回来。
史料三:1913 年,丹麦科学家玻尔改进了卢瑟福的原子核式结构模型,认为电子只能在原子内的一些特定的稳定轨道上运动。
(1)、史料一中汤姆生推测原子中还有带正电的粒子,他的推测依据是。(2)、根据α粒子散射实验,统计不同偏转角度的α粒子数量,绘制图像如图所示,其中下列符合实验现象的图像是____。A、 B、
B、 C、
C、 D、
D、 (3)、从原子结构模型的建立过程中,我们发现____(可多选)。A、卢瑟福的原子核式结构模型推翻了汤姆生对原子内部结构的所有观点 B、汤姆生、卢瑟福等科学家都是在实验的基础上,通过推理和想象建构原子模型 C、建立模型往往需要有一个不断究善、不断修正的过程,以使模型更接近事物的本质 D、玻尔改进了卢瑟福的原子结构模型,使人们对原子结构的认识达到了完美的境界(4)、随着技术的发展,人们对原子的结构的认识逐渐深入,如图甲是现代氢原子的结构模型图,请你依据氢原子的结构模型(甲图),在图乙的方框内绘制锂-7原子的原子核结构模型图。。(用“
(3)、从原子结构模型的建立过程中,我们发现____(可多选)。A、卢瑟福的原子核式结构模型推翻了汤姆生对原子内部结构的所有观点 B、汤姆生、卢瑟福等科学家都是在实验的基础上,通过推理和想象建构原子模型 C、建立模型往往需要有一个不断究善、不断修正的过程,以使模型更接近事物的本质 D、玻尔改进了卢瑟福的原子结构模型,使人们对原子结构的认识达到了完美的境界(4)、随着技术的发展,人们对原子的结构的认识逐渐深入,如图甲是现代氢原子的结构模型图,请你依据氢原子的结构模型(甲图),在图乙的方框内绘制锂-7原子的原子核结构模型图。。(用“ ”表示中子)
”表示中子) 27. 为破解原子内部结构的奥秘,一代又一代科学家进行了不懈地探索。
27. 为破解原子内部结构的奥秘,一代又一代科学家进行了不懈地探索。材料一:1897年,汤姆生通过实验发现原子中有带负电的微粒,推测原子中还有带正电的物质,从而建立了西瓜模型。
材料二:1911年,卢瑟福进行了著名的α粒子轰击金箔实验,发现如下现象:①绝大多数a粒子能穿透金箔而不改变原来的运动方向;②有小部分α粒子改变了原来的运动方向;⑧有极少部分α粒子被弹了回来。根据现象,卢瑟福建立了原子核式结构模型。
材料三:卢瑟福的学生莫塞莱注意到,原子核所带电荷数与质子数相等,但原子核质量却远大于质子总质量。
(1)、汤姆生建立西瓜模型时,推测原子中必须存在带正电的物质,其依据的科学原理是。(2)、莫塞莱所发现的“原子核所带电荷数与质子数相等,但原子核质量却远大于质子总质量”其本质原因是。(3)、在认识原子结构模型的基础上,为强化同学们对分子结构模型的理解,老师布置了制作甲烷分子模型的实践性活动,并为此次活动设计了相应的评价量表:“甲烷分子结构模型制作”评价量表 评价指标 优秀 合格 待改进 指标一 两种颜色,原子大小比例合理 两种颜色,原子大小比例不合理 同种颜色,原子大小比例失调 指标二 形态规整、能较好体现分子的正四面体结构 ▲ 形态扭曲与实际不符 
小科和小红同学用超轻黏土制作甲烷分子模型(如图所示),参照评价量表。组长把小科作品的“指标一”和“指标二”都评定为“优秀”,而小红的“指标一”为优秀“指标二”评定为“合格”。请你完善指标二的评价量表:。四、综合题(共5题,共35分)
-
28. 从微观层面认识物质是化学独特的视角。许多物质是由分子初晚的,分子又由原子构成。原子虽然眼小,但本身也存在质量。如图是水分子的揯观模型图,表中是几种原子的质量,请根据要求回答下列问题:

原子种类
1个原子的质量/kg
相对原子质量
氢
1
氧
16
碳-12
12
(1)、 1个水分子的质量是多少? (在横线上列出算式) =2.9918×10-26kg(2)、由上述计算可知分子根小,书写、记忆和使用都很不方便。为此可采用类似“原子”的处理方法。即以碳-12原子质量的 作为标准,用分子的质量跟它的比值,得到分子的相对质量。请用该思路求H2O的相对分子质量。 (请列式计算,计算结果保留整数)29. 余姚梁弄果农种植蓝莓取得了很好的经济效益,每年5、6月是蓝莓丰收的时节,蓝莓中含有丰富的花青素(化学式为C15H11O6)。花青素是一种水溶性色素,颜色与细胞液的酸碱性有关,细胞液酸性时呈红色,碱性时呈蓝色。(1)、花青素分子中碳、氢、氧原子个数比为。(2)、花青素分子的相对分子质量是多少?(3)、28.7克花青素中含有几克碳元素?30. 元素周期表是学习和研究科学的重要工具,经历了100多年的不断发展和完善,如图是元素周期表的一段发展史。(1)、表一是元素周期表的一部分,迈耶尔和门捷列夫都提到了这部分,只是门捷列夫更为完善,F元素的化合价与表中(写元素名称)相似。(2)、表二是八音律表的一部分,表中“G”可能是现行元素周期表中相对应的(写元素符号),按照纽兰兹的理论,请找出与G元素性质相似的元素,它与氧元素形成化合物的化学式。 (3)、分析上述科学史料,下列观点正确的有(可多选)。
(3)、分析上述科学史料,下列观点正确的有(可多选)。A.研究复杂的现象往往需要寻找规律
B.科学家在研究元素周期规律时,不需要借助任何技术
C.如果当时门捷列夫没有发现元素周期表,以后就不会再有人发现了
D.随着科学的进步,新的元素陆续会被发现
E.纽兰兹的八音律理论中没有稀有气体元素,说明他的理论完全错误
31. 相对原子质量(即原子量)是原子实际质量与基准相比后得出的比值。基准的确定历经几代科学家的研究,下列是其历程的部分资料: (1)、若氢原子质量为a,氧原子质量为b,以道尔顿的原子量基准,氧原子的相对原子质量为.(2)、结合资料三,请推测斯达的原子量基准后来被取代的原因是.(3)、现代科学将一个原子的真实质量与一个C-12原子质量的 做比较,即可得到该原子的相对原子质量。下列利用的科学方法相似的是____。A、用温度计液柱高度变化反映物体温度变化 B、水和酒精混合之后总体积减小,说明分子间存在空隙 C、研究木星体积时,若地球体积被定为1,则木星体积为1321 D、研究植物生长与光照的关系时,控制水分、温度等条件不变32. 人们对原子内部结构的认识经历了漫长而曲折的过程,原子结构模型的建立同样是一代又一代科学家不断修正和完善的结果。卢瑟福用α粒子轰击金箔,并根据实验现象提出了原子核式模型。科学小组用模拟实验来理解卢瑟福的实验过程。
(1)、若氢原子质量为a,氧原子质量为b,以道尔顿的原子量基准,氧原子的相对原子质量为.(2)、结合资料三,请推测斯达的原子量基准后来被取代的原因是.(3)、现代科学将一个原子的真实质量与一个C-12原子质量的 做比较,即可得到该原子的相对原子质量。下列利用的科学方法相似的是____。A、用温度计液柱高度变化反映物体温度变化 B、水和酒精混合之后总体积减小,说明分子间存在空隙 C、研究木星体积时,若地球体积被定为1,则木星体积为1321 D、研究植物生长与光照的关系时,控制水分、温度等条件不变32. 人们对原子内部结构的认识经历了漫长而曲折的过程,原子结构模型的建立同样是一代又一代科学家不断修正和完善的结果。卢瑟福用α粒子轰击金箔,并根据实验现象提出了原子核式模型。科学小组用模拟实验来理解卢瑟福的实验过程。用废弃的粉笔头模拟α粒子,用栓有小球的纸箱模拟金箔(如图甲所示),纸箱的框为40cm×40cm,小科站在纸箱正方前方,朝着框内随机投掷100个粉笔头,记录击中小球的次数,通过“各小球的横截面之和=纸箱框内面积×击中率”,推算小球的半径r。
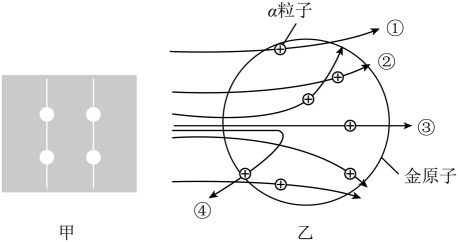 (1)、如图乙所示,是根据卢瑟福的α粒子轰击金箔实验现象绘制出的示意图,其中轨迹(填序号)绘制错误。(2)、α粒子是氦原子的原子核,由2个质子和2个中子构成,则α粒子所带的电荷情况为。(3)、模拟被反弹的α粒子的比例推算小球大小,理解原子核体积占不小,小科共投掷出多个粉笔头,击中率为10%。请推算出每个小球的半径r为cm。(请用带π的式子表示,圆的面积公式为πr2)(4)、部分大质量恒心经历超新星爆炸时,恒星原子中的所有电子会被压缩到原子核中,与质子结合后形成中子,恒星演变成密度为10亿吨/厘米3左右的中子星,请结合卢瑟福原子模型和密度公式,解释中子星密度超大的原因。
(1)、如图乙所示,是根据卢瑟福的α粒子轰击金箔实验现象绘制出的示意图,其中轨迹(填序号)绘制错误。(2)、α粒子是氦原子的原子核,由2个质子和2个中子构成,则α粒子所带的电荷情况为。(3)、模拟被反弹的α粒子的比例推算小球大小,理解原子核体积占不小,小科共投掷出多个粉笔头,击中率为10%。请推算出每个小球的半径r为cm。(请用带π的式子表示,圆的面积公式为πr2)(4)、部分大质量恒心经历超新星爆炸时,恒星原子中的所有电子会被压缩到原子核中,与质子结合后形成中子,恒星演变成密度为10亿吨/厘米3左右的中子星,请结合卢瑟福原子模型和密度公式,解释中子星密度超大的原因。