浙教版科学 七年级下册 第二章 物质的微观结构 单元检测卷(基础)
试卷更新日期:2026-01-04 类型:单元试卷
一、选择题(每小题3分,共45分)
-
1. 模型可以帮助人们认识和理解一些不能直接观察到的事物,下列不属于模型的是A、地球仪
 B、细胞结构图
B、细胞结构图 C、电流表
C、电流表 D、甲烷结构图
D、甲烷结构图 2. 世界是由元素组成的,图中能正确表示地壳中元素含量分布的是( )A、
2. 世界是由元素组成的,图中能正确表示地壳中元素含量分布的是( )A、 B、
B、 C、
C、 D、
D、 3. 某同学制作的试剂标签如下,其中化学式书写正确的是A、
3. 某同学制作的试剂标签如下,其中化学式书写正确的是A、 B、
B、 C、
C、 D、
D、 4. 臭氧(O3)、二氧化氯(ClO2)、过氧化氢(H2O2)都是生产、生活中最常用的消毒剂.三种物质中都含有( )A、氧分子 B、氧离子 C、氧气 D、氧元素5. 如图是元素周期表中铀元素的信息。下列有关说法中不正确的是( )
4. 臭氧(O3)、二氧化氯(ClO2)、过氧化氢(H2O2)都是生产、生活中最常用的消毒剂.三种物质中都含有( )A、氧分子 B、氧离子 C、氧气 D、氧元素5. 如图是元素周期表中铀元素的信息。下列有关说法中不正确的是( ) A、铀的原子序数是92 B、铀的元素符号为U C、铀原子的中子数为92 D、铀的相对原子质量为2386. 如图是水的微观层次结构,图中“◯”表示 ( )
A、铀的原子序数是92 B、铀的元素符号为U C、铀原子的中子数为92 D、铀的相对原子质量为2386. 如图是水的微观层次结构,图中“◯”表示 ( )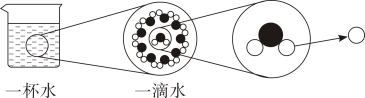 A、氧分子 B、氧原子 C、氢分子 D、氢原子7. 分析图所示测定相对原子质量的示意图,则A原子的相对原子质量约为( )
A、氧分子 B、氧原子 C、氢分子 D、氢原子7. 分析图所示测定相对原子质量的示意图,则A原子的相对原子质量约为( ) A、5 B、10 C、12 D、168. 某团队研究证明了PtO42+离子能够稳定存在(Pt是铂的元素符号),已知该离子中氧元素显-2价,则该离子中铂元素的化合价为 ( )A、+10 B、+8 C、+4 D、+29. 探月卫星“嫦娥一号”主要任务之一是探明月球上氦-3的储量。下图是氦-3原子结构示意图,以下说法错误的是 ( )
A、5 B、10 C、12 D、168. 某团队研究证明了PtO42+离子能够稳定存在(Pt是铂的元素符号),已知该离子中氧元素显-2价,则该离子中铂元素的化合价为 ( )A、+10 B、+8 C、+4 D、+29. 探月卫星“嫦娥一号”主要任务之一是探明月球上氦-3的储量。下图是氦-3原子结构示意图,以下说法错误的是 ( ) A、原子核内质子数等于核外电子数 B、氦-3原子由原子核和核外电子构成 C、氦-3原子核内有2个质子 D、质子和中子是不可再分的粒子10. 1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据这个实验获得的正确结论是( )
A、原子核内质子数等于核外电子数 B、氦-3原子由原子核和核外电子构成 C、氦-3原子核内有2个质子 D、质子和中子是不可再分的粒子10. 1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验,根据这个实验获得的正确结论是( ) A、金原子核带正电荷 B、金原子是实心球体,紧密排列 C、金原子中有带负电的电子 D、金原子核的质量与α粒子质量相当11. 如图是电解水实验的改进装置,有关说法正确的是 ( )
A、金原子核带正电荷 B、金原子是实心球体,紧密排列 C、金原子中有带负电的电子 D、金原子核的质量与α粒子质量相当11. 如图是电解水实验的改进装置,有关说法正确的是 ( )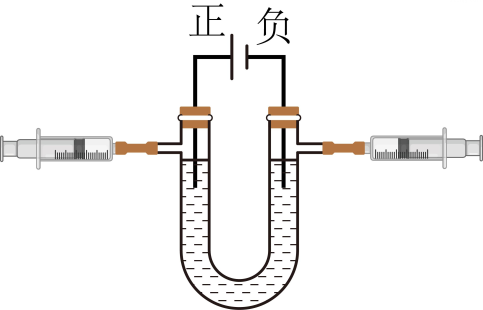 A、该实验能证明水由氢和氧元素组成 B、左侧注射器收集到的气体能燃烧 C、左右两侧注射器收集到气体体积比为2:1 D、右侧注射器收集到的气体能使带火星的木条复燃12. 日本核废水排放之后,许多检测机构在核废水中检测到了一种物质“重水”,一个重水分子由两个氘原子和一个氧原子构成,其中一个氘原子中含有一个中子和一个质子,根据以上信息判断下列说法中正确的是 ( )A、重水的相对分子质量是18 B、一个氘原子外有两个核外电子 C、氘原子和气原子质子数相同,属于同位素 D、氘原子和气原子在元素周期表中位于不同位置13. 下列关于构成物质的微粒说法正确的是( )A、目前发现的微粒只有分子、原子、离子三种 B、分子由原子构成,因此原子一定比分子小 C、Cl和Cl-属于同种元素,但化学性质不同 D、构成O2 、CO2 两种物质的微粒中都含有氧分子14. 2025年“3·15晚会”曝光部分企业在加工水产品时违规、超量添加磷酸盐保水剂。长期过量摄入磷酸盐可能会导致人体钙磷比失衡,引发心血管疾病。这里的“钙、磷”是指()A、单质 B、元素 C、离子 D、原子15. 已知一个CO的分子的质量为 nkg,一个CO2分子的质量为 mkg,若以碳原子的1/12质量作为相对原子质量的标准,则CO2的相对分子质量为( )A、 B、 C、 D、
A、该实验能证明水由氢和氧元素组成 B、左侧注射器收集到的气体能燃烧 C、左右两侧注射器收集到气体体积比为2:1 D、右侧注射器收集到的气体能使带火星的木条复燃12. 日本核废水排放之后,许多检测机构在核废水中检测到了一种物质“重水”,一个重水分子由两个氘原子和一个氧原子构成,其中一个氘原子中含有一个中子和一个质子,根据以上信息判断下列说法中正确的是 ( )A、重水的相对分子质量是18 B、一个氘原子外有两个核外电子 C、氘原子和气原子质子数相同,属于同位素 D、氘原子和气原子在元素周期表中位于不同位置13. 下列关于构成物质的微粒说法正确的是( )A、目前发现的微粒只有分子、原子、离子三种 B、分子由原子构成,因此原子一定比分子小 C、Cl和Cl-属于同种元素,但化学性质不同 D、构成O2 、CO2 两种物质的微粒中都含有氧分子14. 2025年“3·15晚会”曝光部分企业在加工水产品时违规、超量添加磷酸盐保水剂。长期过量摄入磷酸盐可能会导致人体钙磷比失衡,引发心血管疾病。这里的“钙、磷”是指()A、单质 B、元素 C、离子 D、原子15. 已知一个CO的分子的质量为 nkg,一个CO2分子的质量为 mkg,若以碳原子的1/12质量作为相对原子质量的标准,则CO2的相对分子质量为( )A、 B、 C、 D、二、填空题(共7题,共40分)
-
16. 用化学式或化学符号填写:(1)、n个氢氧根离子。(2)、标出水中氢元素的化合价。(3)、5个二氧化硫分子。17. 如图表示的是地壳里所含各种元素的质量分数。请根据图示回答下列问题。
 (1)、地壳中含量最多的非金属元素是(填元素符号);(2)、地壳中含量最多的非金属元素与含量占第二位的金属元素之间形成的化合物可能是( )(填序号)。A、 B、 C、 D、18. 某校开辟了一块劳动基地种植大棚青菜,在种植前,学校向同学们征集建议。(1)、小金建议学校采购肥料,如硝酸钠,其化学式是(用化学符号表示)。(2)、小金认为CO2也是一种气体肥料,CO2中数字“2”的意义。19. 在宏观、微观和符号之间建立联系是科学学科的特点。(1)、物质的组成及构成关系如图所示,图中①是。
(1)、地壳中含量最多的非金属元素是(填元素符号);(2)、地壳中含量最多的非金属元素与含量占第二位的金属元素之间形成的化合物可能是( )(填序号)。A、 B、 C、 D、18. 某校开辟了一块劳动基地种植大棚青菜,在种植前,学校向同学们征集建议。(1)、小金建议学校采购肥料,如硝酸钠,其化学式是(用化学符号表示)。(2)、小金认为CO2也是一种气体肥料,CO2中数字“2”的意义。19. 在宏观、微观和符号之间建立联系是科学学科的特点。(1)、物质的组成及构成关系如图所示,图中①是。 (2)、下列说法正确的是____(填字母)。A、氯化钠是由钠、氯两种元素组成的 B、氯化钠是由钠和氯气混合而成的 C、氯化钠是由一个钠原子和一个氯原子构成的(3)、氧和氯两种元素最本质的区别是它们原子中的不同;20. 用
(2)、下列说法正确的是____(填字母)。A、氯化钠是由钠、氯两种元素组成的 B、氯化钠是由钠和氯气混合而成的 C、氯化钠是由一个钠原子和一个氯原子构成的(3)、氧和氯两种元素最本质的区别是它们原子中的不同;20. 用 和
和 分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题:
分别表示氮原子和氧原子,如图所示是氮气与氧气在放电条件下发生反应的微观模拟图。请回答下列问题: (1)、在B图中将相关粒子图形补充完整(画图)。(2)、此过程中发生变化的粒子是(选填“质子”、“原子”或“分子”)。(3)、结合该图,从微观角度解释由A到C变化的实质是。(4)、下列物质中,由原子直接构成的是____。A、甲烷 B、金刚石 C、水银 D、氮气21. 在盛有等量冷水和热水的两个相同的烧杯中同时各滴入一滴墨水,一段时间后,杯中水的情况如图甲所示,该实验表明扩散快慢与有关;如图乙所示,在试管中装一半水并滴几滴红墨水,然后向试管中缓缓注满酒精,塞紧塞子,一段时间后试管内波面下降且颜色趋于一致,要想加快混合速度,结合第一个实验现象,可以对试管;如图丙所示,将两个表面较滑的铅块相互紧压,它们会粘在一起,这一现象证明分子间有。
(1)、在B图中将相关粒子图形补充完整(画图)。(2)、此过程中发生变化的粒子是(选填“质子”、“原子”或“分子”)。(3)、结合该图,从微观角度解释由A到C变化的实质是。(4)、下列物质中,由原子直接构成的是____。A、甲烷 B、金刚石 C、水银 D、氮气21. 在盛有等量冷水和热水的两个相同的烧杯中同时各滴入一滴墨水,一段时间后,杯中水的情况如图甲所示,该实验表明扩散快慢与有关;如图乙所示,在试管中装一半水并滴几滴红墨水,然后向试管中缓缓注满酒精,塞紧塞子,一段时间后试管内波面下降且颜色趋于一致,要想加快混合速度,结合第一个实验现象,可以对试管;如图丙所示,将两个表面较滑的铅块相互紧压,它们会粘在一起,这一现象证明分子间有。 22. 如图所示是元素周期表的一部分,请回答有关问题:
22. 如图所示是元素周期表的一部分,请回答有关问题:H
①
F
Na
②
Si
③
④
(1)、表中①②③④所代表的四种元素中,属于非金属的是(填序号)。(2)、写出表中②和④组成的化合物的化学式:。(3)、以下判断正确的是____。(多选)A、原子序数:④>③ B、核外电子数:①=③ C、③和④处于同一周期 D、①和③的电子层数相同三、实验与探究题(共5题,共40分)
-
23. 为了了解原子结构的奥秘,人类经历了漫长的探索过程。英国科学家卢瑟福为原子结构模型的建立作出了巨大贡献,他于1911年进行了著名的α粒子轰击金箔实验,为建立现代原子理论打下了基础。在实验中,
①大部分α粒子直线穿过金属箔。
②少部分α粒子有偏转。
③极少数α粒子有较大角度的偏转,甚至被弹回。
这就是著名的α粒子散射实验(如图所示),请根据所学内容进行回答。
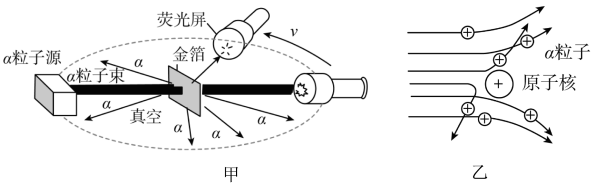 (1)、本实验中的放射性物质放出的α粒子带 (填“正”或“负”)电荷。(2)、大部分α粒子直线穿过金属箔而不改变原来的方向,是因为 非常小,且原子内部有很大空间。(3)、少部分α粒子有偏转是因为原子核带正电,α粒子途经原子核附近时,受到了 (填“引力”或“斥力”)。(4)、统计不同偏转角度的α粒子数量,符合实验现象的图像是 ____。A、
(1)、本实验中的放射性物质放出的α粒子带 (填“正”或“负”)电荷。(2)、大部分α粒子直线穿过金属箔而不改变原来的方向,是因为 非常小,且原子内部有很大空间。(3)、少部分α粒子有偏转是因为原子核带正电,α粒子途经原子核附近时,受到了 (填“引力”或“斥力”)。(4)、统计不同偏转角度的α粒子数量,符合实验现象的图像是 ____。A、 B、
B、 C、
C、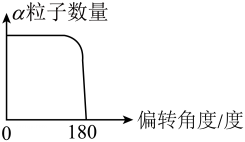 D、
D、 24. 隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种足原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。
24. 隔夜菜是否能吃,主要在于烧熟后的隔夜菜中亚硝酸盐含量的变化是否符合食品安全要求。蔬菜中的硝酸盐来自生长过程中所施氮肥,空气中微生物(如硝酸盐还原菌)进入到蔬菜中,会产生一种足原酶,使蔬菜中的部分硝酸盐还原成亚硝酸盐。烧熟后的菜在食用和保存阶段都会有一些细菌进入:做熟的蔬菜更适合细菌生长。某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位: mg/kg)
菜肴
半小时
6小时
18小时
24小时
炒青菜
0.6861
0.7982
4.3333
5.3624
韭菜炒蛋
1.8153
1.9249
2.8390
5.6306
红烧肉
2.4956
4.2558
4.0668
5.5188
红烧鲫鱼
/
2.0948
3.2300
7.2397
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483mg/g。
请根据以上材料,回答下列问题:
(1)、亚硝酸盐中含有亚硝酸根离子NO2- , 其中氮元素的化合价是 价。(2)、根据表中的数据,菜中的亚硝酸盐含量变化的共同规律是: 。(3)、要使烧熟后的隔夜菜中亚硝酸盐含量尽可能低,保存的条件应该是。(4)、用多种菜做实验的目的是 。25. 1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图甲所示。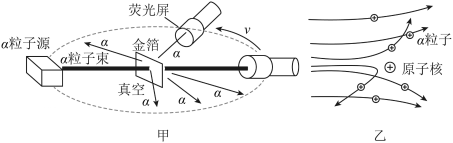
[收集证据]①绝大多数a粒子穿过金箔后仍沿原来的方向前进。②只有少数a粒子却发生了较大的偏转,并且有极少数a粒子的偏转超过 90°,有的甚至几乎达到 像是被金箔弹了回来。
[猜想与假设]a粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。[解释与结论]
(1)、要发生大角度的散射,能说明原子的大部分质量集中到了一个很小的结构,且该结构带有与α粒子电性相同的电荷,这个很小的结构指的是。(2)、能说明原子内部绝大部分是空的证据是。 (填收集证据的序号)(3)、根据卢瑟福的实验产生的现象,能够获得的结论是____。A、原子核体积很小 B、原子核带正电 C、核外电子带负电 D、原子核质量较大(4)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为图中的。 26. 元素周期表是元素周期的具体表现,它是学习化学的重要工具,对科学研究具有重要的指导作用,请阅读以下相关材料并回答问题。
26. 元素周期表是元素周期的具体表现,它是学习化学的重要工具,对科学研究具有重要的指导作用,请阅读以下相关材料并回答问题。材料一:氟是一种非金属化学元素,氟元素的单质是F2 , 它是一种淡黄色有剧毒的气体。氟气的腐蚀性很强,化学性质极为活泼,是氧化性最强的物质之一。
硫是一种非金属元素,通常单质硫是黄色的晶体。硫元素在自然界中通常以化合物或单质的形式存在。硫单质难溶于水,微溶于酒精对人体而言,单质硫通常是无毒无害的。
材料二:美国化学家鲍林提出用电负性来衡量元素在形成化合物时吸引电子的能力,元素电负性数值越大则表示吸引电子能力越强,下表是包含电负性的部分元素信息。
电负性
符号和名称相对原子质量
2.544
6C 碳
12
3.006
7 N 氮
14.01
3.61
8O氧
16
4.193
9F 氟
19
4.787
10 Ne 氖
20.18
电负性
符号和名称相对原子质量
1.916
14 Si 硅28.08
2.253
15 P 磷30.96
2.589
16 S 硫32.06
2.896
17 Cl 氯35.45
3.242
18 Ar 氩39.95
电负性
符号和名称相对原子质量
1.994
32 Ge 锗72.63
2.211
33 As 砷74.92
1
2
2.966
36 Kr 氪83.8
电负性
符号和名称相对原子质量
1.824
50 Sn 锡118.7
1.984
51 Sb 锑121.8
3
4
2.582
54 Xe 氙131.3
(1)、写出元素电负性在上表中同一周期的递变规律:。(2)、假设A 元素的电负性为1.1,B元素的电负性为2.9,请判断A、B两种元素形成的化合物中属于阳离子的是元素。(3)、某种元素,相对原子质量是79.9,单质是红黑色液体,蒸气具有腐蚀性,并且有毒。请你结合材料预测该元素在元素周期表中的位置(选择图中序号) , 并说明理由。27. 小东利用如图装置,进行电解水实验,并在水中加入一定量的硫酸溶液(电解过程中硫酸本身不会减少)。
实验编号
①
②
③
④
硫酸溶液浓度
0.5%
1.0%
1.5%
2.0%
氢气体积/毫升
5
5
5
5
时间/秒
300
100
60
50
(1)、实验中加入硫酸溶液的目的是。(2)、实验结束后,关闭电源,打开(选填“a”或“b”)处活塞,将带火星的木条放在玻璃管口,可观察到木条复燃。(3)、本实验通过比较来判断水电解的快慢。(4)、如表是在其它条件不变的情况下,改变溶液浓度时得到的实验数据。请结合表格内容,分析随着电解水实验的进行,产生氢气的速度变快的原因是。四、综合题(共5题,共35分)
-
28. 人们对相对原子质量的认识经历了不断修正和完善的过程。
材料一:19世纪初,有科学家认为:氢是母体,其他元素的相对原子质量理论上都是氢的相对原子质量的整数倍。
材料二:1886年,英国科学家克鲁克斯大胆假设:同一元素的原子,可以有不同的相对原子质量。某元素的相对原子质量是其不同的相对原子质量的平均值。
材料三: 1961年, 国际上采用碳-12原子质量的1/12,作为相对原子质量的标准,确定各种同位素原子的相对原子质量。某元素的相对原子质量是其各种同位素原子的相对原子质量乘以各自在该元素所占的百分比之和。
(1)、下列元素的相对原子质量不支持材料一的是____。A、O-16 B、Cl-35.5 C、Ag-108(2)、在克鲁克斯的假设中,同一元素的原子,可以有不同的相对原子质量。这是因为原子结构中的某种微粒数不同,该微粒的名称是。(3)、氯元素的相对原子质量是35.5,自然界氯元素仅有35Cl和37Cl两种同位素原子。根据材料三可以推出,氯元素中,35Cl和37Cl这两种同位素原子的个数之比为。29. 中国首位诺贝尔医学奖获得者屠呦呦继发现青蒿素后又发明了双氢青蒿素。如表是双氢青蒿素片的部分说明,请回答: (1)、双氢青蒿素分子中碳、氢原子个数比为。(2)、双氢青蒿素片的相对分子质量为。(3)、成人连用5日该药物,其中所含碳元素的质量为多少。 (结果取整数)30. 根据下列两则材料完成下列问题:
(1)、双氢青蒿素分子中碳、氢原子个数比为。(2)、双氢青蒿素片的相对分子质量为。(3)、成人连用5日该药物,其中所含碳元素的质量为多少。 (结果取整数)30. 根据下列两则材料完成下列问题:材料一:碘是人体的必需微量元素之一,缺碘可影响人体的生长及智力发育。我们可以通过食用碘盐来补碘。 “加碘食盐”是在食盐中加入了少量的碘酸钾(KIO3)。
材料二:碘是一种由碘分子构成的非金属单质。淀粉遇碘变蓝色。
(1)、“加碘食盐”为人体补充的是(填“碘元素”或“碘单质”);(2)、KIO3中Ⅰ的化合价为;(3)、取少量的“加碘食盐”溶解在水中,用馒头蘸取少量的食盐水,馒头不变蓝色,由此可知, “加碘食盐”中(填“存在”或“不存在”)碘分子;(4)、取少量碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头会变蓝色。请用分子的观点来解释实验中的现象:。31. 清明节食用“清明果”是温州传统习俗。制作时需将鼠曲草切碎后与糯米粉混合揉团,蒸熟后制成青绿色的清明果。鼠曲草中富含多种人体所需氨基酸,其中一种亮氨酸(化学式 能促进肌肉蛋白质合成。请回答下列问题: (1)、亮氨酸中C、N元素的质量比为。(2)、计算亮氨酸中氮元素的质量分数。(保留1位小数)(3)、6.55克亮氨酸中的氮元素质量为多少克?(保留1位小数)32. 小科按以下步骤完成活动“探索元素周期表”:
(1)、亮氨酸中C、N元素的质量比为。(2)、计算亮氨酸中氮元素的质量分数。(保留1位小数)(3)、6.55克亮氨酸中的氮元素质量为多少克?(保留1位小数)32. 小科按以下步骤完成活动“探索元素周期表”:①制作铭牌:利用便利贴将1~20号元素制作成铭牌。
②元素分类:利用制作的元素铭牌,将各元素按照一定的分类依据分成几个大类。
③元素排序:在上述分类的基础上,将所有元素按一定的顺序进行排列。各元素的排列结果如下表所示。
H
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
(1)、图甲是小科制作的17号氯元素的铭牌,铭牌中“?”对应的数值是; (2)、在步骤②中小科将图乙中的氧元素和碳元素分为一类,钠元素、铝元素和氩元素分为一类,钾元素分为一类,其分类依据是;(3)、小科发现:除第一周期外,步骤③的表中每一周期开头的是元素;(4)、小科排列的 He元素位置与课本中不相同,课本中将 He元素排在最后一列的原因是。
(2)、在步骤②中小科将图乙中的氧元素和碳元素分为一类,钠元素、铝元素和氩元素分为一类,钾元素分为一类,其分类依据是;(3)、小科发现:除第一周期外,步骤③的表中每一周期开头的是元素;(4)、小科排列的 He元素位置与课本中不相同,课本中将 He元素排在最后一列的原因是。