(新浙教版)科学 八年级下册 第一章 我们呼吸的空气 单元检测卷(提高)
试卷更新日期:2025-12-30 类型:单元试卷
一、选择题(每小题3分,共45分)
-
1. 下列物质在氧气中燃烧,其中可观察到明亮蓝紫色火焰现象的是( )A、蜡烛
 B、木炭
B、木炭 C、硫粉
C、硫粉 D、铁丝
D、铁丝 2. 铁丝在纯氧中可以剧烈燃烧,但在空气中却不能燃烧,造成此差异的主要影响因素是( )A、铁丝的质量 B、铁丝的表面积 C、氧气的浓度 D、反应的温度3. 思维导图是有效的思维模式,是应用于记忆、学习、思考等的思维“地图”。下图为氧气制取课题的思维导图,下列说法不合理的是
2. 铁丝在纯氧中可以剧烈燃烧,但在空气中却不能燃烧,造成此差异的主要影响因素是( )A、铁丝的质量 B、铁丝的表面积 C、氧气的浓度 D、反应的温度3. 思维导图是有效的思维模式,是应用于记忆、学习、思考等的思维“地图”。下图为氧气制取课题的思维导图,下列说法不合理的是 A、Ⅰ、Ⅱ处分别是氧气的不同制法 B、Ⅲ处表示的是催化剂 C、 图中制取氧气的原料中都含有氧气 D、利用空气制取氧气可知液氧沸点比氮高4. 相对稳定的洁净空气对人类和其他生物的生存都非常重要,下列说法错误的是( )A、空气质量指数(AQI)是评价大气环境质量的指标,其数值越低表示空气质量越好 B、自然因素也会造成空气污染 C、PM2.5 是指粒径小于等于2.5 毫米的颗粒物 D、酸雨是指 pH 低于5.6 的酸性降水5. 下图是实验室用高锰酸钾制取并收集氧气的实验装置图。下列有关实验操作的表述,错误的是( )。
A、Ⅰ、Ⅱ处分别是氧气的不同制法 B、Ⅲ处表示的是催化剂 C、 图中制取氧气的原料中都含有氧气 D、利用空气制取氧气可知液氧沸点比氮高4. 相对稳定的洁净空气对人类和其他生物的生存都非常重要,下列说法错误的是( )A、空气质量指数(AQI)是评价大气环境质量的指标,其数值越低表示空气质量越好 B、自然因素也会造成空气污染 C、PM2.5 是指粒径小于等于2.5 毫米的颗粒物 D、酸雨是指 pH 低于5.6 的酸性降水5. 下图是实验室用高锰酸钾制取并收集氧气的实验装置图。下列有关实验操作的表述,错误的是( )。 A、往试管里装药品前,必须检验装置的气密性 B、给试管里药品加热前,要先给试管预热 C、要等到气泡连续均匀放出后,才能开始收集气体 D、实验结束时,应先熄灭酒精灯,然后把导管口移出水面6. 某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示,下列关于该过程的说法正确的是( )
A、往试管里装药品前,必须检验装置的气密性 B、给试管里药品加热前,要先给试管预热 C、要等到气泡连续均匀放出后,才能开始收集气体 D、实验结束时,应先熄灭酒精灯,然后把导管口移出水面6. 某同学误将少量KMnO4当成MnO2加入KClO3中进行加热制取氧气,部分物质质量随时间变化如图所示,下列关于该过程的说法正确的是( ) A、c代表氧气 B、a代表高锰酸钾 C、t1时刻, KClO3开始分解 D、t3时刻,生成氧气的质量达到最大值7. 高锰酸钾制取氧气()实验中,高锰酸钾完全反应。下列能正确表示反应物和生成物质量随时间变化大致曲线的图是( )A、
A、c代表氧气 B、a代表高锰酸钾 C、t1时刻, KClO3开始分解 D、t3时刻,生成氧气的质量达到最大值7. 高锰酸钾制取氧气()实验中,高锰酸钾完全反应。下列能正确表示反应物和生成物质量随时间变化大致曲线的图是( )A、 B、
B、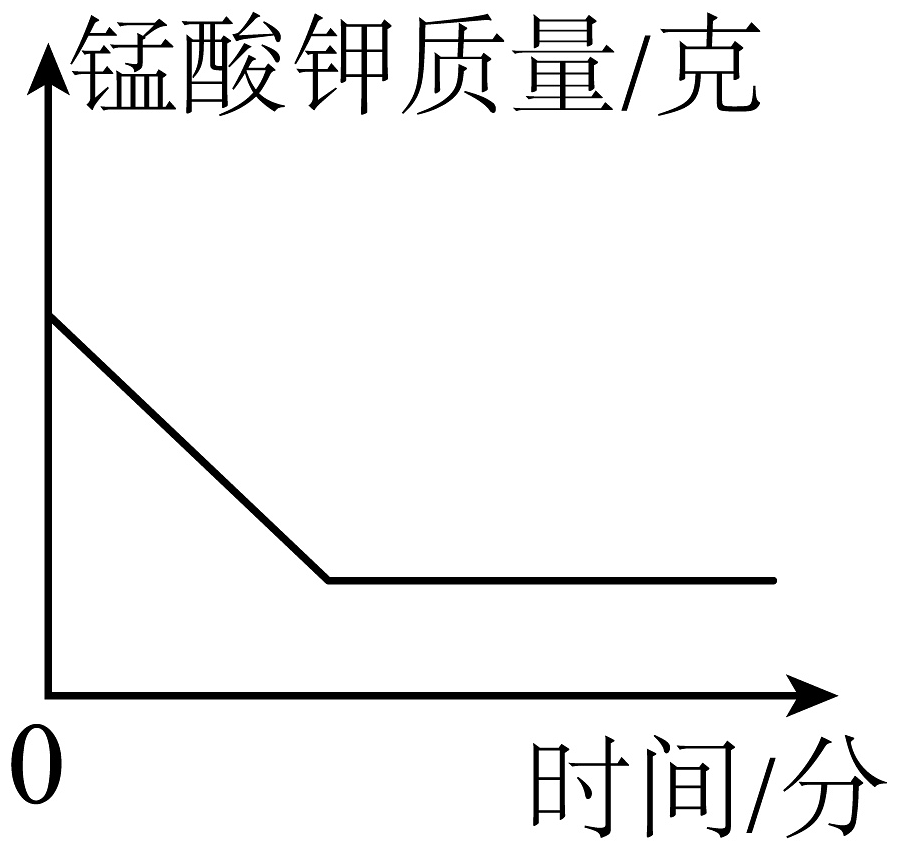 C、
C、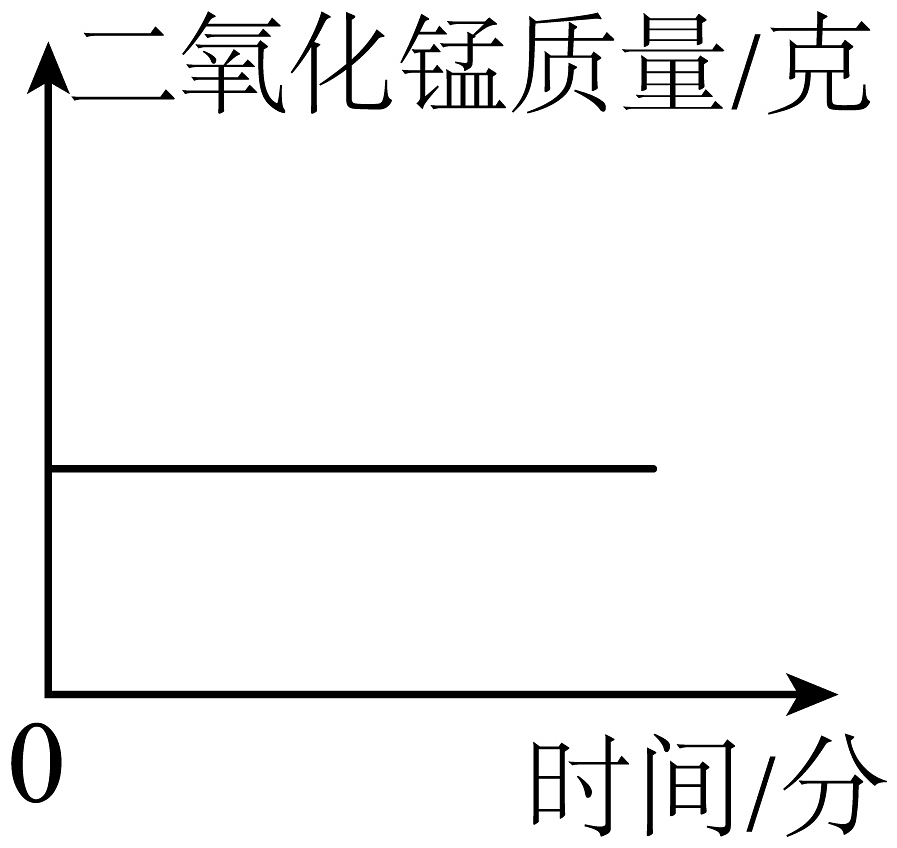 D、
D、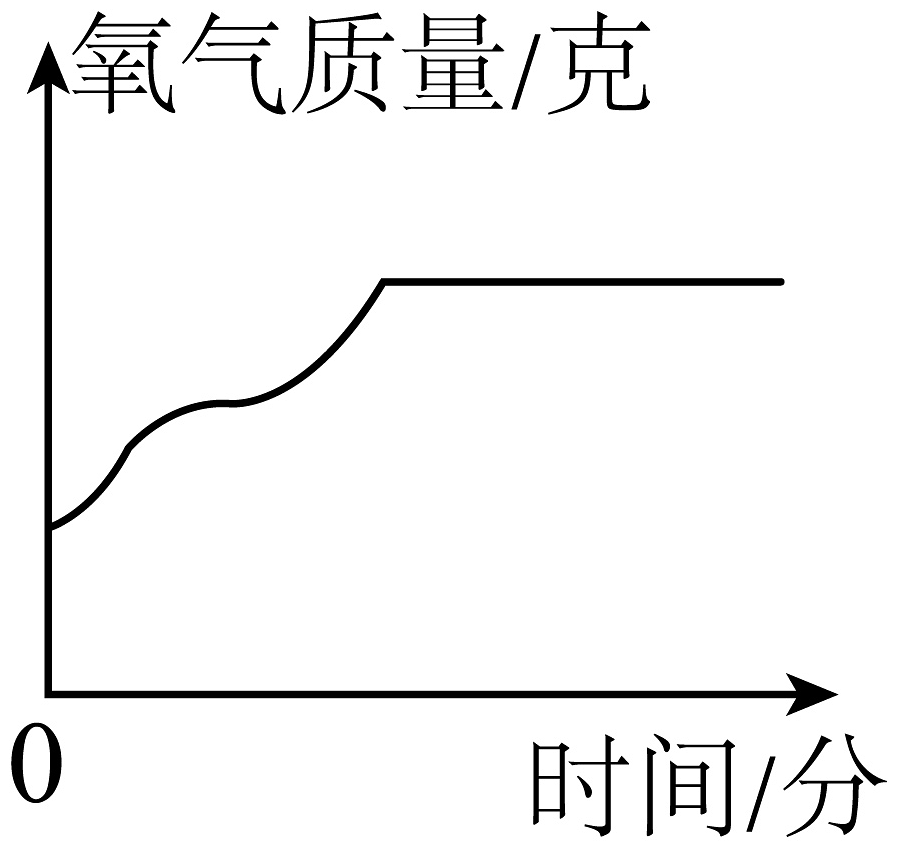 8. 用如图所示装置进行实验(夹持仪器略去)。实验过程:①通入N2一段时间,点燃酒精灯,a、b中均无明显现象;②熄灭酒精灯,立即改通O2 , a中无明显现象,b中红磷燃烧。根据上述实验步骤,下列说法不正确的是 ( )
8. 用如图所示装置进行实验(夹持仪器略去)。实验过程:①通入N2一段时间,点燃酒精灯,a、b中均无明显现象;②熄灭酒精灯,立即改通O2 , a中无明显现象,b中红磷燃烧。根据上述实验步骤,下列说法不正确的是 ( ) A、红磷燃烧过程中产生大量白雾,并放出大量的热 B、通入一段时间N2的目的是排尽装置中原有的空气 C、对比a、b在实验过程②中的现象,可知燃烧需要温度达到可燃物的着火点 D、对比b在实验过程①②中的现象,可以得出可燃物的燃烧需要氧气9. 某户外品牌研发了一款便携式自热食品包,其发热包主要成分为生石灰、铁粉、活性炭和盐。使用时撕开包装,加入冷水,生石灰和水反应放热,发热包迅速升温。包装说明强调“保存时需密封防潮,使用时避免明火”。下列说法不正确的是A、铁粉在潮湿空气中缓慢氧化放热,该反应属于化合反应 B、活性炭疏松多孔的结构可吸附氧气,促进铁粉氧化 C、密封防潮保存可防止生石灰提前与水反应失效 D、加水后温度骤升,是因为水降低了铁的着火点10. 神舟十五号载人飞船发射圆满成功。火箭助推器使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为推进剂,燃烧时发生反应的微观示意图如图。参加反应的
A、红磷燃烧过程中产生大量白雾,并放出大量的热 B、通入一段时间N2的目的是排尽装置中原有的空气 C、对比a、b在实验过程②中的现象,可知燃烧需要温度达到可燃物的着火点 D、对比b在实验过程①②中的现象,可以得出可燃物的燃烧需要氧气9. 某户外品牌研发了一款便携式自热食品包,其发热包主要成分为生石灰、铁粉、活性炭和盐。使用时撕开包装,加入冷水,生石灰和水反应放热,发热包迅速升温。包装说明强调“保存时需密封防潮,使用时避免明火”。下列说法不正确的是A、铁粉在潮湿空气中缓慢氧化放热,该反应属于化合反应 B、活性炭疏松多孔的结构可吸附氧气,促进铁粉氧化 C、密封防潮保存可防止生石灰提前与水反应失效 D、加水后温度骤升,是因为水降低了铁的着火点10. 神舟十五号载人飞船发射圆满成功。火箭助推器使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作为推进剂,燃烧时发生反应的微观示意图如图。参加反应的 和
和 分子个数比是( )
分子个数比是( )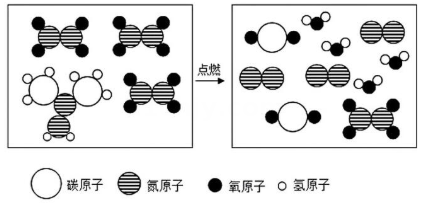 A、3:1 B、1:3 C、2:1 D、1:211. 在“双碳”目标引领的时代背景下,能源与环境愈发成为全球瞩目的焦点。2025 年上半年,我国某大型能源集团对旗下使用天然气与煤炭作为燃料的两个大型发电厂进行了为期一周的污染物排放监测,所产生的CO2和SO2气体的质量统计数据如图所示。根据图示分析,下列说法不正确的是
A、3:1 B、1:3 C、2:1 D、1:211. 在“双碳”目标引领的时代背景下,能源与环境愈发成为全球瞩目的焦点。2025 年上半年,我国某大型能源集团对旗下使用天然气与煤炭作为燃料的两个大型发电厂进行了为期一周的污染物排放监测,所产生的CO2和SO2气体的质量统计数据如图所示。根据图示分析,下列说法不正确的是 A、该天然气中也含硫元素 B、煤燃烧产生的气体更易导致酸雨 C、煤和天然气的燃烧都有温室气体产生 D、一定质量的煤燃烧所产生的SO2的质量比CO2多12. 如图为氮元素的部分化合价、物质类别二维图。下列说法错误的是( )
A、该天然气中也含硫元素 B、煤燃烧产生的气体更易导致酸雨 C、煤和天然气的燃烧都有温室气体产生 D、一定质量的煤燃烧所产生的SO2的质量比CO2多12. 如图为氮元素的部分化合价、物质类别二维图。下列说法错误的是( ) A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的化学式为HNO2 D、d点物质的化学式为NO213. 利用太阳能可将甲烷(CH4)在高温熔融盐环境中转化为H2 , 反应原理如图所示。下列说法正确的是( )
A、a点物质在空气中体积分数最高 B、b点物质属于大气污染物 C、c点物质的化学式为HNO2 D、d点物质的化学式为NO213. 利用太阳能可将甲烷(CH4)在高温熔融盐环境中转化为H2 , 反应原理如图所示。下列说法正确的是( )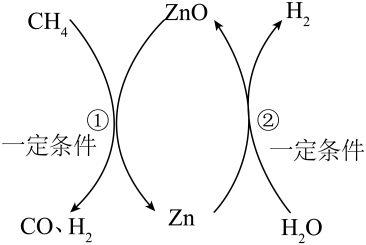 A、反应①属于分解反应 B、反应①产生的CO和H2的质量比是 14:1 C、整个反应体系在正常工作时,每16克 CH4 参加反应,可产生6克 H2 D、当参加反应的 CH4与H2O 质量比为4:9 时,整个反应体系中可不补充 ZnO14. 在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,在确的是( )
A、反应①属于分解反应 B、反应①产生的CO和H2的质量比是 14:1 C、整个反应体系在正常工作时,每16克 CH4 参加反应,可产生6克 H2 D、当参加反应的 CH4与H2O 质量比为4:9 时,整个反应体系中可不补充 ZnO14. 在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。下列关于此反应的认识,在确的是( )物质
X
Y
Z
W
反应前的质量/g
20
m
16
14
反应后的质量/g
4
6
60
50
A、参加反应的X与Y的质量比是1;3 B、m的数值为64 C、反应中Z、W的质量变化之比为6:5 D、若继续反应,最终容器内只剩下X、Z、W三种物质15. 往FeCl3和CuCl2 的混合溶液中加入铁粉。已知反应的先后顺序、化学方程式分别为: +Cu,如图所示为反应后混合液质量与加入铁粉质量的关系曲线,N、M、P、Q是曲线上的点,则下列说法错误的是 ( ) A、N→P 发生的反应为化合反应 B、与M、P、Q对应的溶液中的溶质种类分别是3、2、1 种 C、若 b=2a,则反应过程中溶液质量的增加量与减小量之比为 8:7 D、若b=2a,则原混合液中 FeCl3和 CuCl2的质量分数之比为 65:27
A、N→P 发生的反应为化合反应 B、与M、P、Q对应的溶液中的溶质种类分别是3、2、1 种 C、若 b=2a,则反应过程中溶液质量的增加量与减小量之比为 8:7 D、若b=2a,则原混合液中 FeCl3和 CuCl2的质量分数之比为 65:27二、填空题(共7题,共40分)
-
16. 科学家对物质的组成和结构有了更深入的认识后,从微观本质上揭示了化学反应前后质量守恒的原因。结合氢气与氧气反应生成水的示意图。 (◯表示氧原子,●表示氢原子)回答下列问题:
 (1)、根据质量守恒定律,图A中缺少(填微观粒子名称)。(2)、从微观角度分析:化学反应前后,不变,因此参加化学反应的各物质的质量总和一定等于生成物的各物质的质量总和。17. 如图是有关氧气的知识网络图(反应条件省略),用化学用语回答:
(1)、根据质量守恒定律,图A中缺少(填微观粒子名称)。(2)、从微观角度分析:化学反应前后,不变,因此参加化学反应的各物质的质量总和一定等于生成物的各物质的质量总和。17. 如图是有关氧气的知识网络图(反应条件省略),用化学用语回答: (1)、物质⑥是铁丝在氧气中燃烧的产物,其颜色是;(2)、硫在氧气中燃烧的现象是剧烈燃烧、放出大量的热、等现象;(写出其中一点即可)(3)、图中①②③是实验室制取氧气的三个反应,它们都属于(“化合”或“分解”)反应。18. 2024年4月 25日,搭载神舟十八号载人飞船的长征二号F遥十八运载火箭在酒泉卫星发射中心点火发射,其助推器使用偏二甲肼(C2H6N2)作燃料,四氧化二氮(N2O4)作助燃剂,两者反应的微观示意图如下:
(1)、物质⑥是铁丝在氧气中燃烧的产物,其颜色是;(2)、硫在氧气中燃烧的现象是剧烈燃烧、放出大量的热、等现象;(写出其中一点即可)(3)、图中①②③是实验室制取氧气的三个反应,它们都属于(“化合”或“分解”)反应。18. 2024年4月 25日,搭载神舟十八号载人飞船的长征二号F遥十八运载火箭在酒泉卫星发射中心点火发射,其助推器使用偏二甲肼(C2H6N2)作燃料,四氧化二氮(N2O4)作助燃剂,两者反应的微观示意图如下: (1)、 从宏观角度看: C2H6N2和N2O4中, 和氧气的化学性质相似。(2)、从微观角度看:已知④中的分子只含有一种原子,请画出该分子模型。(3)、从符号表征看:该反应的化学方程式为:。19. 18世纪,很多科学家着力研究燃烧现象的本质、物质的组成等,为开启现代化学的研究做出了极大的贡献。
(1)、 从宏观角度看: C2H6N2和N2O4中, 和氧气的化学性质相似。(2)、从微观角度看:已知④中的分子只含有一种原子,请画出该分子模型。(3)、从符号表征看:该反应的化学方程式为:。19. 18世纪,很多科学家着力研究燃烧现象的本质、物质的组成等,为开启现代化学的研究做出了极大的贡献。(1)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两类:
a.加热分解硝酸钾(KNO3)、氧化汞(HgO)、硝酸银(AgNO3)等
b.用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)=2MnSO4+2X+O2↑
①a中反应物均可制得氧气,因为这些物质在组成上都含有。
②b中物质X的化学式为。
(2)1783年,拉瓦锡利用如图装置探究水的组成:往A杯中滴加少量的水,水通过灼热的铁管时发生汽化,水蒸气与灼热的铁反应,生成了一种黑色固体(Fe3O4)。再通过盛放冷水中的钢管,在B装置中收集到纯净的氢气。由此,拉瓦锡得出水是由氢、氧元素组成。科学家们测量实验后黑色固体质量为m1 , 氢气质量为m2。再将氢气完全燃烧,生成水的质量为m3。若拉瓦锡结论正确,则m1、m2、m3三者应满足的关系是。
 20. 如图是化学中“有名”的装置(万能瓶),有如下用途:
20. 如图是化学中“有名”的装置(万能瓶),有如下用途:
(1)可以用做向上排空气法收集氧气,从端进氧气。
(2)可以用做排水法收集氧气,在集气瓶中装满水,从端进氧气。
(3)医院里给病人输氧为了给氧气加湿和观察氧气的输出速度也可以在氧气瓶和病人之间连接该装置,在集气瓶装半瓶水,将端接氧气钢瓶,通过观察就知道氧气的输出速度。
21. 科学兴趣小组的同学利用如图微型实验装置进行实验。请回答: (1)、挤压滴管,观察 到左侧装置中产生大量气泡,微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是;(2)、打开燃烧管左侧胶管,通入氮气,燃烧的磷很快熄灭,体现出的灭火原理为。22. 2024年4月25日,搭载神舟十八号载人飞船的长征二号F遥十八运载火箭在酒泉卫星发射中心点火发射,其助推器使用如图①偏二甲肼()作燃料,②四氧化二氮作为助燃剂,两者反应的微观示意图如下图:
(1)、挤压滴管,观察 到左侧装置中产生大量气泡,微热燃烧管,白磷燃烧而红磷不燃烧,由此可说明燃烧需要的条件是;(2)、打开燃烧管左侧胶管,通入氮气,燃烧的磷很快熄灭,体现出的灭火原理为。22. 2024年4月25日,搭载神舟十八号载人飞船的长征二号F遥十八运载火箭在酒泉卫星发射中心点火发射,其助推器使用如图①偏二甲肼()作燃料,②四氧化二氮作为助燃剂,两者反应的微观示意图如下图: (1)、从宏观角度看:偏二甲肼中有种元素。(2)、从微观角度看:从偏二甲肼燃料燃烧时发生反应的微观示意图可知④的模型为。(3)、从符号表征看:该反应的化学方程式为:
(1)、从宏观角度看:偏二甲肼中有种元素。(2)、从微观角度看:从偏二甲肼燃料燃烧时发生反应的微观示意图可知④的模型为。(3)、从符号表征看:该反应的化学方程式为:三、实验与探究题(共5题,共40分)
-
23. 某科学兴趣小组的同学利用数字化技术对“空气中氧气体积分数的测定”进行了实验甲(如图1所示,燃烧匙内盛有过量红磷),得到的数据曲线如图2所示。

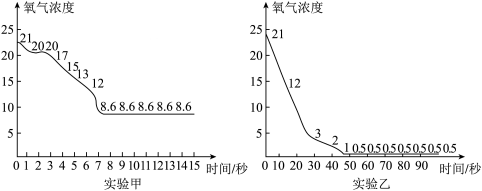 (1)、实验前集气瓶中的水为10mL,若集气瓶的容积为150mL(燃烧匙所占体积忽略不计),第一次实验结束后理论上集气瓶中水的体积约为mL。(2)、图2中X曲线表示的是集气瓶内的的变化趋势。(3)、若第二次进行实验时,图1中装置漏气,则第二次测得的c点数值比图2中第一次测得的c点数值(选填“大”或“小”)。(4)、接下来,该小组同学对实验装置进行改进,把“暖宝宝”中的黑色粉末(足量铁粉)涂抹在集气瓶内壁的四周,再次进行实验乙。通过数字传感器,测得实验甲、实验乙中氧气的浓度随时间变化的关系分别如上图所示。依据图中信息,该小组同学一致认为实验乙的测定方法更准确,其判断依据是。24. 小塘在实验室里用高锰酸钾固体制取氧气。
(1)、实验前集气瓶中的水为10mL,若集气瓶的容积为150mL(燃烧匙所占体积忽略不计),第一次实验结束后理论上集气瓶中水的体积约为mL。(2)、图2中X曲线表示的是集气瓶内的的变化趋势。(3)、若第二次进行实验时,图1中装置漏气,则第二次测得的c点数值比图2中第一次测得的c点数值(选填“大”或“小”)。(4)、接下来,该小组同学对实验装置进行改进,把“暖宝宝”中的黑色粉末(足量铁粉)涂抹在集气瓶内壁的四周,再次进行实验乙。通过数字传感器,测得实验甲、实验乙中氧气的浓度随时间变化的关系分别如上图所示。依据图中信息,该小组同学一致认为实验乙的测定方法更准确,其判断依据是。24. 小塘在实验室里用高锰酸钾固体制取氧气。 (1)、检查装置气密性时,将导管浸入水中,用手捂住试管,观察到 , 说明气密性良好。(2)、实验步骤:①在试管中加入试剂并固定好装置;②把导管移出水面;③点燃酒精灯加热;④熄灭酒精灯;⑤检查装置的气密性。以上步骤的正确顺序为(填序号)。(3)、若用排空气法收集氧气,应选择丙图的收集装置(选填“a”或“b”)。利用此装置收集氧气,检验氧气是否已集满的具体操作是。25. “氧烛”常用做潜艇等密闭仓内的紧急供氧设备,使用时按压点火装置,药块中的镁粉持续氧化放热3)在二氧化锰的催化下分解产生氧气,化学方程式:
(1)、检查装置气密性时,将导管浸入水中,用手捂住试管,观察到 , 说明气密性良好。(2)、实验步骤:①在试管中加入试剂并固定好装置;②把导管移出水面;③点燃酒精灯加热;④熄灭酒精灯;⑤检查装置的气密性。以上步骤的正确顺序为(填序号)。(3)、若用排空气法收集氧气,应选择丙图的收集装置(选填“a”或“b”)。利用此装置收集氧气,检验氧气是否已集满的具体操作是。25. “氧烛”常用做潜艇等密闭仓内的紧急供氧设备,使用时按压点火装置,药块中的镁粉持续氧化放热3)在二氧化锰的催化下分解产生氧气,化学方程式:↑,Mg粉持续氧化放出的热量可维持至氯酸钠耗尽,生成的氧气经气滤装置后由氧气出气口排出。其装置如图甲。查资料可知产氧药块有A、B两种:A药块含有 和MnO2 , 并均匀分布金属燃料镁粉:B药块含有NaClO3和MnO2 , 不含镁粉,如图乙。为探究A、B药块的组合方式对氧烛产氧量的影响,小科进行了以下实验。
 (1)、从反应的基本类型看,分解氯酸钠获取氧气属于反应。(2)、为探究A、B两种药块填充布局方式对产氧量的影响,小科进行了图丙设计。为保障A、B药块中的NaClO3完全消耗,以达到最大产氧量的目的,应选择哪一种结构?。(3)、为探究产氧量与A、B药块的质量配比的关系,小科在保证A、B药块总质量相同的前提下,按不同的质量比进行模拟实验,如图丁所示。则该实验的结论是:。(4)、为进一步确定产氧量最高的A、B药块质量比,该如何进一步实验?请简述实验步骤: 。26. 为了探究氯酸钾制取氧气时,生成氧气的速度与加入二氧化锰的质量有怎样的关系?小明用图甲装置开展实验。步骤如下:
(1)、从反应的基本类型看,分解氯酸钠获取氧气属于反应。(2)、为探究A、B两种药块填充布局方式对产氧量的影响,小科进行了图丙设计。为保障A、B药块中的NaClO3完全消耗,以达到最大产氧量的目的,应选择哪一种结构?。(3)、为探究产氧量与A、B药块的质量配比的关系,小科在保证A、B药块总质量相同的前提下,按不同的质量比进行模拟实验,如图丁所示。则该实验的结论是:。(4)、为进一步确定产氧量最高的A、B药块质量比,该如何进一步实验?请简述实验步骤: 。26. 为了探究氯酸钾制取氧气时,生成氧气的速度与加入二氧化锰的质量有怎样的关系?小明用图甲装置开展实验。步骤如下:①检查装置气密性,在500毫升集气瓶中装满水;
②向10支试管中各加入2克氯酸钾,分别记为①~⑩组,往10支试管中分别装入0.1克 0.2克、0.3 克、0.4 克、0.5克、0.65克、 1 克、 1.3克、2克、3克二氧化锰,并混合均匀;
③将10支试管分别加热,记录生成300毫升氧气所需时间,计算生成氧气的速度如图乙。
 (1)、实验中除了量筒外,还需用到的测量仪器有。(2)、和向下排空气法相比,本实验中用排水法收集氧气的优点是。(3)、分析实验数据,得出的初步结论是。(4)、4克氯酸钾和13克二氧化锰混合均匀加热,据图推测,收集300毫升氧气所需要的时间约为秒。27. 某校科学小组同学想通过实验验证质量守恒定律。
(1)、实验中除了量筒外,还需用到的测量仪器有。(2)、和向下排空气法相比,本实验中用排水法收集氧气的优点是。(3)、分析实验数据,得出的初步结论是。(4)、4克氯酸钾和13克二氧化锰混合均匀加热,据图推测,收集300毫升氧气所需要的时间约为秒。27. 某校科学小组同学想通过实验验证质量守恒定律。【实验思路】先确认发生的是“物理变化”还是“化学变化”,再比较变化中反应物的质量总和和生成物的质量总和是否相等。
(1)、如图甲的实验方案(填“能”或“不能”)用来验证质量守恒定律。
小组同学又设计了图乙的方案:
Ⅰ.锥形瓶内装入白磷,塞紧瓶塞放在天平托盘上,调节平衡:
Ⅱ.取下锥形瓶,将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并立即塞紧瓶塞;
Ⅲ.待反应结束冷却后,将锥形瓶放回天平托盘上,观察天平是否平衡。
(2)、【交流反思】该实验中,必须待反应结束并冷却后再称量的目的是。(3)、要确认是否发生了化学变化,有同学认为气球膨胀这一现象就足以作为发生化学变化的证据,你是否同意,并说明理由:。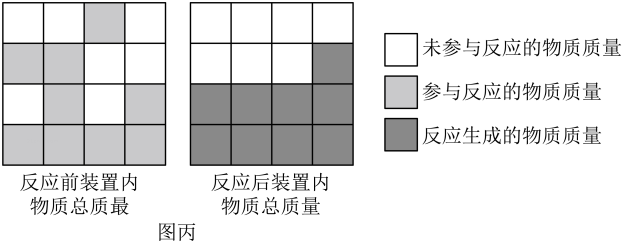 (4)、反应结束后,若有部分白磷未参与反应,依然能得出正确结论。请根据图丙的思维模型,推理解释:因为实验测得反应前后装置内物质总质量相等,且反应前后质量不变,所以参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
(4)、反应结束后,若有部分白磷未参与反应,依然能得出正确结论。请根据图丙的思维模型,推理解释:因为实验测得反应前后装置内物质总质量相等,且反应前后质量不变,所以参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。四、综合题(共5题,共35分)
-
28. 2015 年 2 月记者柴静的纪录片《穹顶之下》的播放,让我们更进一步的认识了雾霾,认识了 PM2.5。(1)、知道了一座城市当天平均 PM2.5 浓度,我们就能自行计算出 PM2.5 的分指数。计算公式是:[当天PM2.5 浓度(单位:微克/立方米)/国家二级标准限制 75(单位:微克/立方米)]×100 。单独看PM2.5 的分指数这个污染指标,我们可把每天的空气质量分六个等级:
分指数
空气质量级别
空气质量状况
0-50
I 级
优
51-100
II 级
良
101-150
III(1)级
轻微污染
151-200
III(2)级
轻度污染
201-300
IV(1)级和 IV(2)级
中度和中度重污染
大于 300
V 级
重度污染
2015年5月22日PM2.5监测试报数据显示,丽水的PM2.5浓度为49微克/立方米。则单看PM2.5指标,丽水的空气质量级别为。
(2)、下列关于 PM2.5 的说法正确的是① 燃放烟花爆竹会产生 PM2.5
② PM2.5 是造成雾霾天气的“元凶”之一
(3)、我国科学家在 CO 低温氧化的研究上取得了突破性进展。利用四氧化三钴(Co3O4)纳米棒的催化,使汽车尾气中的 CO 在低温时与 O2 反应生成 CO2 , 关于该反应的说法中,不正确的是( ) A、反应类型为化合反应 B、可降低汽车尾气对大气的污染 C、反应前后Co3O4质量改变 D、反应前后碳元素的化合价改变29. 在学习“质量守恒定律”时,某同学查阅到以下材料:
A、反应类型为化合反应 B、可降低汽车尾气对大气的污染 C、反应前后Co3O4质量改变 D、反应前后碳元素的化合价改变29. 在学习“质量守恒定律”时,某同学查阅到以下材料: (1)、波义耳实验中金属灰比原金属质量增加了,从你所懂得的“质量守恒定律”的知识进行解释。(2)、质量守恒定律的发现过程,带给我们的启示有_______(填序号)。A、要善于总结前人的成果和经验 B、定量方法是科学研究的重要方法 C、实验的成功与否,只取决于药品的选择(3)、受科学家研究的启发,某同学参照教材中的实验继续深入探究。在白磷燃烧前后质量测定实验中(如图),气球的作用有(写一点即可)。
(1)、波义耳实验中金属灰比原金属质量增加了,从你所懂得的“质量守恒定律”的知识进行解释。(2)、质量守恒定律的发现过程,带给我们的启示有_______(填序号)。A、要善于总结前人的成果和经验 B、定量方法是科学研究的重要方法 C、实验的成功与否,只取决于药品的选择(3)、受科学家研究的启发,某同学参照教材中的实验继续深入探究。在白磷燃烧前后质量测定实验中(如图),气球的作用有(写一点即可)。 (4)、该同学认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不符合质量守恒定律。你认为该同学的结论是否正确,并说明理由。30. 北京冬奥会水下机器人火炬对接,让无数网友看到了“水火相容”的情景。某校科学兴趣小组对此情景展开了相关活动。
(4)、该同学认为,蜡烛燃烧后剩下的固体质量比燃烧前少了,因此该现象不符合质量守恒定律。你认为该同学的结论是否正确,并说明理由。30. 北京冬奥会水下机器人火炬对接,让无数网友看到了“水火相容”的情景。某校科学兴趣小组对此情景展开了相关活动。查阅资料:火炬燃料丙烷的着火点:450℃;
丙烷燃烧的实际温度400-900℃,取决于测定点相对火焰的位置。
剧烈的燃烧反应能喷涌出高压炽热气体,能形成一个球形的气体罩


(1)“水火相容”:将装有某气体的大试管管口朝下垂直插入水中,使管口罩住白磷(如图甲所示),结果观察到了“水火相容”的奇观,则大试管中所装的气体可能是。
(2)“水火不容”:将大试管向上移动一定高度,燃烧的白磷就熄灭了,其原因是:。
(3)小组同学利用所学的知识设计了如图乙所示的火炬模型,请结合材料说明该火炬能在水中持续燃烧的理由:。
31. 把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示,请回答第一次
第二次
第三次
O2的质量(g)
3
4
6
SO2的质量(g)
6
8
8
(1)、上述实验中,第次实验中氧气有剩余,剩余克;(2)、在这三次实验中,符合质量守恒定律的是。(3)、若该同学要进行第四次实验,如果要将48克硫粉完全反应,能生成二氧化硫多少克?若将生成的二氧化硫全部被氢氧化钠溶液吸收,需要10%的氢氧化钠溶液多少克?(二氧化硫与氢氧化钠反应的化学方程式:SO2+2NaOH==Na2SO3+H2O)32. 为测定某大理石样品中含有碳酸钙的质量分数,小明取3克大理石样品进行实验,测量的方法如图甲所示,实验装置气密性良好。(化学方程式: , 其余杂质不参加反应)
(1)将稀盐酸滴入样品中反应一段时间后,当观察到(填实验现象),说明反应结束。
(2)实验结束后,量筒内进入水的体积如图乙所示(单位为),将量筒内进入水的体积作为生成二氧化碳体积来计算,请计算该大理石样品中的碳酸钙的质量分数。(已知在该实验条件下,生成气体的密度为)。
(3)若考虑盐酸加入后烧瓶内物质所占体积的变化对测定数据产生的影响,则(2)中测出的碳酸钙的质量分数将偏大,请说明理由。