人教版化学九年级下册随堂练习第十单元课题2 《常见的酸和碱》(基础卷)
试卷更新日期:2025-11-14 类型:同步测试
一、选择题
-
1. 分类是学习化学的一种重要方法。下列分类叙述不正确的是A、金属材料:生铁、硬铝、青铜 B、盐类:苛性钠、小苏打、纯碱 C、氧化物:水、二氧化碳、氧化钙 D、溶液:盐酸、生理盐水、碘酒2. 紫色石蕊试液遇柠檬汁变红色,这一现象不能说明( ).A、柠檬汁呈酸性 B、柠檬汁中含有丰富的维生素 C、石蕊能与柠檬汁中的某种物质发生反应 D、柠檬汁和酸溶液中都含有某种相同的粒子3. 小组同学用压强传感器研究蒸馏水或NaOH溶液吸收CO2的效果。注射器内各装有等体积的液体,同时等速度注入各自锥形瓶中,一段时间后,同时振荡锥形瓶。下列说法不正确的是
 A、曲线1表示注入蒸馏水后装置内的压强变化 B、0~t1段压强变化的主要原因是注入液体后气体被压缩 C、t1~t2段压强变化的主要原因是振荡锥形瓶,使反应进行更充分 D、对比曲线1和曲线2,可说明NaOH溶液吸收CO2的效果比蒸馏水吸收CO2的效果好4. 劳动实践活动不仅是素质教育的重要组成部分,也是培养学生实际操作能力和科学素养的有效途径。下列劳动实践与化学知识没有直接关联的是
A、曲线1表示注入蒸馏水后装置内的压强变化 B、0~t1段压强变化的主要原因是注入液体后气体被压缩 C、t1~t2段压强变化的主要原因是振荡锥形瓶,使反应进行更充分 D、对比曲线1和曲线2,可说明NaOH溶液吸收CO2的效果比蒸馏水吸收CO2的效果好4. 劳动实践活动不仅是素质教育的重要组成部分,也是培养学生实际操作能力和科学素养的有效途径。下列劳动实践与化学知识没有直接关联的是选项
劳动实践
化学知识
A
将废电池放入有害垃圾箱
回收利用废弃物,保护环境
B
在家炒菜时油锅不慎着火,用锅盖盖灭
隔绝氧气可以灭火
C
用铝合金制成门窗
铝在常温下与氧气不反应
D
用生石灰制作发热包
生石灰与水反应放出热量
A、A B、B C、C D、D5. 如图是稀硫酸和氢氧化钠溶液发生反应的微观示意图,下列说法正确的是 A、从物质类别看:该反应中涉及4种氧化物 B、从微观构成看:硫酸由2个氢离子、1个硫酸根离子构成 C、从质量关系看:参加反应的H2SO4和NaOH的质量比为98:40 D、从表示方法看:该反应的化学方程式为6. 下列四个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是
A、从物质类别看:该反应中涉及4种氧化物 B、从微观构成看:硫酸由2个氢离子、1个硫酸根离子构成 C、从质量关系看:参加反应的H2SO4和NaOH的质量比为98:40 D、从表示方法看:该反应的化学方程式为6. 下列四个坐标图分别表示4个实验过程中某些质量的变化,其中正确的是A
B
C
D
向一定量铁粉中滴加稀盐酸
向一定量硫酸铜溶液中不断加入锌粉
加热一定量高锰酸钾固体
向一定量氢氧化钠溶液中滴加稀盐酸

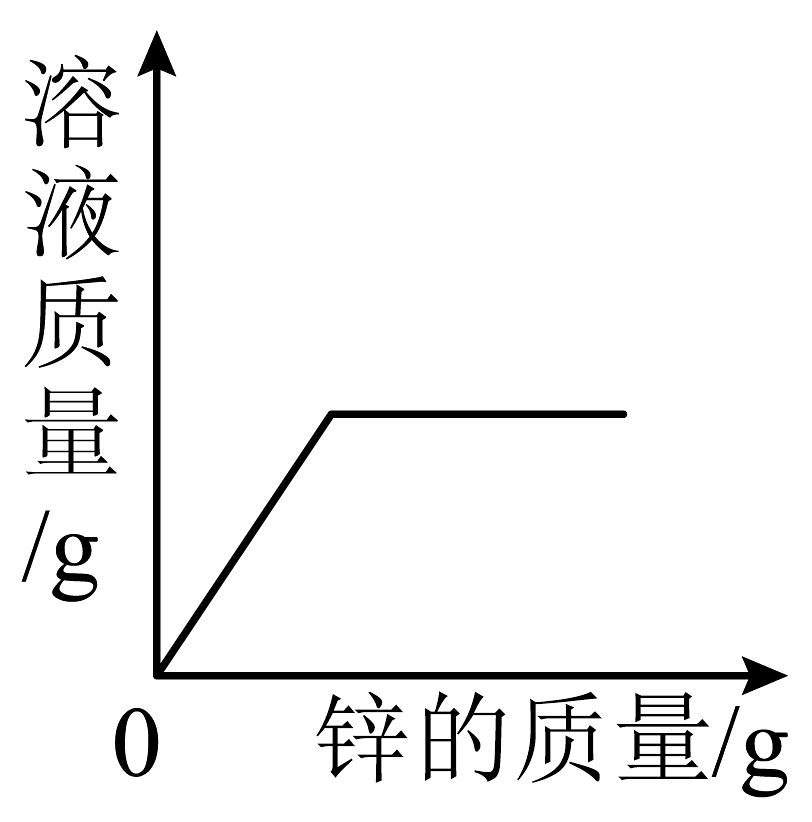
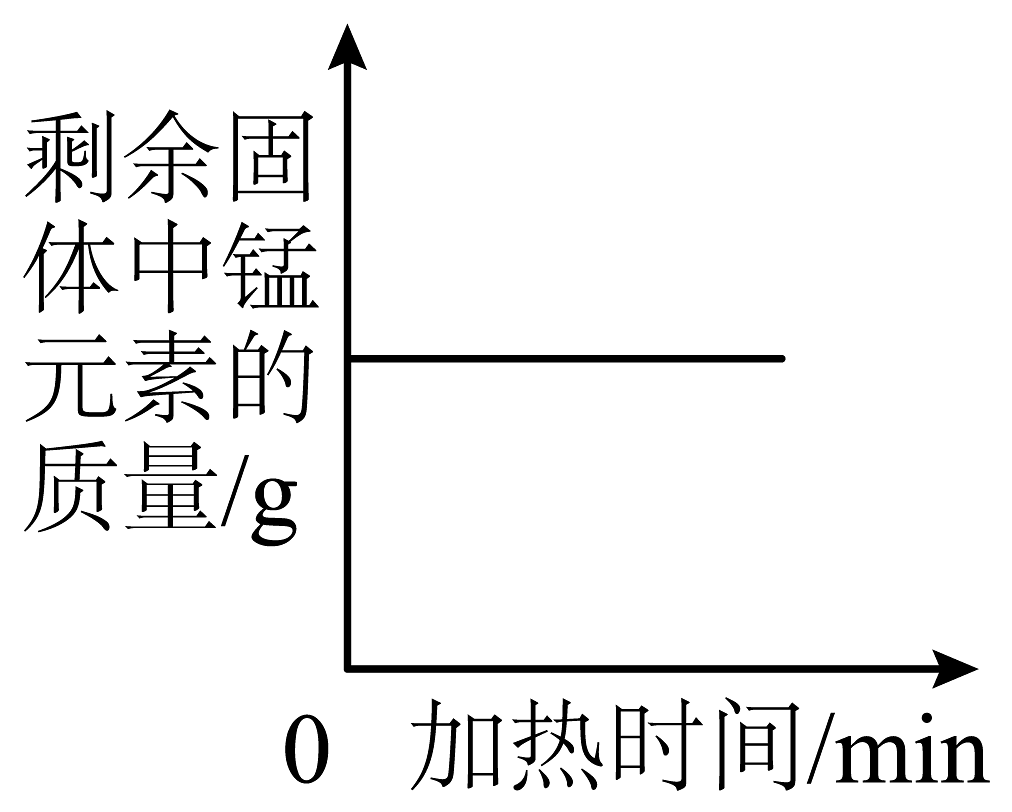
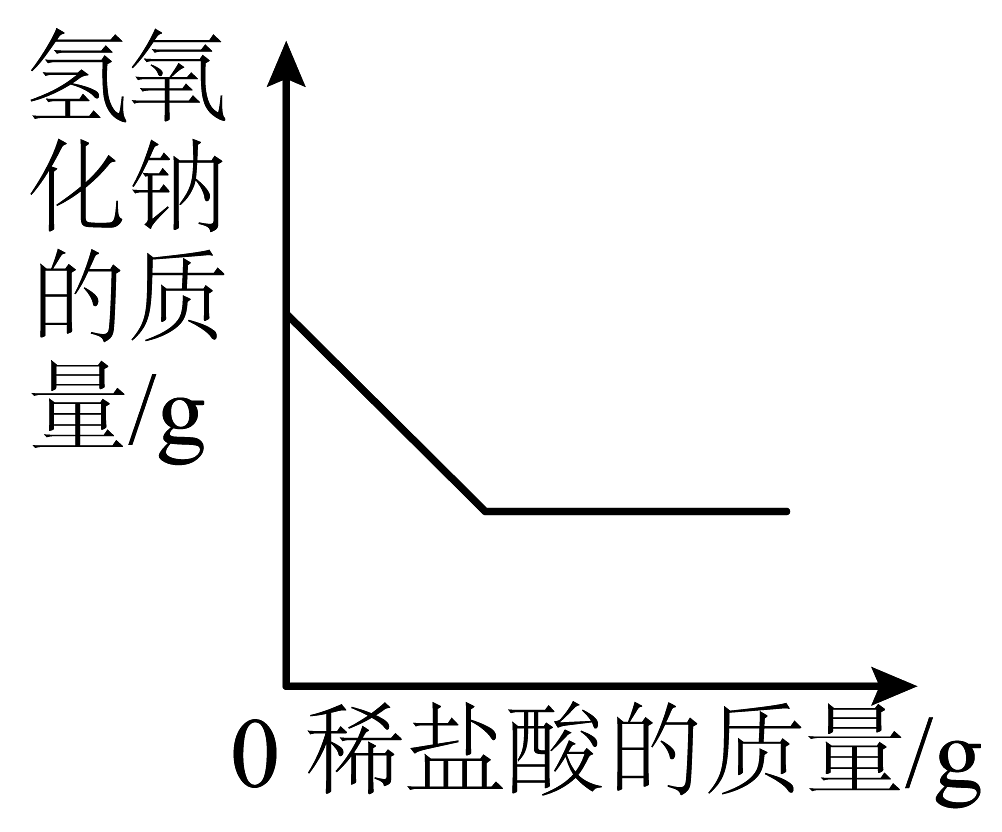 A、A B、B C、C D、D7. 酸溶液中都含有大量H+ , 因此不同酸表现出一些共同性质,下列关于盐酸性质的描述中,不属于酸的共同性质的是( ).A、能使紫色石蕊试液变为红色 B、能与氢氧化钠溶液反应生成水 C、能与硝酸银溶液反应生成白色沉淀 D、能与锌反应生成氢气8. 下列跨学科实践活动涉及的化学知识解释正确的是( )
A、A B、B C、C D、D7. 酸溶液中都含有大量H+ , 因此不同酸表现出一些共同性质,下列关于盐酸性质的描述中,不属于酸的共同性质的是( ).A、能使紫色石蕊试液变为红色 B、能与氢氧化钠溶液反应生成水 C、能与硝酸银溶液反应生成白色沉淀 D、能与锌反应生成氢气8. 下列跨学科实践活动涉及的化学知识解释正确的是( )选项
实践活动
化学知识
A
调查家用燃料的变迁与合理使用
未来的家用燃料要清洁、易调控、热值高
B
改良土壤的酸碱性
农业上使用氢氧化钠改良酸性土壤
C
用橡皮泥制作氢原子的原子模型
氢原子的原子核都由质子和中子构成
D
微型空气质量“监测站”的使用
测定空气中 SO2、CO2、NO2等污染性气体的含量
A、A B、B C、C D、D9. 下列有关实验操作正确的是A、 倾倒溶液
B、
倾倒溶液
B、 吸取少量溶液
C、
吸取少量溶液
C、 读出溶液的体积
D、
读出溶液的体积
D、 稀释浓硫酸
10. 合理利用化石燃料资源,是人类不断探索的课题。如图所示为某城市家用燃料的发展历程(括号内为燃料的主要成分)。下列有关说法不正确的是
稀释浓硫酸
10. 合理利用化石燃料资源,是人类不断探索的课题。如图所示为某城市家用燃料的发展历程(括号内为燃料的主要成分)。下列有关说法不正确的是 A、天然气燃烧产生的排放到空气中会造成酸雨 B、将煤制成管道煤气是化学变化 C、煤制成蜂窝煤有利于煤充分燃烧 D、以上燃料燃烧时均放出热量
A、天然气燃烧产生的排放到空气中会造成酸雨 B、将煤制成管道煤气是化学变化 C、煤制成蜂窝煤有利于煤充分燃烧 D、以上燃料燃烧时均放出热量二、填空题
-
11. 2030年前实现“碳达峰”,2060年实现“碳中和”是我国实现绿色发展的重要目标。CO2的捕集、封存及资源化利用是日前化学研究的热点。“碳捕集并封存”被认为是目前减缓全球变暖最经济可行的方式。(1)、实验室用澄清石灰水检验CO2也是“捕集”CO2的过程。但根据溶液知识,不宜采用澄清石灰水“捕集”CO2 , 原因是。(2)、氢氧化钠溶液吸收CO2没有明显现象,利用图1装置进行实验,先后将溶液全部快速推入,即可判断两物质发生了反应。同时用压强传感器测得一段时间内压强变化如图2所示。下列说法正确的是______(填序号)。
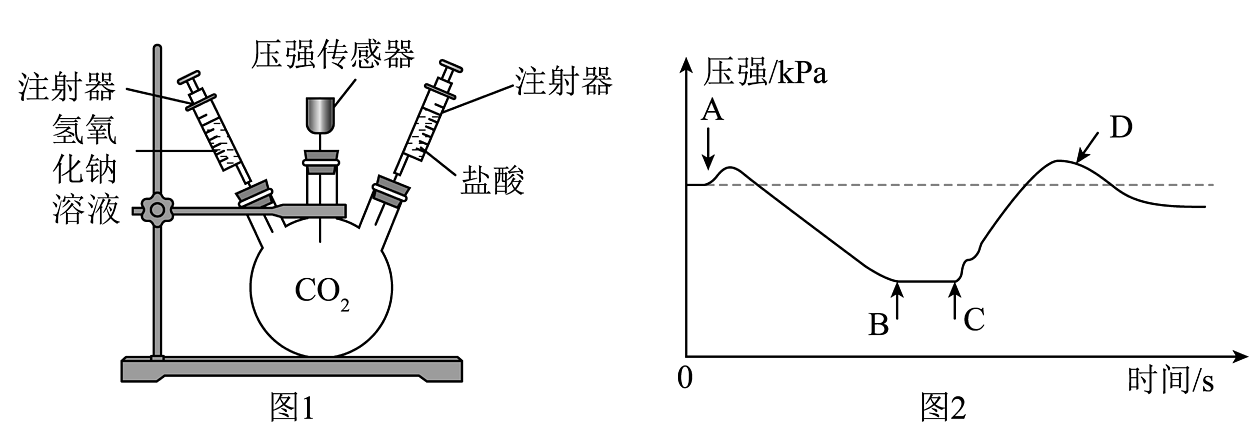 A、先推入的是盐酸 B、C点表示CO2与NaOH反应恰好停止 C、D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多 D、若盐酸足量,最终压强比初始压强小,原因可能是有部分二氧化碳溶于水(3)、“碳封存”是将CO2(气态)压入地下或注入到海底深处,以液态的形式封存。加压“封存”过程中,CO2分子的(填“大小”或“间隔”)将减小。(4)、实现“碳中和”主要有两条途径:一是节能减排,二是转化吸收。下列措施不符合节能减排理念的是______(填字母序号)。A、开发使用新能源 B、节约用电,绿色出行 C、全面禁止使用化石燃料 D、尽量减少使用塑料袋12. 分类、类比、推理都是学习化学常用的方法。(1)、实验时药品选择或操作不当都会导致无法达到实验目的,请将A和分为一类,分类标准是:均为导致无法达到实验目的。
A、先推入的是盐酸 B、C点表示CO2与NaOH反应恰好停止 C、D点压强比初始瓶内压强大,此时瓶内二氧化碳气体的量比初始多 D、若盐酸足量,最终压强比初始压强小,原因可能是有部分二氧化碳溶于水(3)、“碳封存”是将CO2(气态)压入地下或注入到海底深处,以液态的形式封存。加压“封存”过程中,CO2分子的(填“大小”或“间隔”)将减小。(4)、实现“碳中和”主要有两条途径:一是节能减排,二是转化吸收。下列措施不符合节能减排理念的是______(填字母序号)。A、开发使用新能源 B、节约用电,绿色出行 C、全面禁止使用化石燃料 D、尽量减少使用塑料袋12. 分类、类比、推理都是学习化学常用的方法。(1)、实验时药品选择或操作不当都会导致无法达到实验目的,请将A和分为一类,分类标准是:均为导致无法达到实验目的。



A.用木炭代替红磷测定空气中氧气含量
B.用湿润的pH试纸测酸的pH值
C.粗盐提纯通过蒸发获得精盐
D.用氢氧化钠溶液代替澄清石灰水检验二氧化碳
(2)、像氯化钾这样由(填符号)通过静电作用形成的化合物叫离子化合物。而氯化氢的形成过程则不同,氢原子趋向于得一个电子,氯原子也趋向于得一个电子,双方各给出一个电子组成共用电子对,为两个原子所共用。像氯化氢这样以共用电子对形成分子的化合物叫共价化合物。下列属于共价化合物的是(填字母)。A.CO B.ZnS C.
13. 生活中处处有化学。请用化学知识回答下列问题。(1)、发生森林火灾时,在大火蔓延路线前砍掉一片树木,形成隔离带,其灭火原理是。(2)、洋洋将一瓶汽水的瓶盖打开,汽水自动喷出来了,这是因为。(3)、用盐酸可除去铁制品表面的铁锈,反应的化学方程式为。(4)、为了节约石油资源,常在汽油中加入乙醇。写出乙醇在空气中燃烧的化学方程式。(5)、“百炼成钢”是指生铁在高温条件下反复捶打转化为钢,反复捶打的目的是降低生铁中的。14. 钴及其氧化物具有重要的工业用途。金属钴(Co)是一种“氢前金属”,金属活动性介于Zn和Cu之间,化学性质与铁相似,Co元素常见的化合价为和。(1)、根据金属化学性质的一般规律,下列预测钴的化学性质合理的是_____(填字母)。A、Co在中燃烧生成 B、常温时钴易与反应 C、钴能够与盐酸或者稀硫酸反应 D、硫酸钴溶液中的硫酸锌可以加入钴粉除去(2)、已知 , 均溶于水,而难溶于水,设计由生产的转化路径,依次写出反应的化学方程式:。(3)、将一段金属钴条(表面覆盖有、等物质)放入过量的稀硫酸中,如图:
反应过程中有气体产生,气体的成分为(填化学式),并请在图中补充完善反应后溶液中含有的粒子种类(粒子数目不作要求,不考虑水)。
(4)、在工业上有重要应用,具有成本低、来源广、稳定性好和催化活性高等优点,广泛应用于超级电容器、锂离子电池、催化剂、气体传感器、压敏陶瓷、磁性材料和颜料等领域。某研究小组利用加热分解固体的方式制取 , 实验中固体样品剩余质量随温度的变化如图所示。(已知385℃及以上残留固体均为金属氧化物)
①在空气中灼烧生成和一种能使澄清石灰水变浑浊的气体,该反应的化学方程式为。
②根据如图中数据,中a的值为。
③加热至800℃时,开始分解生成M和氧气,则物质M是(填化学式)。
(相对分子质量:147241)
三、推断题
-
15. A是一种难溶于水的黑色氧化物,其相对分子质量为80,请分析如下转化关系并填空。
 (1)、用化学式表示:A是 , C是 , 溶液D中的溶质是。(2)、用化学方程式表示:;。16. 某小组同学对炼铁高炉中发生的主要反应进行了知识网络建构,各物质之间的转化关系如图所示(反应条件已略去)。A~H是初中化学常见物质,已知F是易与人体血红蛋白结合的有毒气体,E与水反应放出热量,其中B、D、G为高炉炼铁原料的主要成分。请回答下列问题:
(1)、用化学式表示:A是 , C是 , 溶液D中的溶质是。(2)、用化学方程式表示:;。16. 某小组同学对炼铁高炉中发生的主要反应进行了知识网络建构,各物质之间的转化关系如图所示(反应条件已略去)。A~H是初中化学常见物质,已知F是易与人体血红蛋白结合的有毒气体,E与水反应放出热量,其中B、D、G为高炉炼铁原料的主要成分。请回答下列问题: (1)、反应②的化学方程式为。(2)、反应③的化学方程式为;该反应是(填“吸热”或“放热”)反应。(3)、反应④化学方程式为。(4)、E与水反应生成的物质在生产生活中的用途是(写一条即可)。
(1)、反应②的化学方程式为。(2)、反应③的化学方程式为;该反应是(填“吸热”或“放热”)反应。(3)、反应④化学方程式为。(4)、E与水反应生成的物质在生产生活中的用途是(写一条即可)。四、实验探究题
-
17. 铜跟浓硫酸的反应原理是 2H2O,某小组同学用如图所示装置制取硫酸铜,请回答下列问题.
 (1)、图中B装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,请将B装置中的导管补画完整.(2)、图中C装置的作用是防止氢氧化钠溶液倒吸入B瓶中,装置D的作用是:.(3)、充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验.
(1)、图中B装置用来收集SO2(已知SO2的密度大于CO2的密度),但未将导管画全,请将B装置中的导管补画完整.(2)、图中C装置的作用是防止氢氧化钠溶液倒吸入B瓶中,装置D的作用是:.(3)、充分反应后,烧瓶中的铜片仍有剩余,那么硫酸是否也有剩余呢?该小组同学进一步研究:待烧瓶冷却后,将烧瓶中的混合物稀释、过滤,用滤液做了如下实验.实验1:用pH试纸测试滤液 pH,其中 pH约为1.
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀生成.
你认为可以说明硫酸有剩余(填“实验1”或“实验2”).
(4)、以铜片与浓硫酸为原料用上述方法制取硫酸铜,存在的缺陷有(答出两点即可).18. 某化学兴趣小组对酸、碱、盐的部分性质进行探究.【探究一】氢氧化钠与二氧化碳反应
甲同学设计实验方案如图1所示:
 (1)、实验现象为 , 甲同学由此判断氢氧化钠和二氧化碳发生了反应.(2)、小组内其他同学认为甲同学方案不完善,理由是.(3)、【探究二】氢氧化钠和盐酸发生中和反应时放出热量
(1)、实验现象为 , 甲同学由此判断氢氧化钠和二氧化碳发生了反应.(2)、小组内其他同学认为甲同学方案不完善,理由是.(3)、【探究二】氢氧化钠和盐酸发生中和反应时放出热量乙同学向一定量10%的氢氧化钠溶液中滴加10%的盐酸,滴加过程中温度变化如表所示:
加入盐酸体积V/mL
2
4
6
8
10
12
14
16
18
20
混合溶液温度 T/℃
15.2|
19.6|
22.0
26.0
28.2|
26.7
25.7|
24.7
23.7
22.9
反应的化学方程式为.
(4)、根据表中数据分析混合溶液温度变化的原因是.(5)、小组内其他同学提出“将10%的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理?说明理由: .(6)、丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象.现将混合液中的氯化钠进行提纯,具体的操作为.(7)、【探究三】碳酸钠溶液与稀盐酸的分步反应
【查阅资料】向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应.
丁同学向106g质量分数为10%的碳酸钠溶液中逐滴加入质量分数为3.65%的稀盐酸,生成二氧化碳的质量变化如图2所示(不考虑CO2的溶解).
A→C 段发生反应的化学方程式为.
(8)、若B 点横坐标为150,则其纵坐标为.19. 金属钴(Co)在国防工业中有重要应用.某矿石中含钴的氧化物(CoO、Co2O3).研究人员在实验室用硫酸酸浸的方法提取钴元素,并探究最佳提取条件。(1)、写出下列化合物中 Co元素的化合价:CoO , Co2O3.(2)、酸浸时钴的氧化物发生如下反应:反应Ⅰ
反应Ⅱ
反应Ⅲ Co
①反应后溶液中含钴元素的微粒是(填化学符号).
②已知反应前矿石中CoO的质量为 ag,Co2O3的质量为 bg,则理论上可以生成CoSO4g(用含 a、b的式子表示).
(3)、为探究最佳提取条件,将矿石在一定条件下酸浸4 小时,测量钴元素的浸出率,部分数据如下:编号
矿石用量(g)
硫酸用量(g)
Na2SO3 用量(g)
温度(℃)
钴元素浸出率(%)
1
85.71
12.62
0
85
56.39
2
85.71
6.31
0
85
49.98
3
85.71
6.31
0
65
43.33
4
85.71
6.31
0.43
65
73.95
5
85.71
6.31
0.86
65
74.77
①本实验研究了哪些因素对钴元素浸出率的影响?;
②根据上表数据,其他条件不变,温度升高,钴元素的浸出率;
③工业生产中采用实验(填编号)的提取条件更合理.
五、计算题
-
20. 某兴趣小组为了测定某稀硫酸样品的溶质质量分数,进行了如下实验:取200g该样品加入烧杯中,向烧杯中逐渐加入溶质质量分数为8%的氢氧化钠溶液,测得烧杯中溶液的pH与加入氢氧化钠溶液质量的变化关系如图所示。
 (1)、曲线上a点溶液溶质的化学式为。(2)、曲线上b点所含的离子是。(3)、求稀硫酸样品的溶质质量分数?(写出计算过程)
(1)、曲线上a点溶液溶质的化学式为。(2)、曲线上b点所含的离子是。(3)、求稀硫酸样品的溶质质量分数?(写出计算过程)