人教版化学九年级下册随堂练习第九单元课题3 《溶质的质量分数》(提升卷)
试卷更新日期:2025-11-14 类型:同步测试
一、选择题
-
1. 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中正确的是( ).
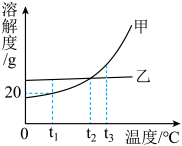 A、甲的溶解度比乙大 B、t2℃时,甲、乙的溶液中溶质的质量分数相等 C、t1℃时,将50g水加入15g甲物质中,可得到65g溶液 D、要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法2. 硝酸钾的溶解度随温度升高而增大.如图是有关硝酸钾溶液的实验操作及变化情况.下列说法正确的是( ).
A、甲的溶解度比乙大 B、t2℃时,甲、乙的溶液中溶质的质量分数相等 C、t1℃时,将50g水加入15g甲物质中,可得到65g溶液 D、要使接近饱和的乙溶液转化为饱和溶液,可采用蒸发溶剂的方法2. 硝酸钾的溶解度随温度升高而增大.如图是有关硝酸钾溶液的实验操作及变化情况.下列说法正确的是( ). A、操作Ⅰ一定是降温 B、操作Ⅰ一定是加溶质 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等3. 如图为Na2SO4与NaCl的溶解度曲线,下列说法正确的是
A、操作Ⅰ一定是降温 B、操作Ⅰ一定是加溶质 C、①与③的溶质质量一定相等 D、②与③的溶质质量分数一定相等3. 如图为Na2SO4与NaCl的溶解度曲线,下列说法正确的是 A、30℃时,Na2SO4的溶解度为41 B、P点表示该温度下,两饱和溶液中溶质质量相等 C、20℃时,Na2SO4饱和溶液的溶质质馓分数为19.5% D、若氯化钠中含有少量硫酸钠,则提纯氯化钠的方式为蒸发结晶,趁热过滤,洗涤,干燥4. 如图是、和的溶解度曲线。下列说法正确的是
A、30℃时,Na2SO4的溶解度为41 B、P点表示该温度下,两饱和溶液中溶质质量相等 C、20℃时,Na2SO4饱和溶液的溶质质馓分数为19.5% D、若氯化钠中含有少量硫酸钠,则提纯氯化钠的方式为蒸发结晶,趁热过滤,洗涤,干燥4. 如图是、和的溶解度曲线。下列说法正确的是 A、℃时,三种物质的饱和溶液中溶质质量分数最小的是 B、氯化钾的溶解度大于硫酸镁 C、将℃时的饱和溶液缓慢降温至℃,有晶体析出 D、℃时,将40g加入50g水中充分搅拌,可得90g溶液5. 传统的豆腐制作常用卤水来点卤。常见卤水主要是氯化镁、硫酸镁和氯化钠的混合溶液。三种物质的溶解度曲线如图所示。下列说法正确的是
A、℃时,三种物质的饱和溶液中溶质质量分数最小的是 B、氯化钾的溶解度大于硫酸镁 C、将℃时的饱和溶液缓慢降温至℃,有晶体析出 D、℃时,将40g加入50g水中充分搅拌,可得90g溶液5. 传统的豆腐制作常用卤水来点卤。常见卤水主要是氯化镁、硫酸镁和氯化钠的混合溶液。三种物质的溶解度曲线如图所示。下列说法正确的是 A、搅拌可以使卤水中三者溶解度增大 B、时,卤水中的质量一定最大 C、时,将等质量的和固体,配置成饱和溶液,和需要的水质量相同。 D、时,溶液和溶液,它们的溶质质量分数一定相等6. 同学们在实验室中(室温)自制蔗糖晶体的实验过程如图1所示,图2是蔗糖的溶解度曲线,下列有关说法不正确的是
A、搅拌可以使卤水中三者溶解度增大 B、时,卤水中的质量一定最大 C、时,将等质量的和固体,配置成饱和溶液,和需要的水质量相同。 D、时,溶液和溶液,它们的溶质质量分数一定相等6. 同学们在实验室中(室温)自制蔗糖晶体的实验过程如图1所示,图2是蔗糖的溶解度曲线,下列有关说法不正确的是 A、加入水后所得蔗糖溶液的质量是 B、溶解时用玻璃棒搅拌的目的是加速溶解 C、加热后蔗糖溶液中溶质的质量分数增大 D、静置天后结晶出的蔗糖晶体是7. X、Y、Z三种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A、加入水后所得蔗糖溶液的质量是 B、溶解时用玻璃棒搅拌的目的是加速溶解 C、加热后蔗糖溶液中溶质的质量分数增大 D、静置天后结晶出的蔗糖晶体是7. X、Y、Z三种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是 A、三种物质的溶解度由大到小的顺序为:X>Y>Z B、t2℃时,将20gX物质放入50g水中,可得到70g溶液 C、t3℃时,将100gX物质的饱和溶液降温至t2℃,可析出20g晶体 D、t1℃时,分别将X、Y、Z三种物质的饱和溶液升温至t3℃(不考虑溶剂的蒸发),所得溶液中溶质的质量分数的大小关系为:Y>Z>X8. 如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是
A、三种物质的溶解度由大到小的顺序为:X>Y>Z B、t2℃时,将20gX物质放入50g水中,可得到70g溶液 C、t3℃时,将100gX物质的饱和溶液降温至t2℃,可析出20g晶体 D、t1℃时,分别将X、Y、Z三种物质的饱和溶液升温至t3℃(不考虑溶剂的蒸发),所得溶液中溶质的质量分数的大小关系为:Y>Z>X8. 如图是甲、乙两种物质的溶解度曲线。下列有关叙述正确的是 A、甲的溶解度大于乙的溶解度 B、20℃时,甲、乙两种溶液的溶质质量分数相等 C、甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲大于乙 D、将20℃的甲、乙饱和溶液恒温蒸发等质量的水,二者析出晶体的质量一定相等9. 三种硫酸盐Li2SO4、Al2(SO4)3和ZnSO4的溶解度曲线如图所示,下列说法正确的是( )
A、甲的溶解度大于乙的溶解度 B、20℃时,甲、乙两种溶液的溶质质量分数相等 C、甲、乙的饱和溶液从40℃降温到20℃,析出固体质量甲大于乙 D、将20℃的甲、乙饱和溶液恒温蒸发等质量的水,二者析出晶体的质量一定相等9. 三种硫酸盐Li2SO4、Al2(SO4)3和ZnSO4的溶解度曲线如图所示,下列说法正确的是( ) A、Al2(SO4)3的溶解度大于Li2SO4 B、40℃时,将40gZnSO4加入到50g水中,形成饱和溶液 C、将80℃时三种物质的饱和溶液分别降温至20℃,Al2(SO4)3溶液析出晶体的质量最大 D、60℃时,Al2(SO4)3饱和溶液的溶质质量分数为60%10. A、B、C三种物质的溶解度曲线如图所示。下列说法中正确的是( )
A、Al2(SO4)3的溶解度大于Li2SO4 B、40℃时,将40gZnSO4加入到50g水中,形成饱和溶液 C、将80℃时三种物质的饱和溶液分别降温至20℃,Al2(SO4)3溶液析出晶体的质量最大 D、60℃时,Al2(SO4)3饱和溶液的溶质质量分数为60%10. A、B、C三种物质的溶解度曲线如图所示。下列说法中正确的是( ) A、阴影区域中,A、C均处于不饱和状态 B、将t2℃时,A、B、C的饱和溶液降温到t1℃,所得溶液溶质的质量分数:B=C>A. C、将A和B的饱和溶从t2℃降温到t1℃时,析出晶体关系为A>B D、t1℃时,将50g固体A加入到200g水中,所得溶液的质量分数为16.7%
A、阴影区域中,A、C均处于不饱和状态 B、将t2℃时,A、B、C的饱和溶液降温到t1℃,所得溶液溶质的质量分数:B=C>A. C、将A和B的饱和溶从t2℃降温到t1℃时,析出晶体关系为A>B D、t1℃时,将50g固体A加入到200g水中,所得溶液的质量分数为16.7%二、填空题
-
11. 某实验团队的老师给同学们三种物质a、b、c,要求他们测出不同温度下各自的溶解度并作出其溶解度曲线图(如图所示)。请回答下列问题:
 (1)、P点的含义。(2)、t2℃时,a、b、c三种物质溶解度从小到大的顺序为。(3)、若物质a中含有少量的b,提纯a最好采用(填“降温结晶”或“蒸发结晶”)方法。(4)、将t2℃时等质量的a、b、c三种物质的饱和溶液降温到t1℃,所得到的溶液的溶质质量分数由大到小的顺序为(填“b>a>c”或“b>a=c”)。12. 同学们开展自制“纸树开花”的项目式学习。下图分别为网购“纸树开花”的效果图和使用说明。
(1)、P点的含义。(2)、t2℃时,a、b、c三种物质溶解度从小到大的顺序为。(3)、若物质a中含有少量的b,提纯a最好采用(填“降温结晶”或“蒸发结晶”)方法。(4)、将t2℃时等质量的a、b、c三种物质的饱和溶液降温到t1℃,所得到的溶液的溶质质量分数由大到小的顺序为(填“b>a>c”或“b>a=c”)。12. 同学们开展自制“纸树开花”的项目式学习。下图分别为网购“纸树开花”的效果图和使用说明。
已知该“魔法水”是磷酸二氢钾(KH2PO4)饱和溶液(纸树对KH2PO4饱和溶液吸水快,KH2PO4结晶快、晶体颗粒大)。
请回答下列问题:
(1)、“魔法水”的溶剂是。(2)、同等操作条件下,开“花”效果更好的天气是(选填“雨天”或“晴天”)。(3)、KH2PO4与另一种物质甲的溶解度曲线如下图所示(KH2PO4在不同温度下的溶解度数值列于其曲线上方)。
①配制20℃时100gKH2PO4的饱和溶液需称量KH2PO4的质量为(精确到0.1g)。
②下列说法中正确的是(填序号)。
a.t1℃时KH2PO4和甲两种物质溶液中溶质的质量分数相等
b.B点对应的甲溶液降温至t1℃,变为A点对应的甲溶液
c.将KH2PO4不饱和溶液降低温度,溶质的质量分数可能会减小
d.10℃时,若m克10%的KH2PO4溶液蒸发掉0.5m克水,溶质质量分数变为20%
13. 将30g氧化锌样品加入稀硫酸中(杂质不溶于水,也不与酸反应,杂质中不含锌元素),实验过程测得数据如下,请回答下列问题。 (1)、写出发生反应的化学方程式;(2)、向反应后所得滤液中加入75.7g水,所得溶液溶质质量分数为。(3)、若用质量分数98%的浓硫酸配制实验所用的稀硫酸,则需要98%的浓硫酸的质量为;(4)、稀释过程中用到的仪器有玻璃棒,其中玻璃棒的作用有_______(填选项);A、搅拌,使热量及时散失 B、搅拌,加速溶解 C、搅拌,使混合均匀(5)、若工业上用300t上述氧化锌样品(假设炼制过程中没有损失),能炼出含锌50%的铜锌合金的质量为t。14. 依据物质的溶解度可以进行溶液配制、物质分离和制备等,表中数据是四种物质在部分温度下的水中的溶解度(g):
(1)、写出发生反应的化学方程式;(2)、向反应后所得滤液中加入75.7g水,所得溶液溶质质量分数为。(3)、若用质量分数98%的浓硫酸配制实验所用的稀硫酸,则需要98%的浓硫酸的质量为;(4)、稀释过程中用到的仪器有玻璃棒,其中玻璃棒的作用有_______(填选项);A、搅拌,使热量及时散失 B、搅拌,加速溶解 C、搅拌,使混合均匀(5)、若工业上用300t上述氧化锌样品(假设炼制过程中没有损失),能炼出含锌50%的铜锌合金的质量为t。14. 依据物质的溶解度可以进行溶液配制、物质分离和制备等,表中数据是四种物质在部分温度下的水中的溶解度(g):10℃
20℃
30℃
40℃
50℃
60℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
NH4Cl
33.3
37.2
41.4
45.8
50.4
55.3
NH4HCO3
15.8
21.0
27.0
﹣﹣﹣
﹣﹣﹣
﹣﹣﹣
NaHCO3
8.1
9.6
11.1
12.7
14.5
16.4
回答下列问题:
(1)、20℃时,NaCl饱和溶液中溶质质量分数为(写算式)。(2)、将接近饱和的NH4Cl溶液变为饱和溶液,可采用的一种方法是。(3)、Na+、Cl-、NH、HCO四种离子可以组成四种物质NaCl、NH4HCO3、NH4Cl、NaHCO3。20℃时在NaCl和NH4HCO3均达饱和的混合溶液中,会析出(填化学式)晶体。(4)、下列说法中不正确的是_______。A、20℃时配制等质量的四种物质的饱和溶液,需水质量最小的是NaHCO3 B、提纯含少量氯化钠的氯化铵,可先以其配制60℃氯化铵饱和溶液,再降温结晶 C、30℃以上无法测得NH4HCO3溶解度数据,是因为此时NH4HCO3已发生分解 D、60℃的NH4Cl、NaHCO3饱和溶液分别降温到10℃,NaHCO3结晶效率更高15. 溶液在日常生活、工农业生产和科学研究中应用广泛。(1)、碘酒用于消毒杀菌,其溶剂是(填化学式)。(2)、甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。
① 图中P点表示的含义是。
② t1℃时,将丙溶液由N点状态转化为M点状态的方法是。
③ t2℃时,将30g甲物质加入50g水中,充分溶解后,所得溶液的质量为g。
④ t2℃时,将甲、乙、丙三种物质的饱和溶液同时降温至t1℃,所得溶液中溶质质量分数由大到小的顺序为。
三、实验探究题
-
16. 40℃时,将等质量的甲、乙固体分别放入各盛有100g水的两个烧杯中,充分搅拦后并降温至20℃,现象如左图所示,有关甲和乙的溶解度曲线如图所示。
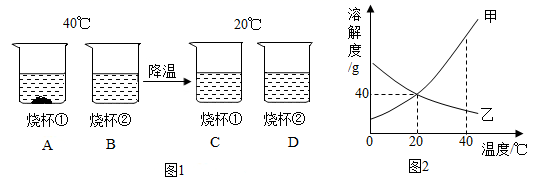 (1)、左上图中一定属于饱和溶液的是(填序号),烧杯①中溶解的溶质是(填甲或乙)(2)、20℃时140g甲的饱和溶液稀释成10%的溶液,需加水g;(3)、下列有关说法错误的是
(1)、左上图中一定属于饱和溶液的是(填序号),烧杯①中溶解的溶质是(填甲或乙)(2)、20℃时140g甲的饱和溶液稀释成10%的溶液,需加水g;(3)、下列有关说法错误的是A 上图中A中上层溶液中溶质质量分数>B中溶液溶质质量分数
B 上图中B,C,D烧杯里的溶液都可能是饱和溶液
C 从甲、乙的饱和溶液中提纯乙可采用升温的方法
D 甲、乙的饱和溶液分别从40℃降温到20℃,得到的溶液中溶质质量分数相等
E 20℃时可用40%乙溶液稀释成10%的溶液
17. 如图是 A,B,C 三种固体物质的溶解度曲线,请回答下列问题。 (1)、P 点的含义是。(2)、t1℃时,A,B,C三种固体物质的溶解度由大到小依次是。(3)、t2℃时,分别向 100g 的水中加入 30gA、30gB 和 30gC, 形成不饱和溶液的是。(4)、当 B 中混有少量的 A 时,可用的方法提纯 B。(5)、将 t2℃时等质量的 A,B,C 的饱和溶液降温到 t1℃,则下列说法正确的是(填序号)。
(1)、P 点的含义是。(2)、t1℃时,A,B,C三种固体物质的溶解度由大到小依次是。(3)、t2℃时,分别向 100g 的水中加入 30gA、30gB 和 30gC, 形成不饱和溶液的是。(4)、当 B 中混有少量的 A 时,可用的方法提纯 B。(5)、将 t2℃时等质量的 A,B,C 的饱和溶液降温到 t1℃,则下列说法正确的是(填序号)。A 溶质质量分数:A<C
B 溶剂质量:A>B
C 溶质质量:A>C
D 溶液质量:B>C
18. 水是一种重要的资源. (1)、电解水实验揭示了水的组成,图1实验中得到氧气的试管是(填“1”或“2”)(2)、自来水厂净水过程中用到活性炭,其作用是 .(3)、海水淡化可缓解岛礁饮水匮乏的问题.图2为太阳能海水淡化装置示意图.请用分子的观点解释:水变成①水蒸气的过程中,不发生变化的是(填字母序号).
(1)、电解水实验揭示了水的组成,图1实验中得到氧气的试管是(填“1”或“2”)(2)、自来水厂净水过程中用到活性炭,其作用是 .(3)、海水淡化可缓解岛礁饮水匮乏的问题.图2为太阳能海水淡化装置示意图.请用分子的观点解释:水变成①水蒸气的过程中,不发生变化的是(填字母序号).A、分子种类
B、分子间隔
C、分子的化学性质.
②利用该装置将一定量的海水暴晒一段时间后,剩余海水中氯化钠的质量分数会(填“变大”、“变小”或“不变”)
 (4)、生活中鉴别硬水和软水可以用;如果出现现象的为硬水.长期饮用硬水对身体有害,生活中我们可以采取方法将其软化.19. 分析处理图表中的信息是学习化学的一种重要方法.(1)、下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
(4)、生活中鉴别硬水和软水可以用;如果出现现象的为硬水.长期饮用硬水对身体有害,生活中我们可以采取方法将其软化.19. 分析处理图表中的信息是学习化学的一种重要方法.(1)、下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:温度/℃
10
20
30
40
溶解度/g
氯化钠
35.8
36.0
36.3
36.6
碳酸钠
12.2
21.8
39.7
53.2
①40℃时,氯化钠的溶解度为 g.
②碳酸钠的溶解度随温度的升高而(填“增大”或“减小”).在20℃时,将100g的水加入30g碳酸钠中,充分搅拌后得到的是 (填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30℃,该溶液的溶质质量分数为 (计算结果精确到0.1%).
(2)、将足量的稀盐酸加入一定量的铁、铜混合物中,写出其中反应的化学方程式 . 如图是实验过程生成气体或剩余固体的质量随反应时间的变化关系,其中表示正确的是 (填标号).
四、计算题
-
20. 实验室取 34g 过氧化氢溶液和 lg 二氧化锰混合制取氧气,充分反应后,称量反应容器内剩余物质的总质量为 34.2g。求:
(1)充分反应后,生成氧气的质量为 g;
(2)该过氧化氢溶液中溶质的质量分数。