人教版化学九年级下册随堂练习第九单元课题2 《溶解度》(提升卷)
试卷更新日期:2025-11-14 类型:同步测试
一、选择题
-
1. 将某碳酸饮料拧开,倒入装有冰块的杯中,如图。下列分析合理的是
 A、拧开瓶盖后,二氧化碳溶解度变大 B、产生气泡的原因是饮料与冰发生化学反应 C、冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液 D、图中现象能说明二氧化碳溶解度与压强、温度的关系2. 水是常见的溶剂。“果蔬洗盐”是一种果蔬清洁剂,某“果蔬洗盐”的部分标签如图1所示,配料中物质的溶解度曲线如图2所示。下列说法正确的是( )
A、拧开瓶盖后,二氧化碳溶解度变大 B、产生气泡的原因是饮料与冰发生化学反应 C、冒泡刚结束时,饮料仍然是二氧化碳的饱和溶液 D、图中现象能说明二氧化碳溶解度与压强、温度的关系2. 水是常见的溶剂。“果蔬洗盐”是一种果蔬清洁剂,某“果蔬洗盐”的部分标签如图1所示,配料中物质的溶解度曲线如图2所示。下列说法正确的是( ) A、取15g“果蔬洗盐”放入1kg20℃的水中,形成的溶液是NaCl的饱和溶液 B、任取“果蔬洗盐”溶液中的各部分,清洗果蔬的效果不一样 C、提纯含有少量Na2CO3的NaCl样品,可用溶解→蒸发→过滤的方法,其中过滤要在40℃左右进行 D、20℃时,NaHCO3的饱和溶液溶质质量分数为10%3. 二氧化碳溶于水可得到气泡水,制作气泡水的最佳条件是A、低温低压 B、低温高压 C、高温高压 D、高温低压4. 下列关于溶液的说法正确的是A、溶液都是无色澄清透明的液体 B、均一稳定的液体一定是溶液 C、溶液中可以有多种溶质 D、饱和溶液就是不能继续溶解任何溶质的溶液5. 一块体积为V%的木块漂浮于装有硝酸钾(KNO3)溶液(有部分硝酸钾固体未溶解)的小烧杯中,如图甲所示。当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开水的体积V排随时间发生的变化如图乙所示。下列有关说法正确的是
A、取15g“果蔬洗盐”放入1kg20℃的水中,形成的溶液是NaCl的饱和溶液 B、任取“果蔬洗盐”溶液中的各部分,清洗果蔬的效果不一样 C、提纯含有少量Na2CO3的NaCl样品,可用溶解→蒸发→过滤的方法,其中过滤要在40℃左右进行 D、20℃时,NaHCO3的饱和溶液溶质质量分数为10%3. 二氧化碳溶于水可得到气泡水,制作气泡水的最佳条件是A、低温低压 B、低温高压 C、高温高压 D、高温低压4. 下列关于溶液的说法正确的是A、溶液都是无色澄清透明的液体 B、均一稳定的液体一定是溶液 C、溶液中可以有多种溶质 D、饱和溶液就是不能继续溶解任何溶质的溶液5. 一块体积为V%的木块漂浮于装有硝酸钾(KNO3)溶液(有部分硝酸钾固体未溶解)的小烧杯中,如图甲所示。当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开水的体积V排随时间发生的变化如图乙所示。下列有关说法正确的是 A、甲图中的硝酸钾溶液处于不饱和状态 B、由图乙推断温度改变的方式是升温 C、M点时烧杯底部没有硝酸钾固体 D、V排增大过程中,硝酸钾溶液的溶质质量分数减小6. 下列图像能正确表示其对应关系的是A、
A、甲图中的硝酸钾溶液处于不饱和状态 B、由图乙推断温度改变的方式是升温 C、M点时烧杯底部没有硝酸钾固体 D、V排增大过程中,硝酸钾溶液的溶质质量分数减小6. 下列图像能正确表示其对应关系的是A、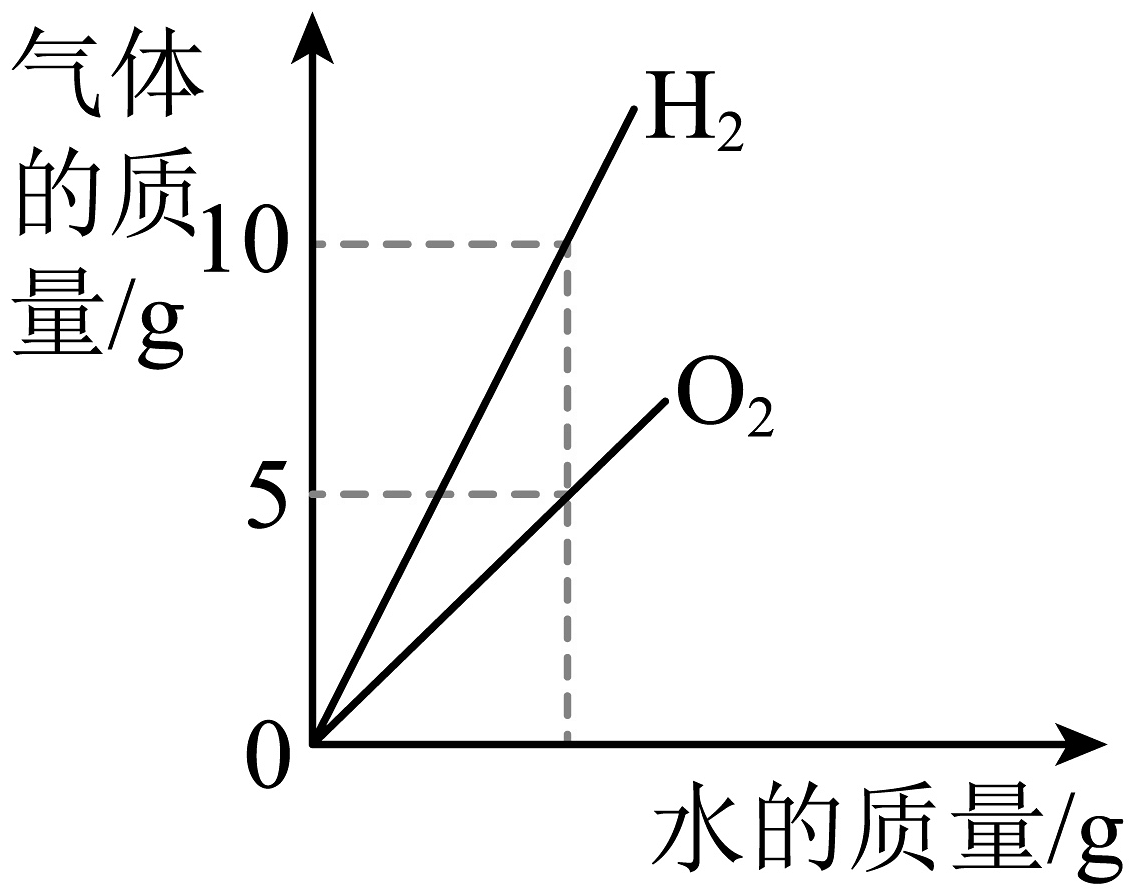 水在通电的条件下反应
B、
水在通电的条件下反应
B、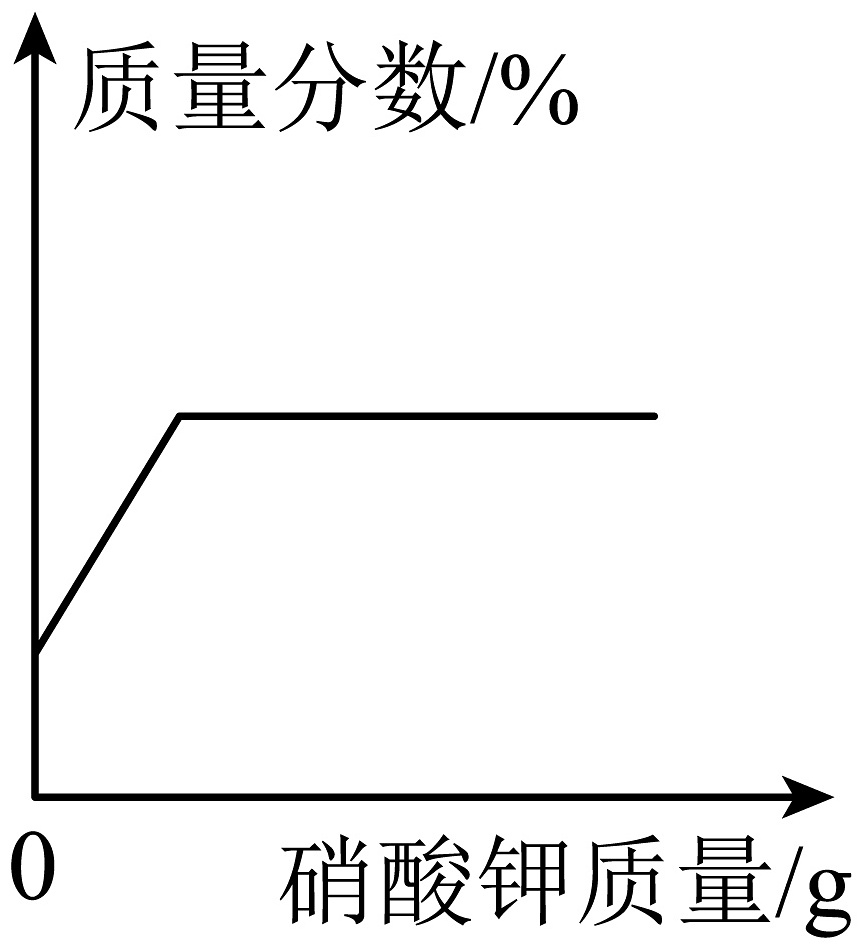 一定温度下,向接近饱和的硝酸钾溶液中加入硝酸钾
C、
一定温度下,向接近饱和的硝酸钾溶液中加入硝酸钾
C、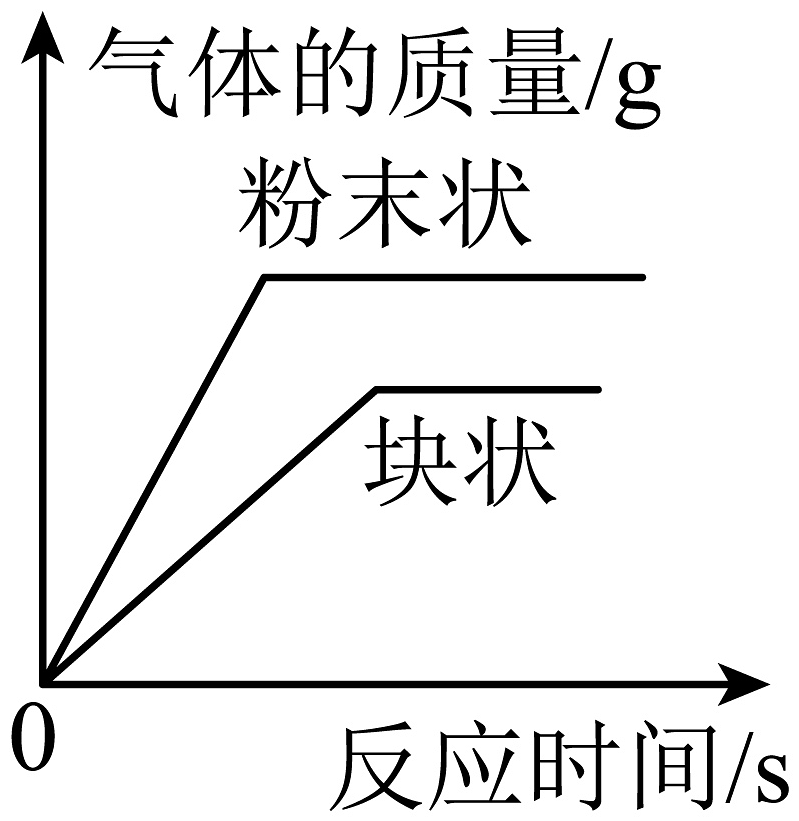 等质量的CaCO3分别与足量的质量分数相同的稀盐酸反应
D、
等质量的CaCO3分别与足量的质量分数相同的稀盐酸反应
D、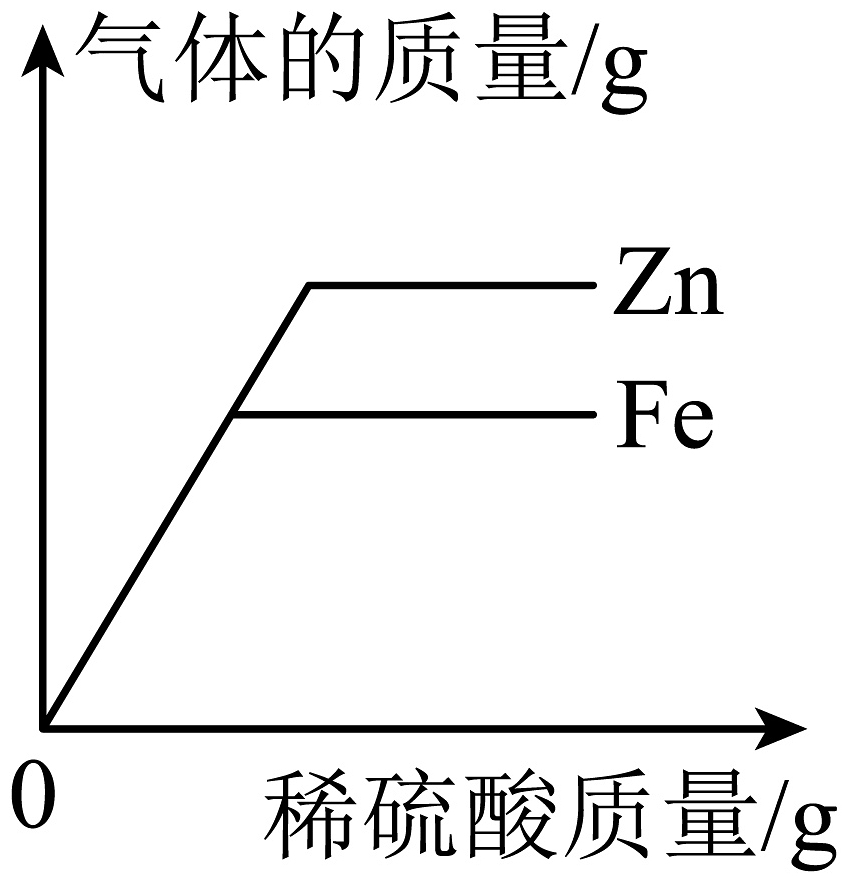 常温下,相同质量的锌和铁分别与足量质量分数相同的稀硫酸反应
常温下,相同质量的锌和铁分别与足量质量分数相同的稀硫酸反应
提示:①Zn+H2SO4=ZnSO4+H2↑ ②Fe + H2SO4 = FeSO4 + H2↑7. 下列说法不合理的是A、氯化钠溶液中存在钠离子、氯离子和水分子 B、电解氢氧化钠的稀溶液,得到氢气和氧气的质量比为2:1 C、氯化钠易溶于水不溶于植物油,是因为水分子与油分子对 Na+ 、Cl- 的作用不同 D、其他条件不变,增加溶剂能使饱和溶液变成不饱和溶液8. 碳酸钠和氯化钠的溶解度曲线如图所示,下列说法错误的是 A、氯化钠的溶解度随温度升高而增大 B、b点表示t2℃时碳酸钠和氯化钠的溶解度相等 C、t1℃时,将20g氯化钠放入50g水中,充分溶解后得到70g溶液 D、t3℃时,可通过升高温度的方法使接近饱和的碳酸钠溶液变为饱和溶液9. 下列图像能正确反映其对应关系的是
A、氯化钠的溶解度随温度升高而增大 B、b点表示t2℃时碳酸钠和氯化钠的溶解度相等 C、t1℃时,将20g氯化钠放入50g水中,充分溶解后得到70g溶液 D、t3℃时,可通过升高温度的方法使接近饱和的碳酸钠溶液变为饱和溶液9. 下列图像能正确反映其对应关系的是 A、①表示电解水 B、②向两份质量相等且溶质质量分数相同的稀硫酸中分别加入足量的锌粉和锌粉 C、③表示一定的温度时,向饱和溶液中加入固体并搅拌 D、④表示等质量、等质量分数的过氧化氢溶液完全分解10. 下列设计的实验方案能达到实验目的的是
A、①表示电解水 B、②向两份质量相等且溶质质量分数相同的稀硫酸中分别加入足量的锌粉和锌粉 C、③表示一定的温度时,向饱和溶液中加入固体并搅拌 D、④表示等质量、等质量分数的过氧化氢溶液完全分解10. 下列设计的实验方案能达到实验目的的是


 A、探究不同催化剂对分解速率的影响 B、探究同种物质在不同溶剂中的溶解性 C、探究合金及其成分金属的熔点高低 D、探究燃烧的条件与氧气的浓度有关
A、探究不同催化剂对分解速率的影响 B、探究同种物质在不同溶剂中的溶解性 C、探究合金及其成分金属的熔点高低 D、探究燃烧的条件与氧气的浓度有关二、实验探究题
-
11.
某购物平台有自制碳酸饮料的设备出售,与该设备一同出售的还有二氧化碳弹,用设备将其“打”入水中,便可形成碳酸饮料。小组同学购买后制备碳酸饮料进行实验,探究影响溶解能力的因素。
【活动一】探究温度和压强对溶解能力的影响
实验1:标准大气压下,向试管中分别加入所购设备自制的无色碳酸饮料 , 大烧杯中加入不同温度的水,小烧杯中加入适量澄清石灰水。
实验装置
实验序号
大烧杯中水的温度
试管中产生气泡的速率
澄清石灰水的现象

实验①
0℃
缓慢
不浑浊
实验②
20℃
适中
不浑浊
实验③
90℃
很快
变浑浊
(1)由实验1得到的结论是:温度升高,二氧化碳的溶解能力(填“变大”“变小”或“不变”),小组同学建议:制好碳酸饮料后,应(填“低温”“高温”或“常温”)保存。
实验2:室温下,向试管中分别加入自制无色碳酸饮料(针筒体积为)。
实验装置
实验序号
注射器活塞的位置
试管中的产生气泡的速率

实验④
不拉动活塞
适中
实验⑤
向上拉活塞到
变快
实验⑥
向上拉活塞到
变得更快
(2)由实验2可知,压强越大,溶解的量越(填“多”或“少”);小组同学推测所购设备的作用是 , 使得二氧化碳能大量溶解于水中,形成碳酸饮料。
【活动二】探究在不同物质中的溶解性
实验3:烧瓶中收集的气体,分别加入不同液体,通过压强传感器测定瓶中压强变化(实验前烧瓶内压强为 , 实验过程中保持温度恒定)
实验操作
实验序号
烧瓶中气体
注射器中物质
实验后瓶内压强

实验⑦
空气
水
实验⑧
水
实验⑨
盐酸
实验⑩
小苏打的水溶液
(3)实验⑦的作用是。
(4)实验后瓶内的压强,实验⑧小于实验⑦,其原因是(答一个原因)。
(5)比较实验⑧、⑨、⑩的数据,可得出在三种液体中溶解能力的关系是(合理即可)。
12. 为了探究影响物质溶解性的因素,小林设计并进行了如下实验。(1)、探究溶质的种类对物质溶解性的影响。在实验中要改变的因素是。
要保持不变的因素是、、溶质的质量。
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:相同温度,相同溶剂的条件下, 。
(2)、探究温度(以硝酸钾为例)对物质溶解性的影响。在实验中要改变的因素是;要保持不变的因素是溶质的种类(硝酸钾)和质量、。
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论:。
13. 水是生命的源泉,也是不可缺少的资源。
①如图电解水实验,写出该反应的化学方程式 , 1处产生的气体是。
②该实验的主要目的是验证水由组成。
③我区华亭大米远近闻名,选种时可用一定浓度的食盐水浸泡选种。现要配制浓度为16%的食盐水50kg,需要称量氯化钠kg。
④下表是KNO3、NaCl 在不同温度下的部分溶解度数据(单位:g/100g 水),请回答问题:
温度(℃)
10
20
40
60
80
KNO3
20.9
31.6
63.9
110
169
NaCl
35.8
36
36.6
37.3
38.4
Ⅰ. 60℃时,KNO3溶解度是。将70g的硝酸钾加入到50g 水中,所得溶液的质量是g。
Ⅱ. 60℃时,KNO3的饱和溶液中含有少量NaCl,通过方法获得较纯净的KNO3晶体。
Ⅲ. 根据表中数据,请在坐标图中描点、绘制符合KNO3 溶解度变化规律的曲线。

Ⅳ. 40℃时,向两个分别盛有相同质量的硝酸钾和氯化钠的烧杯中,各加入100g 水,充分溶解后,恢复至40℃,其结果如图所示。下列有关说法中,错误的是(填字母编号)。
A烧杯①中溶解的是NaCl,烧杯②中溶解的是KNO3
B烧杯②中溶液肯定是不饱和溶液
C使烧杯①中固体全部溶解可以增加溶剂
D若将烧杯①中的溶液变为不饱和溶液,溶液中溶质质量分数一定减小
14. 硝酸钾、氯化钾的溶解度曲线如图1所示。 (1)、P点的含义是。(2)、当温度时,氯化钾的溶解度大于硝酸钾的溶解度。(3)、t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 , 其溶液的溶质质量分数为(结果精确到0.1%)。(4)、图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为。(5)、下列有关说法错误的是。
(1)、P点的含义是。(2)、当温度时,氯化钾的溶解度大于硝酸钾的溶解度。(3)、t2℃时,分别将30g硝酸钾和氯化钾加入到50g水中,充分溶解后一定形成饱和溶液的是 , 其溶液的溶质质量分数为(结果精确到0.1%)。(4)、图2是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为。(5)、下列有关说法错误的是。A①与②的溶质质量可能相等
B②与③的溶质质量分数一定相等
C等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
三、填空题
-
15. A、B、C、D四个烧杯分别盛有质量相等的同种溶剂,在相同的温度下,向四个烧杯中加入20g、15g、10g、5g的相同某固体溶质,充分溶解后(如图所示),回答下列问题(填序号)。
 (1)、A、B、C、D四个烧杯中盛的一定是饱和溶液;中盛的可能是饱和溶液;中盛的一定是不饱和溶液。(2)、如果溶质是硝酸钾,将饱和溶液变为不饱和溶液可以(写一种),在一定温度下,向A、B中分别加入相同质量的溶剂,B中固体刚好溶解,A中固体(填“能”或“不能”)完全溶解。(3)、丙烯酸乙酯存在于菠萝等水果中。请计算填空:
(1)、A、B、C、D四个烧杯中盛的一定是饱和溶液;中盛的可能是饱和溶液;中盛的一定是不饱和溶液。(2)、如果溶质是硝酸钾,将饱和溶液变为不饱和溶液可以(写一种),在一定温度下,向A、B中分别加入相同质量的溶剂,B中固体刚好溶解,A中固体(填“能”或“不能”)完全溶解。(3)、丙烯酸乙酯存在于菠萝等水果中。请计算填空:①丙烯酸乙酯由种元素组成。
②丙烯酸乙酯中碳、氢元素、氧元素的原子个数比为。
③丙烯酸乙酯中碳、氢元素质量比为。
④丙烯酸乙酯中氧元素的质量分数为。
16. 化学物质与人类的生产、生活密切相关。(1)、食盐的主要成分是氯化钠,氯化钠是由(填“分子”、“原子”或“离子”)构成的。(2)、碘酒的主要作用是用来抑制和杀灭细菌、病毒等。碘酒的溶剂是。(3)、金刚石、石墨都是碳元素组成的单质,但它们的物理性质有很大的差异,其根本原因是。(4)、洗涤剂可以清洗掉盘子上的油污,洗涤剂起到作用。(5)、如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,根据如图回答下列问题。
①P点的含义是。
②大量的b中混有少量的a,提纯b的方法为。
17. 根据如图A、B、C三种固体的溶解度曲线回答: (1)、要使C的饱和溶液成为不饱和溶液,可采用的方法有。(2)、B的溶解度曲线较平,要从含有B的饱和溶液中得到的B晶体,通常采用的方法是。(3)、t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为(结果精确至0.1%)。(4)、将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数最小的是(填序号)。
(1)、要使C的饱和溶液成为不饱和溶液,可采用的方法有。(2)、B的溶解度曲线较平,要从含有B的饱和溶液中得到的B晶体,通常采用的方法是。(3)、t1℃时,将15gA加入到装有50g水的烧杯中,充分搅拌,所得溶液的溶质质量分数为(结果精确至0.1%)。(4)、将t2℃时三种物质的饱和溶液分别降温到t1℃,所得溶液中溶质的质量分数最小的是(填序号)。四、流程题
-
18. 易溶于水,某科研小组用粗锰粉(含Mn及少量Fe,Ni,Pb等单质)为原料制备部分实验过程如下:
 (1)、“酸溶”时,将粗锰研磨成粗锰粉的原因是。(2)、操作1和操作2相同,均为。(3)、分解生成的同时产生一种常见的液体,该反应的化学反应式为。(4)、是否可循环物质(填“是”或“否”)。(5)、操作2之后,发现此时不达标而达标。根据下表数据推测二者溶解性的大小关系是: (填“>”或“<”)。流程中各步骤对杂质离子的去除情况如下表:
(1)、“酸溶”时,将粗锰研磨成粗锰粉的原因是。(2)、操作1和操作2相同,均为。(3)、分解生成的同时产生一种常见的液体,该反应的化学反应式为。(4)、是否可循环物质(填“是”或“否”)。(5)、操作2之后,发现此时不达标而达标。根据下表数据推测二者溶解性的大小关系是: (填“>”或“<”)。流程中各步骤对杂质离子的去除情况如下表:初始浓度/mg·L-1
酸浸后/mg·L-1
除铁后/mg∙L-1
操作2后/mg∙L-1
4.95
3.80
3.76
3.19(未达标)
5.86
3.39
3.38
0.12(达标)
19. 二甲基亚矾(DMSO)产品用途广泛,具有较好的经济效益。生产DMSO过程中产生的工业废渣主要含NaNO3及少量有毒的NaNO2 , 以该废渣为原料制备农用KNO3的工艺流程如下: (1)、步骤Ⅱ中,需要加入KCl固体。已知40℃时KCl的溶解度为40g,则该温度下KCl饱和溶液的溶质质量分数为(结果保留到0.1%)。(2)、步骤Ⅲ中,加热至90℃时发生反应:NaNO3+KCl=KNO3+NaCl↓。结合下图溶解度曲线,分析该反应能发生的原因是。
(1)、步骤Ⅱ中,需要加入KCl固体。已知40℃时KCl的溶解度为40g,则该温度下KCl饱和溶液的溶质质量分数为(结果保留到0.1%)。(2)、步骤Ⅲ中,加热至90℃时发生反应:NaNO3+KCl=KNO3+NaCl↓。结合下图溶解度曲线,分析该反应能发生的原因是。 (3)、步骤Ⅲ中,趁热过滤的目的是 , 得到的滤液1一定是(填“KNO3”或“NaCl”)的饱和溶液。(4)、步骤Ⅳ得到的KNO3粗品,还应在常温下进行洗涤、干燥,则最佳的洗涤剂为________(填标号)。A、蒸馏水 B、饱和的NaCl溶液 C、饱和的KNO3溶液
(3)、步骤Ⅲ中,趁热过滤的目的是 , 得到的滤液1一定是(填“KNO3”或“NaCl”)的饱和溶液。(4)、步骤Ⅳ得到的KNO3粗品,还应在常温下进行洗涤、干燥,则最佳的洗涤剂为________(填标号)。A、蒸馏水 B、饱和的NaCl溶液 C、饱和的KNO3溶液五、计算题
-
20. 100克t℃10%的硝酸钾溶液,加10克硝酸钾晶体可以使溶液达到饱和,问:(1)、恒温蒸发多少克水可析出晶体2克?(2)、t℃硝酸钾的溶解度是多少?