浙江省海宁市硖石中学2025-2026学年九年级上学期11月期中考试科学试题(到第3章)
试卷更新日期:2025-11-10 类型:期中考试
一、选择题(本题有15小题,每小题3分,共45分。)
-
1. 科学实验要规范操作,下列实验操作你认为正确的是( )A、
 B、
B、 C、
C、 D、
D、 2. 第19届杭州亚运会顺利闭幕,下列说法不正确的是( )A、亚运火炬“薪火”的主要燃料是甲醇(CH3OH),利用了甲醇的可燃性 B、主体育场屋面采用的新材料铝镁锰板合金,属于有机合成材料 C、主体育场的“花瓣”钢结构造型采用压弯成型技术,利用了金属的延展性 D、亚运会开闭幕式首次使用“数字烟花”代替“实物烟花”,体现了绿色环保理念3. 如图所示用大小相等的拉力F,分别沿光滑的斜面和粗糙的水平面拉同一木箱使其在F的作用下移动的距离 对比这两种情况,下列说法正确的是( )
2. 第19届杭州亚运会顺利闭幕,下列说法不正确的是( )A、亚运火炬“薪火”的主要燃料是甲醇(CH3OH),利用了甲醇的可燃性 B、主体育场屋面采用的新材料铝镁锰板合金,属于有机合成材料 C、主体育场的“花瓣”钢结构造型采用压弯成型技术,利用了金属的延展性 D、亚运会开闭幕式首次使用“数字烟花”代替“实物烟花”,体现了绿色环保理念3. 如图所示用大小相等的拉力F,分别沿光滑的斜面和粗糙的水平面拉同一木箱使其在F的作用下移动的距离 对比这两种情况,下列说法正确的是( ) A、AB段F做功较多 B、AB段与CD段F做的功一样多 C、CD段F做功较多 D、无法比较AB段与CD段F做功的多少4. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
A、AB段F做功较多 B、AB段与CD段F做的功一样多 C、CD段F做功较多 D、无法比较AB段与CD段F做功的多少4. 如图,甲和乙分别是氢气和一氧化碳还原氧化铜的实验,下列有关说法正确的是( )
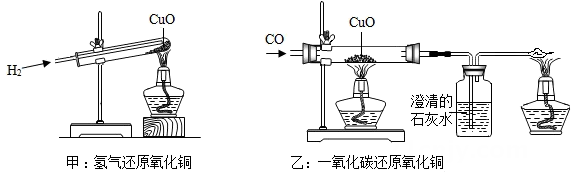 A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应5. 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
A、甲实验试管口向下倾斜可防止氢气逸出 B、乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 C、甲、乙两实验中,都应先通入气体,再用酒精灯加热试管、玻璃管,以防止发生爆炸 D、甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应5. 要使如图装置中的小气球鼓起来,则使用的固体和液体可以是( )
①石灰石和稀盐酸 ②固体氢氧化钠和水 ③硝酸铵固体和水 ④铜和稀硫酸
A、①②③④ B、①② C、①②④ D、②③④6. 某研究性学习小组为了探究氢氧化钠溶液与稀硫酸是否恰好完全反应,分别取少量反应后的溶液于试管中,用下表中的不同试剂进行实验。下列选项说法错误的是( )选项
所用试剂
现象和结论
A
氯化钡溶液
出现白色沉淀,则硫酸一定过量
B
酚酞试液
呈无色,则可能恰好完全反应
C
硫酸铜溶液
出现蓝色沉淀,则氢氧化钠一定过量
D
锌粒
无气泡,则可能恰好完全反应
A、A B、B C、C D、D7. 如图所示的情境中,做功的是 ( ) A、图甲:人提水桶水平移动 B、图乙:运动员举着杠铃不动 C、图丙:足球飞向空中后踢球的力 D、图丁:石头被撬起的过程中手向下压撬棍的力8. 2020年6月23日,我国成功发射第55颗北斗导航卫星,如图甲所示是北斗卫星在随火箭加速上升的情景。人造地球卫星沿椭圆轨道绕地球运行时,离地球最近的一点叫近地点,最远的一点叫远地点,如图乙所示。下列说法正确的是( )
A、图甲:人提水桶水平移动 B、图乙:运动员举着杠铃不动 C、图丙:足球飞向空中后踢球的力 D、图丁:石头被撬起的过程中手向下压撬棍的力8. 2020年6月23日,我国成功发射第55颗北斗导航卫星,如图甲所示是北斗卫星在随火箭加速上升的情景。人造地球卫星沿椭圆轨道绕地球运行时,离地球最近的一点叫近地点,最远的一点叫远地点,如图乙所示。下列说法正确的是( ) A、北斗卫星上升过程中,重力势能变大,动能变小 B、人造地球卫星运行时,重力势能变大,动能变大 C、人造地球卫星从近地点向远地点运动时,速度减小 D、图甲、乙中卫星的机械能都不变9. 有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3中的一种。为区分这四种溶液,现将它们两两混合并得到下列现象:
A、北斗卫星上升过程中,重力势能变大,动能变小 B、人造地球卫星运行时,重力势能变大,动能变大 C、人造地球卫星从近地点向远地点运动时,速度减小 D、图甲、乙中卫星的机械能都不变9. 有甲、乙、丙、丁四种无色溶液,它们分别是HCl、H2SO4、BaCl2、Na2CO3中的一种。为区分这四种溶液,现将它们两两混合并得到下列现象:溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
根据上述现象可推知甲、乙、丙、丁四种溶液依次是 ( )
A、HCl、BaCl2、H2SO4、Na2CO3 B、H2SO4、HCl、BaCl2、Na2CO3 C、HCl、H2SO4、BaCl2、Na2CO3 D、H2SO4、Na2CO3、HCl、BaCl210. 某兴趣小组进行实验探究,向盛有硝酸亚铁和硝酸银混合液的烧杯中加入一定量的锌粉、反应停止后过滤,向滤渣中加入稀盐酸,有气泡产生。下列说法正确的是( )A、滤液中一定含有 Zn2+和Fe2+ , 一定没有 Ag+ B、滤液中一定含有Zn2+ , 一定没有Fe2+和Ag+ C、滤渣中一定含有银,可能含有锌和铁 D、滤渣中一定含有银和铁,可能含有锌11. 小敏学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如下图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中颜色不正确的是 A、紫色 B、蓝色 C、红色 D、无色12. 氢氧化铯是一种可溶性碱,其化学式为CsOH ,则下列叙述中正确的是 ( )A、CsOH 溶液的pH小于 7 B、CsOH 和CuO能发生化学反应 C、CsOH 溶液能使酚酞试液变蓝, D、CsOH 中铯(Cs)元素的化合价为+113. 将一只乒乓球从O点由静止释放,竖直下落撞击到升降台上,弹起的最高点为M;若只将升降台升高至图乙位置,乒乓球下落弹起后到达的最高点为N,不计碰撞过程中的能量损失。则N点( )
A、紫色 B、蓝色 C、红色 D、无色12. 氢氧化铯是一种可溶性碱,其化学式为CsOH ,则下列叙述中正确的是 ( )A、CsOH 溶液的pH小于 7 B、CsOH 和CuO能发生化学反应 C、CsOH 溶液能使酚酞试液变蓝, D、CsOH 中铯(Cs)元素的化合价为+113. 将一只乒乓球从O点由静止释放,竖直下落撞击到升降台上,弹起的最高点为M;若只将升降台升高至图乙位置,乒乓球下落弹起后到达的最高点为N,不计碰撞过程中的能量损失。则N点( ) A、在M点的下方 B、与M点重合 C、在M点和O点之间 D、与O点重合14. 通过监测溶液pH和温度的变化情况可探究稀盐酸和氢氧化钠溶液的反应,如图甲所示为反应过程中溶液pH的变化曲线,如图乙所示为反应过程中溶液温度的变化曲线。下列说法正确( )
A、在M点的下方 B、与M点重合 C、在M点和O点之间 D、与O点重合14. 通过监测溶液pH和温度的变化情况可探究稀盐酸和氢氧化钠溶液的反应,如图甲所示为反应过程中溶液pH的变化曲线,如图乙所示为反应过程中溶液温度的变化曲线。下列说法正确( ) A、d点所示溶液,其中的阳离子只有Na+ B、恰好完全反应时,消耗稀盐酸的体积为40mL C、f点对应溶液的pH为7 D、c点和g点对应溶液蒸发结晶后,得到固体成分不相同15. 在中国科技馆的展厅里,摆着一个如图所示,叫做“最速降线”的展品:两个并排轨道的起点高度一样,终点高度也一样;一个是倾斜的直轨道,另一个是向下弯曲的弧形轨道。将甲、乙两个完全相同的小球同时分别从直轨道和弧形轨道的起点释放,弧形轨道上的乙球先到达终点。若不计一切摩擦阻力,则关于两小球从起点至终点的运动过程中,下列说法正确的是( )
A、d点所示溶液,其中的阳离子只有Na+ B、恰好完全反应时,消耗稀盐酸的体积为40mL C、f点对应溶液的pH为7 D、c点和g点对应溶液蒸发结晶后,得到固体成分不相同15. 在中国科技馆的展厅里,摆着一个如图所示,叫做“最速降线”的展品:两个并排轨道的起点高度一样,终点高度也一样;一个是倾斜的直轨道,另一个是向下弯曲的弧形轨道。将甲、乙两个完全相同的小球同时分别从直轨道和弧形轨道的起点释放,弧形轨道上的乙球先到达终点。若不计一切摩擦阻力,则关于两小球从起点至终点的运动过程中,下列说法正确的是( ) A、乙球的重力势能先变小后变大 B、甲球的机械能大于乙球的机械能 C、重力对甲球做的功大于重力对乙球做的功 D、重力对甲球做功的功率小于重力对乙球做功的功率
A、乙球的重力势能先变小后变大 B、甲球的机械能大于乙球的机械能 C、重力对甲球做的功大于重力对乙球做的功 D、重力对甲球做功的功率小于重力对乙球做功的功率二、填空题(本题有7 小题,每空2分,共40分)
-
16. 纯净的二氧化硅是现代光学及光纤制品的基本原料。(1)、二氧化硅的化学性质极稳定,氢氟酸(HF)是唯一可以与之发生反应的酸(生成物为H2O和SiF4气体),该反应的化学方程式为。(2)、二氧化硅与碳酸钙在高温下反应生成硅酸钙(CaSiO3)和二氧化碳。据此事实可以判断,碳酸钙和硅酸钙热稳定性更好的是17. 日常生活、社会发展都与科学密切相关。(1)、在新农村建设中,提倡“大力发展沼气,改变农村环境”,沼气的主要成分是。(2)、硫酸是重要的化工原料,用途非常广泛。用于除铁锈(主要成分为Fe2O3)时,反应结束后所得溶液的颜色是。(3)、我国科研人员成功研制出一种纳米纤维可将二氧化碳转化成某种液体燃料,其微观示意图如图所示,写出反应方程式。
 18. 回答与常见的酸有关的问题:(1)、胃液中有助于消化的酸是;(2)、通过一次性实验来验证稀硫酸与碱能反应,选用适宜的碱是____(填序号)。A、NaOH溶液 B、KOH溶液 C、Fe(OH)3 D、Cu(OH)2(3)、向盛有稀盐酸的烧杯中加入适量的某种固体与之反应,反应前后烧杯内溶液中主要离子种类及个数比例变化如图所示,则加入的固体可能是下列中的(选填序号)。
18. 回答与常见的酸有关的问题:(1)、胃液中有助于消化的酸是;(2)、通过一次性实验来验证稀硫酸与碱能反应,选用适宜的碱是____(填序号)。A、NaOH溶液 B、KOH溶液 C、Fe(OH)3 D、Cu(OH)2(3)、向盛有稀盐酸的烧杯中加入适量的某种固体与之反应,反应前后烧杯内溶液中主要离子种类及个数比例变化如图所示,则加入的固体可能是下列中的(选填序号)。
①铁 ②碳酸钠 ③氧化铁 ④氢氧化镁
19. 引体向上是某市体育学业水平测试项目,如图,臂力小的小明情助弹力带进行训练、他用脚蹬弹力带,弹力带对他施加一个向上的力。随着小明身体上升,弹力带对他向上的力的大小变化情况是;在此过程中,弹力带的能转化为小明的重力势能,其实质是弹力带对他的过程。 20. 如图为四旋翼无人机,质量为1.2千克,下方悬挂着一个质量为0.1千克的摄像机。在10秒内无人机从地面竖直上升了20米,然后边摄像边斜向上飞行了30秒,仪表盘上显示离地高度为36米。无人机前10秒对摄像机做功焦,无人机后30秒对摄像机做功焦,整个过程中,无人机对摄像机做功的功率为瓦。
20. 如图为四旋翼无人机,质量为1.2千克,下方悬挂着一个质量为0.1千克的摄像机。在10秒内无人机从地面竖直上升了20米,然后边摄像边斜向上飞行了30秒,仪表盘上显示离地高度为36米。无人机前10秒对摄像机做功焦,无人机后30秒对摄像机做功焦,整个过程中,无人机对摄像机做功的功率为瓦。 21. 根据下面部分金属的活动性顺序回答下列问题。
21. 根据下面部分金属的活动性顺序回答下列问题。 (1)、我国第四套人民币的一元硬币为钢芯镀镍(Ni)合金,已知 Ni 能够发生如下反应: 根据金属活动性顺序,写出 Ni 与CuSO4溶液发生置换反应的化学方程式:。(2)、选择铸造硬币的材料不需要考虑的因素是____(填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、已知:③Y 与稀硫酸不反应,则X、Y、Z三种金属的活动性由强到弱的顺序为。22. 科学兴趣小组研究酸碱反应时利用稀硫酸、氢氧化钠溶液、紫色石蕊指示剂进行实验,实验操作和溶液颜色变化如下图所示。
(1)、我国第四套人民币的一元硬币为钢芯镀镍(Ni)合金,已知 Ni 能够发生如下反应: 根据金属活动性顺序,写出 Ni 与CuSO4溶液发生置换反应的化学方程式:。(2)、选择铸造硬币的材料不需要考虑的因素是____(填序号)。A、金属的导电性 B、金属的耐腐蚀性 C、金属的硬度 D、金属价格与硬币面值的吻合度(3)、已知:③Y 与稀硫酸不反应,则X、Y、Z三种金属的活动性由强到弱的顺序为。22. 科学兴趣小组研究酸碱反应时利用稀硫酸、氢氧化钠溶液、紫色石蕊指示剂进行实验,实验操作和溶液颜色变化如下图所示。 (1)、从微观角度分析,该反应的实质是。(2)、根据乙图颜色的变化,判断图甲中B溶液是。(填写溶液名称)(3)、图乙中M点时,溶液中除紫色石蕊外还存在的溶质有。
(1)、从微观角度分析,该反应的实质是。(2)、根据乙图颜色的变化,判断图甲中B溶液是。(填写溶液名称)(3)、图乙中M点时,溶液中除紫色石蕊外还存在的溶质有。三、实验与探究题(本题有5小题,每小题8分,共40分)
-
23. 在研究锌和铜的金属活动性顺序时,小科用锌片与5%的硫酸铜溶液反应,发现实验现象不明显。小科用锌片与5%的氯化铜溶液反应,发现有红色物质析出,并且有气体产生。是什么原因导致了该反应现象的差异呢?
【问题提出】从微观角度分析,硫酸铜、氯化铜溶液中,只是所含酸根不同。
【提出猜想】
猜想①: Cl-能促进锌和Cu2+的反应, 2-对反应无影响。
猜想②:Cl-对反应无影响,2-有抑制锌和Cu2+反应的作用。
猜想③: Cl-能促进锌和Cu2+的反应, 2-2有抑制锌和Cu2+反应的作用。
【实验探究】
组别
试管中的物质
反应现象
反应片刻后添加固体试剂
添加试剂后的实验现象
1
5%CuCl2溶液5mL锌片1g
有大量的红色物质析出,且有大量气泡产生。
无明显改变
2
5%CuSO4液5mL锌片1g
锌片边缘有很少量红色物质析出,有少量气泡逸出。
1gNaCl
明显加快
3
5%CuSO4液5mL锌片1g
锌片边缘有很少量红色物质析出,有少量气泡逸出。
无明显改变
(1)、为了保证实验结论的准确性,实验前对锌片的处理是 。(2)、根据上述探究,猜想 与实验结果相吻合。(3)、设计第3组实验的目的是 。(4)、经检验所得,锌片和CuCl2、CuSO4溶液反应所放出的气体为氢气。小科查阅资料后得到一个信息:CuCl2和CuSO4溶液都为酸性溶液。根据资料和实验结论可推断出,锌分别与相同H+浓度的稀盐酸、稀硫酸反应,反应比较剧烈的是 。24. 小明对氢氧化钾溶液与稀硫酸反应后溶液中溶质的成分进行了探究(如图)。 (1)、证明氢氧化钾溶液与稀硫酸发生了化学反应的证据是。(2)、探究过程如下:
(1)、证明氢氧化钾溶液与稀硫酸发生了化学反应的证据是。(2)、探究过程如下:【建立猜想】猜想一:只有K2SO4;猜想二:有K2SO4和H2SO4;猜想三:有K2SO4和KOH
【进行实验】为了验证猜想二,小明选用Fe2O3粉末、BaCl2溶液,进行如下探究:
实验方案
实验操作
实验现象
实验结论
方案一
取少量反应后的溶液于试管中,加入Fe2O3粉末
溶液中有H2SO4 , 猜想二正确
方案二
取少量反应后的溶液于试管中,滴加BaCl2溶液
产生白色沉淀
溶液中有H2SO4 , 猜想二正确
①表格空白处的实验现象是:。
②对方案二的结论进行评价:。
(3)、【表达交流】方案一中的Fe2O3粉末可以用下列的某些物质代替,也能得到同样的实验结论。还可以选择的试剂有____。A、Mg B、CuO C、NaCl D、Al2O325. 某科学研究小组以“有机物中碳、氢元素的质量分数测定”为课题进行了如下的实验设计。一定量样品和氧气混合气经过灼热的铜网时被充分氧化,产生二氧化碳和水蒸气。经B、C、D装置可以测得产生的二氧化碳和水蒸气的质量,进而推知样品中碳和氢元素的质量分数。 (1)、产生的二氧化碳和水蒸气是否被充分吸收,会影响碳、氢元素的含量测定。研究小组的成员查找到了下列有关数据,试图了解吸收剂的吸收性能。如表是20℃时,1m3空气中经下列吸收剂吸收后水蒸气残留的克数:
(1)、产生的二氧化碳和水蒸气是否被充分吸收,会影响碳、氢元素的含量测定。研究小组的成员查找到了下列有关数据,试图了解吸收剂的吸收性能。如表是20℃时,1m3空气中经下列吸收剂吸收后水蒸气残留的克数:吸收剂
浓硫酸
固体
CuSO4固体
硅胶固体
CaO固体
NaOH 固体
残留质量
0.003
0.0005
1.4
0.03
0.2
0.14~0.25
根据上述数据,你认为吸收水蒸气时,最理想的吸收剂是 。
(2)、C中的试剂为硫酸铜固体,B、D装置中的试剂也为固体,你认为研究小组在这一实验中,D中的试剂为.(3)、某同学用上图装置测定维生素C中元素组成(可能含有氧元素),取维生素C样品研碎称取0.352g。生成物完全被吸收,测得装置B、D两者分别增重0.144g和0.528g。则样品中碳的质量分数为 , 维生素C中还含有的元素有26. 如图,在“研究物体的动能与哪些因素有关”的实验中,将A、B、C三个小球先后从同一装置的hA、hB、hC高处滚下推动纸盒运动一段距离后静止。 (1)、在此实验中通过观察什么来比较三个小球动能大小?;(2)、要研究动能与质量的关系,我们应选择两图来进行比较;(3)、让质量不同的A、C两钢球从同一高度滚下是为了;(4)、为了让质量不同的B、C两球获得相同的初速度,有同学设计了如图d装置,只要每次让两球压缩弹簧到同样的形变程度后自然释放即可。不考虑各种能量损耗,该方法是否合理并说明原因:。27. 实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验:
(1)、在此实验中通过观察什么来比较三个小球动能大小?;(2)、要研究动能与质量的关系,我们应选择两图来进行比较;(3)、让质量不同的A、C两钢球从同一高度滚下是为了;(4)、为了让质量不同的B、C两球获得相同的初速度,有同学设计了如图d装置,只要每次让两球压缩弹簧到同样的形变程度后自然释放即可。不考虑各种能量损耗,该方法是否合理并说明原因:。27. 实验室有一瓶敞口放置的氢氧化钠固体样品,为探究样品中的成分,小科进行如下实验: (1)、操作①是加水充分溶解,操作②的名称是。(2)、沉淀B的化学式是。(3)、小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由。(4)、经过讨论,同学们认为小科的实验需要将滴加的其中一种试剂进行更换,如何更换?。
(1)、操作①是加水充分溶解,操作②的名称是。(2)、沉淀B的化学式是。(3)、小科根据实验现象认为样品中一定含有氢氧化钠,请你评价小科的判断是否正确,并说明理由。(4)、经过讨论,同学们认为小科的实验需要将滴加的其中一种试剂进行更换,如何更换?。四、综合题(本题有5 小题,共35 分)
-
28. 《天工开物》记载了锡的冶炼方法:入砂(指锡砂)数百斤,丛架木炭亦数百斤,鼓鞲(指鼓入空气)熔化,用铅少许,(锡)沛然流注。其反应原理为(1)、上述反应属于化学基本反应类型中的反应。(2)、炼锡时加入少许铅形成合金,产物更易熔化流出,原因是。(3)、现有151kg含SnO220%的锡砂,理论上可以炼出锡的质量是多少?(写出计算过程)29. 某固体混合物中可能含有氢氧化钡、硝酸钠、硫酸钠、碳酸钠。为了研究该混合物的成分,某同学按下列流程进行了实验(各步均恰好完全反应),根据流程图回答问题:
 (1)、根据实验现象推断该混合物中一定含有的物质是(填化学式)。(2)、该同学为了进一步确定固体混合物的组成,取样品20.9g,按上述流程图进行实验:产生11.65g白色沉淀A,产生2.2g气体W。通过计算,判断并确定该混合物中所含物质的成分及其质量。30. 某跳伞运动员从飞机上跳下,沿竖直方向降落,一段时间后打开降落伞,最后安全着地。已知运动员和跳伞设备的总重力为700 N,跳伞过程中下降的速度与时间的关系如图甲所示:
(1)、根据实验现象推断该混合物中一定含有的物质是(填化学式)。(2)、该同学为了进一步确定固体混合物的组成,取样品20.9g,按上述流程图进行实验:产生11.65g白色沉淀A,产生2.2g气体W。通过计算,判断并确定该混合物中所含物质的成分及其质量。30. 某跳伞运动员从飞机上跳下,沿竖直方向降落,一段时间后打开降落伞,最后安全着地。已知运动员和跳伞设备的总重力为700 N,跳伞过程中下降的速度与时间的关系如图甲所示: (1)、图甲中曲线OA段速度越来越大的原因是。(2)、图乙是跳伞过程中部分阶段的情景及受力示意图,其图甲曲线中CD阶段对应的是。(3)、计算运动员和跳伞设备的总重力在 AB段所做的功和做功功率。31. 急性腹泻会造成人体脱水,可服用补液盐补充水分。某口服补液盐标签如图。
(1)、图甲中曲线OA段速度越来越大的原因是。(2)、图乙是跳伞过程中部分阶段的情景及受力示意图,其图甲曲线中CD阶段对应的是。(3)、计算运动员和跳伞设备的总重力在 AB段所做的功和做功功率。31. 急性腹泻会造成人体脱水,可服用补液盐补充水分。某口服补液盐标签如图。【规格】20g/包, 30包/盒
【成分】每包含葡萄糖1g, NaCl 1.755g, KCl 0.745g, NaHCO3 1.650g
【用量】临用时,将一包补液盐溶于500mL 温水中,一般每日服用3000mL
(1)、该口服补液盐的成分中属于有机物的是。(2)、按照说明书中一天的用量,需要服用6包,则一天由该补液盐补充的钾元素质量是。(3)、科学兴趣小组为鉴定药品中NaHCO3含量是否合规,采用稀盐酸来测定(查资料得知:药品中其他成分不与盐酸反应)。向锥形瓶中加入5包补液盐,然后分6次加入稀盐酸,每次加入稀盐酸后充分反应,且气体全部逸出。已知: 用电子秤测得实验数据如下表:第一次
第二次
第三次
第四次
第五次
第六次
加入稀盐酸的质量/g
50
50
50
50
50
50
反应后瓶中剩余物的总质量/g
149.12
198.24
247.36
296.48
345.60
395.60
通过计算说明该补液盐是否合规。
32. 小敏用稀盐酸和石灰石反应制取二氧化碳(石灰石中的杂质既不溶于水也不和酸反应),为了探究反应后溶液的成分,他又进行如下实验:取反应后的溶液50g于烧杯中,逐滴滴入碳酸钠溶液,发现先有气泡产生,后生成白色沉淀。下表为产生的气体总质量、沉淀总质量与滴入碳酸钠溶液总质量的关系。碳酸钠溶液总质量/g
25.0
50.0
75.0
100.0
125.0
150.0
175.0
200.0
气体总质量/g
1.1
2.2
2.2
2.2
2.2
2.2
2.2
2.2
沉淀总质量/g
0
0
2.5
5.0
m
n
9.0
9.0
(1)、 表中n。(2)、所取的反应后50g溶液中溶质是。(3)、请求出所取的反应后50g溶液中,酸性溶质的质量分数是多少?(写出计算过程)(4)、依据实验事实,请你绘制了溶液的pH随碳酸钠溶液质量变化的曲线,在图中标出合适的数据。