浙江省金华市义乌市春晗学校2025-2026学年第一学期九年级9月作业检测 科学学科( 第1章)
试卷更新日期:2025-10-10 类型:月考试卷
一、选择题(本大题有20小题,每小题3分,共60分)
-
1. “结构决定性质”“性质决定用途”是重要的科学观念。下列物质的用途主要利用某物理性质的是( )A、酒精用作燃料 B、氢氧化铝用于治疗胃酸过多 C、熟石灰用来改良酸性土壤 D、浓硫酸用作干燥剂2. 下列物质所对应的用途不正确的是 ( )A、大理石——用作建筑材料 B、小苏打——焙制糕点 C、氯化钠——配制生理盐水 D、纯碱——除去热水瓶中的水垢3. 氢氧化钠、氢氧化钾和氢氧化钙这三种物质都属于碱。这是因为( )A、它们电离产生的唯一阴离子都是氢氧根离子 B、它们的水溶液都呈碱性 C、它们都含有氢、氧两种元素 D、它们都能溶于水4. 下列食物中酸性最强的是( )A、苹果pH=3.4 B、葡萄 pH=4.5 C、荔枝pH=5.0 D、西瓜 pH=6.35. 规范的实验操作是实验成功的重要保障。下列实验操作正确的是 ( )A、点燃酒精灯
 B、过滤粗盐水
B、过滤粗盐水 C、检验氧气是否集满
C、检验氧气是否集满 D、稀释浓硫酸
D、稀释浓硫酸 6. 用pH试纸测定某溶液的 pH,下列有关说法正确的是( )A、用玻璃棒蘸取待测液,滴在用蒸馏水润湿的pH试纸上,观察颜色变化 B、将pH 试纸浸在待测液中,片刻后取出,观察颜色变化 C、用洁净干燥的玻璃棒蘸取待测液,滴在pH试纸上,把试纸显示的颜色与标准比色卡对比 D、测得该溶液的pH为3.47. 下列物质中属于氮肥的是( )A、KCl B、NH4NO3 C、Ca(H2PO4)2 D、KNO38. 下列物质的化学式、俗名与用途的对应关系正确的是( )
6. 用pH试纸测定某溶液的 pH,下列有关说法正确的是( )A、用玻璃棒蘸取待测液,滴在用蒸馏水润湿的pH试纸上,观察颜色变化 B、将pH 试纸浸在待测液中,片刻后取出,观察颜色变化 C、用洁净干燥的玻璃棒蘸取待测液,滴在pH试纸上,把试纸显示的颜色与标准比色卡对比 D、测得该溶液的pH为3.47. 下列物质中属于氮肥的是( )A、KCl B、NH4NO3 C、Ca(H2PO4)2 D、KNO38. 下列物质的化学式、俗名与用途的对应关系正确的是( )选项
化学式
俗名
用途
A
NaOH
烧碱
治疗胃酸过多
B
Na2CO3
纯碱
干燥剂
C
Ca(OH)2
熟石灰
检验二氧化碳
D
CaCO3
消石灰
和盐酸反应制取二氧化碳
A、A B、B C、C D、D9. 物质的鉴别是重要的实验技能。鉴别下列各组物质所用试剂或方法选择错误的是 ( )选项
需鉴别的物质
试剂或方法
A
铁粉、木炭粉
用磁铁吸引
B
盐酸、氯化钠溶液
硝酸银溶液
C
氧气、二氧化碳气体
用燃着的木条
D
氢氧化钠固体、氯化钠固体
水
A、A B、B C、C D、D10. 如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是( )
A
B
C
D
锥形瓶
MnO2
Zn
H2O
HCl 气体
胶头滴管
H2O2溶液
稀 H2SO4
浓 H2SO4
石灰水
A、A B、B C、C D、D11. 在①氧化铁 ②金属锌 ③氢氧化铜 ④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )A、①②③④ B、①②③ C、①③④ D、②③④12. 黑枸杞素有“花青素之王”的美誉。将黑枸杞浸泡在不同pH的溶液中,呈现颜色情况如图所示。下列生活中常见液体能使黑枸杞浸泡液呈蓝绿色的是( ) A、蒸馏水 B、白醋 C、苏打水 D、食盐水13. 只用一种物质一次就将稀硫酸、食盐水、澄清石灰水三种液体鉴别出来,供选择的是:①pH 试纸、②酚酞试液、③稀盐酸、④碳酸钠溶液,其中能鉴别的是 ( )A、①②④ B、②④ C、①③④ D、①④14. 如图所示两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是( )
A、蒸馏水 B、白醋 C、苏打水 D、食盐水13. 只用一种物质一次就将稀硫酸、食盐水、澄清石灰水三种液体鉴别出来,供选择的是:①pH 试纸、②酚酞试液、③稀盐酸、④碳酸钠溶液,其中能鉴别的是 ( )A、①②④ B、②④ C、①③④ D、①④14. 如图所示两圆相交部分是五种物质中两两之间相互反应的示意图。下列对反应现象的说法中,错误的是( ) A、a 处形成浅绿色溶液 B、b 处形成大量气泡 C、c 处反应放热 D、d 处溶液呈红色15. 在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是( )A、
A、a 处形成浅绿色溶液 B、b 处形成大量气泡 C、c 处反应放热 D、d 处溶液呈红色15. 在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是( )A、 B、
B、 C、
C、 D、
D、 16. 下列离子能在pH=2的无色溶液中大量共存的是( )A、 B、 C、 D、17. 小科利用如图甲所示的装置对盐酸和氢氧化钠溶液反应进行探究,测量结果如图乙和图丙所示。下列说法正确的是( )
16. 下列离子能在pH=2的无色溶液中大量共存的是( )A、 B、 C、 D、17. 小科利用如图甲所示的装置对盐酸和氢氧化钠溶液反应进行探究,测量结果如图乙和图丙所示。下列说法正确的是( ) A、图甲中仪器A盛放的是NaOH溶液 B、图乙中a→d所示溶液中NaCl的质量不断增加 C、图丙中V的数值最接近12 D、图丙中从f→g温度变化趋势可说明该反应是吸热反应18. 主要成分中含有少量杂质,选用试剂检验杂质、除去杂质是科学实验中常见的实际问题。若一种试剂既能检验所含杂质、又能除去杂质,则我们就称其为“高效试剂”。下列选项中不能称为“高效试剂”(所加试剂均适量且忽略分离步骤)的是 ( )
A、图甲中仪器A盛放的是NaOH溶液 B、图乙中a→d所示溶液中NaCl的质量不断增加 C、图丙中V的数值最接近12 D、图丙中从f→g温度变化趋势可说明该反应是吸热反应18. 主要成分中含有少量杂质,选用试剂检验杂质、除去杂质是科学实验中常见的实际问题。若一种试剂既能检验所含杂质、又能除去杂质,则我们就称其为“高效试剂”。下列选项中不能称为“高效试剂”(所加试剂均适量且忽略分离步骤)的是 ( )选项
主要成分
所含的杂质
“高效试剂”
A
HNO3
H2SO4
Ba(NO3)2
B
BaCl2
HCl
BaCO3
C
CaCl2
HCl
Ca(OH)2
D
MgCl2
MgSO4
BaCl2
A、A B、B C、C D、D19. 有甲、乙、丙、丁四种无色溶液,它们分别是Na2CO3、BaCl2、HCl、H2SO4溶液中的一种。为区别这四种溶液,现将它们两两混合并得到下面现象:溶液
甲+乙
乙+丙
丙+丁
甲+丁
现象
无明显现象
白色沉淀
白色沉淀
无色气体
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
A、HCl、BaCl2、Na2CO3、H2SO4 B、Na2CO3、BaCl2、H2SO4、HCl C、H2SO4、HCl、Na2CO3、BaCl2 D、HCl、H2SO4、BaCl2、Na2CO320. 实验废液中可能含有离子 中的几种,为确定可能含有的离子,兴趣小组进行了下面的实验:①取一份废液,加入氯化钡溶液有白色沉淀产生,再加入足量稀盐酸,沉淀无变化;
②另取一份废液,加入氢氧化钾溶液出现白色沉淀,再加入足量稀盐酸,沉淀全部溶解。
分析上面实验得出的结论中,正确的是( )
A、只含有 B、一定含有Cl-、K+ , 可能含有 C、一定含有 可能含有 Cl-、K+ D、一定含有二、填空题(本大题有8小题,每空2分,共46分)
-
21. 观察下列物质的电离方程式:(1)、这三种物质在水中电离出的相同离子是 , 剩余的阴离子称为。(2)、写出H2SO4的酸根离子的符号:。(3)、硝酸、盐酸和硫酸都属于酸,原因是。22. 下列变化中,属于化学变化的是 , 属于物理变化的是。
①自行车轮胎爆裂②鞭炮爆炸③泥浆水静置产生沉淀④铁钉生锈⑤霓虹灯发出有色光⑥从海水中晒出食盐⑦生物的呼吸作用⑧水结成冰 ⑨食物发霉
23. 用符合下列要求的物质的序号填空:①稀硫酸 ②浓盐酸 ③浓硫酸 ④烧碱 ⑤熟石灰
(1)、具有挥发性的是。(2)、可用于干燥二氧化碳气体的是。24. 在科学实验中小明向盛有澄清石灰水的烧杯中逐滴加入氯化铁溶液,有红褐色絮状沉淀产生,至恰好完全反应。(1)、写出该反应的化学方程式:。(2)、完全反应后溶液的pH(填“<”或“=”或“>”)7。(3)、如图“●”“○”“△”表示烧杯内溶液中的不同离子,其中的“△”表示。 25. 如图甲所示为探究铁钉锈蚀条件的实验,如图乙所示为用稀盐酸除铁钉表面铁锈的实验。回答下列问题:
25. 如图甲所示为探究铁钉锈蚀条件的实验,如图乙所示为用稀盐酸除铁钉表面铁锈的实验。回答下列问题: (1)、如图甲所示实验,.若实验结果是试管①③中的铁钉不生锈,试管②中铁钉生锈,则可得出铁钉生锈的条件是铁与接触。(2)、如图乙所示实验,若观察到试管中铁钉变得光亮且表面有气泡生成,则此时溶液中存在的微粒除H+和Cl-外, 还有(不考虑H2O) 。26. “宏观——微观——符号”是化学独特的表示物质及其变化的方法。请用这一方法来完成对性质的研究。
(1)、如图甲所示实验,.若实验结果是试管①③中的铁钉不生锈,试管②中铁钉生锈,则可得出铁钉生锈的条件是铁与接触。(2)、如图乙所示实验,若观察到试管中铁钉变得光亮且表面有气泡生成,则此时溶液中存在的微粒除H+和Cl-外, 还有(不考虑H2O) 。26. “宏观——微观——符号”是化学独特的表示物质及其变化的方法。请用这一方法来完成对性质的研究。 (1)、【宏观现象】在烧杯中先装入少量的 粉末,再加入适量的稀盐酸溶液,可以观察到的现象是。(2)、【微观解释】我们可用如图的模型解释该反应的微观过程,则X代表的微粒为。(3)、【符号表达】请写出该反应的化学方程式。(4)、【拓展】下列物质能证明反应后盐酸有剩余的是( )。A、金属锌 B、酚酗试液 C、碳酸钠溶液 D、硝酸银溶液27. 现有4包白色粉末,编号为B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。
(1)、【宏观现象】在烧杯中先装入少量的 粉末,再加入适量的稀盐酸溶液,可以观察到的现象是。(2)、【微观解释】我们可用如图的模型解释该反应的微观过程,则X代表的微粒为。(3)、【符号表达】请写出该反应的化学方程式。(4)、【拓展】下列物质能证明反应后盐酸有剩余的是( )。A、金属锌 B、酚酗试液 C、碳酸钠溶液 D、硝酸银溶液27. 现有4包白色粉末,编号为B、C、D,他们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,通过下列实验,一一加以鉴别。 (1)、 确定B是硫酸铜,该试管中看到的现象是;(2)、酚酞滴入A溶液中变红色,则A物质是;(3)、将C、D鉴别出来,“?”代表的试剂是。28. 向一瓶久置的氢氧化钾溶液中逐滴加入稀盐酸并振荡,反应过程如图所示。请回答:
(1)、 确定B是硫酸铜,该试管中看到的现象是;(2)、酚酞滴入A溶液中变红色,则A物质是;(3)、将C、D鉴别出来,“?”代表的试剂是。28. 向一瓶久置的氢氧化钾溶液中逐滴加入稀盐酸并振荡,反应过程如图所示。请回答: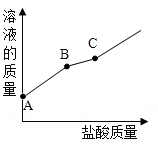 (1)、该氢氧化钾溶液变质程度为(选填“部分变质” 或“全部变质”)。(2)、请写出氢氧化钾变质的原理(用化学方程式表示)。(3)、C点溶液中所含的溶质是(用化学式表示)。
(1)、该氢氧化钾溶液变质程度为(选填“部分变质” 或“全部变质”)。(2)、请写出氢氧化钾变质的原理(用化学方程式表示)。(3)、C点溶液中所含的溶质是(用化学式表示)。三、实验探究题(本大题共有4小题,每空2分,共28分)
-
29. 构建知识网络能帮助我们理解知识间的内在联系,请根据酸碱化学性质的知识网络图(“—”表示物质之间能发生反应)回答下列有关问题:
 (1)、酸、碱都能与①反应,则①为类物质。(2)、请写出一个酸与②反应的化学方程式。(3)、和CO都是非金属氧化物,能与氢氧化钠溶液反应,CO却不能反应,造成此性质差异的微观原因。30. 某食品包装袋中脱氧剂的成分可能含有铁粉、炭粉、碳酸钠、氯化钠、氧化铁中的几种。
(1)、酸、碱都能与①反应,则①为类物质。(2)、请写出一个酸与②反应的化学方程式。(3)、和CO都是非金属氧化物,能与氢氧化钠溶液反应,CO却不能反应,造成此性质差异的微观原因。30. 某食品包装袋中脱氧剂的成分可能含有铁粉、炭粉、碳酸钠、氯化钠、氧化铁中的几种。 (1)、为检验脱氧效果,小科利用一个软塑料瓶设计如图所示实验,观察到现象,说明脱氧效果较好。这是从(填“反应物消失”或“新物质生成”)的视角,验证了该反应的发生。(2)、为确定其成分,小科又进行了如下实验过程:
(1)、为检验脱氧效果,小科利用一个软塑料瓶设计如图所示实验,观察到现象,说明脱氧效果较好。这是从(填“反应物消失”或“新物质生成”)的视角,验证了该反应的发生。(2)、为确定其成分,小科又进行了如下实验过程:
则黄色溶液b一定含有的阳离子是(填离子符号)。
(3)、通过实验,能确定脱氧剂中一定含有的成分是(填化学式)。31. 下列两种方案体现了物质除杂的不同思路:思路一:将杂质直接转化为所需物质;
思路二:将杂质物质转化为中间物质,再将中间物质转化为所需物质。
 (1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。步骤①后,滤液B中一定含有的溶质是。步骤②中加入的甲溶液可以是。
(1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。步骤①后,滤液B中一定含有的溶质是。步骤②中加入的甲溶液可以是。A.碳酸钠溶液 B.氢氧化钠溶液 C.氢氧化钾溶液 D.氢氧化钡溶液
32. 现有一定质量的粗盐样品(含有少量泥沙等不溶性杂质和少量等可溶性杂质)。某实验小组利用实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
请根据提纯步骤回答下列问题:
(1)、步骤⑥中加入过量盐酸的目的是。(2)、实验过程中会产生种沉淀。(3)、步骤②和步骤④不可以颠倒,理由是。(4)、同学提出精盐中的 NaCl 比原来粗盐中的多,简要说明。四、解答题(本大题共有3小题,共26分)
-
33. 图甲是黄铜材质的翻板自封防臭地漏(黄铜的主要成分为铜、锌),其工作原理如图乙所示:利用水对底盖的压力来控制开合,有水时,自动开盖,迅速排水。无水时自动闭合,防臭防虫。
 (1)、黄铜是铜锌合金,有较强的耐腐蚀性,耐腐蚀性属于性质。(2)、为了探究制作地漏所用黄铜的等级,某兴趣小组取制作地漏的黄铜废料进行了实验检测:取样品20g,逐滴加入质量分数为10%的稀硫酸,当加入稀硫酸的质量为98g时,不再有气体产生。通过计算并结合下表判断制作地漏的黄铜属于哪种等级?
(1)、黄铜是铜锌合金,有较强的耐腐蚀性,耐腐蚀性属于性质。(2)、为了探究制作地漏所用黄铜的等级,某兴趣小组取制作地漏的黄铜废料进行了实验检测:取样品20g,逐滴加入质量分数为10%的稀硫酸,当加入稀硫酸的质量为98g时,不再有气体产生。通过计算并结合下表判断制作地漏的黄铜属于哪种等级?黄铜等级
低黄铜
中黄铜
高黄铜
铜的质量分数
60%~80%
80%~90%
高于90%
34. 实验室有一瓶久置的氢氧化钠固体,某科学兴趣小组想了解其是否变质及变质情况,探究如下:【项目一】氢氧化钠是否变质?甲同学取少量固体溶于水后,进行如下实验并得出结论。
方案
实验操作
现象
结论
方案一
取该溶液2毫升于试管中,滴入少量酚酞
变红
没有变质
(1)、乙同学指出方案一不合理,理由是。(2)、【项目二】氢氧化钠是否完全变质?丙同学设计方案二进行探究。方案
实验操作
现象
结论
方案二
①先取该溶液2毫升于试管中,滴入过量氯化钡溶液
溶液变浑浊
②静置后取上层清液放入试管中,滴入酚酞试液
溶液变红色
方案二结论处填写的内容是:。
①处所选药品除氯化钡外,还可滴加 , 分析对应现象也能达成探究目的。(3)、【项目三】氢氧化钠变质程度如何?该同学取瓶中固体按如下方案继续探究。
通过计算,确定所取干燥固体中碳酸钠的质量分数。35. 某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好充全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与反应时间(t)关系如图所示。试回答: (1)、生成CO2的质量为(2)、22.8g样品中氯化钠的质量。(3)、计算所得溶液中溶质的质量分数。
(1)、生成CO2的质量为(2)、22.8g样品中氯化钠的质量。(3)、计算所得溶液中溶质的质量分数。