【浙教版】科学九上2.5 物质的转化 巩固提升练(培优)
试卷更新日期:2025-09-16 类型:同步测试
一、选择题
-
1. 下列各组溶液,不加其他试剂就能鉴别的是 ( )A、Na2CO3、H2SO4、HCl、NaNO3 B、NaOH、NaCl, MgCl2、FeCl3 C、HCl、AgNO3、HNO3、MgCl2 D、K2SO4、Na2CO3、BaCl2、KNO32. 已知A-C为初中常见化学物质,通过一步化学反应可实现如图所示的三种物质间的转化。关于A、B、C之间的转化说法错误的是( )
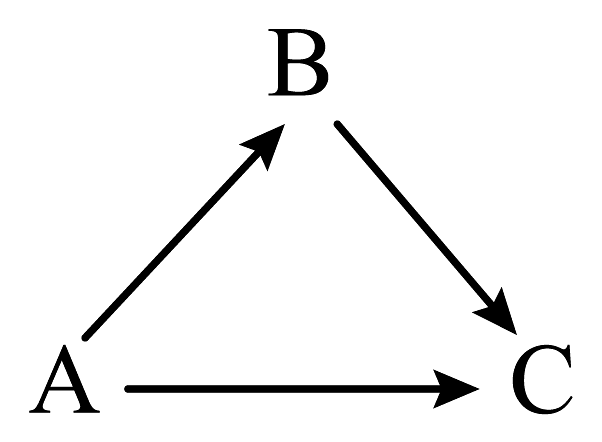 A、A可以作还原剂 B、A、B、C的物质类别可都为单质 C、B→C的反应可能会出现蓝色絮状沉淀 D、A→C的化学反应类型可以是复分解反应3. 某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )
A、A可以作还原剂 B、A、B、C的物质类别可都为单质 C、B→C的反应可能会出现蓝色絮状沉淀 D、A→C的化学反应类型可以是复分解反应3. 某同学为研究相同条件下一氧化碳和氢气哪个还原氧化铁的量更多,将一氧化碳和氢气等体积混合后先通过图甲装置,再通过图乙中的仪器组合。为达到实验目的,图乙中仪器选择和连接最好的是( )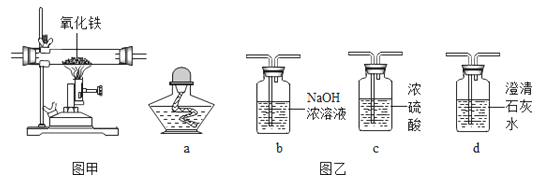 A、cba B、cda C、cbd D、bca4. 下列各组物质中,不能实现如图所示的转化的是( )
A、cba B、cda C、cbd D、bca4. 下列各组物质中,不能实现如图所示的转化的是( )
选项
甲
乙
A.
稀硫酸
B.
NaOH溶液
C.
稀盐酸
溶液
D.
稀硫酸
溶液
A、A B、B C、C D、D5. 黄铁矿的主要成分为二硫化亚铁(FeS2),工业上可利用黄铁矿煅烧的产物冶炼铁和生产浓硫酸,其工业流程如图。下列说法错误的是( ) A、反应①中各元素的化合价均发生了改变 B、反应②是置换反应 C、该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收 D、反应③④为化合反应6. 下列选项所示的物质转化均能一步实现的是( )A、FeFe2O3Fe(OH)3 B、CuOCuSO4CuCl2 C、SSO2H2SO4 D、CO2Na2CO3NaOH7. C,H2 , CO都具有可燃性和还原性.如果C,H2 , CO以一定的质量比分别跟等质量的O2恰好完全应生成CO2或H2O,则C,H2 , CO以同样的质量比分别跟足量的CuO完全反应时,所对应消耗的CuO的质量比为( )A、2:1:1 B、1:2:l C、1:l:2 D、1:1:18. 比较归纳是科学学习中的常用方法。以下的物质转化都由一步反应完成:② 下列说法正确的是 ( )A、三种转化发生的都是复分解反应 B、只有②发生了中和反应 C、三种转化都必须加入盐酸才能进行 D、三种转化的生成物中都有水9. 实验室中区分如表各组物质的方法均正确的是( )
A、反应①中各元素的化合价均发生了改变 B、反应②是置换反应 C、该工业生产过程产生的废气中的SO2可以用熟石灰溶液吸收 D、反应③④为化合反应6. 下列选项所示的物质转化均能一步实现的是( )A、FeFe2O3Fe(OH)3 B、CuOCuSO4CuCl2 C、SSO2H2SO4 D、CO2Na2CO3NaOH7. C,H2 , CO都具有可燃性和还原性.如果C,H2 , CO以一定的质量比分别跟等质量的O2恰好完全应生成CO2或H2O,则C,H2 , CO以同样的质量比分别跟足量的CuO完全反应时,所对应消耗的CuO的质量比为( )A、2:1:1 B、1:2:l C、1:l:2 D、1:1:18. 比较归纳是科学学习中的常用方法。以下的物质转化都由一步反应完成:② 下列说法正确的是 ( )A、三种转化发生的都是复分解反应 B、只有②发生了中和反应 C、三种转化都必须加入盐酸才能进行 D、三种转化的生成物中都有水9. 实验室中区分如表各组物质的方法均正确的是( )选项
需区分的物质
方 法
A
黄铜和黄金
①分别加稀盐酸 ②加热后观察颜色
B
稀盐酸和稀硫酸
①氯化钡溶液 ②紫色石蕊溶液
C
硝酸铵和氯化钠
① 水溶解 ②观察颜色
D
饱和食盐水和蒸馏水
①滴加酚酞溶液 ②各取一滴,在玻璃片上晾干
A、A B、B C、C D、D10. 某固体由、、、、、中的几种离子构成。取一定质量的该固体样品,进行如下实验:①将固体溶于水得无色透明溶液,加入足量溶液过滤后得到5g白色沉淀;②在沉淀中加入过量稀硝酸,仍有3g白色沉淀;③在滤液中滴加溶液,产生白色沉淀。则该固体中一定含有( )A、、、 B、、、 C、、、 D、、、11. 如图各组变化中,每个转化在一定条件下均能一步实现的是 ( ) A、①② B、①③ C、②③ D、①②③12. 工业上可用 K2CO3溶液吸收二氧化碳,化学方程式为 该反应属于( )A、化合反应 B、复分解反应 C、分解反应 D、置换反应13. 小陈在进行CO与Fe2O3反应的实验时,观到如下现象:红色粉末变黑,澄清石灰水变浑浊,硬质玻璃管内固体质量减小,装有澄清石灰水的装置质量增加。对于上述实验现象的分析错误的是( )
A、①② B、①③ C、②③ D、①②③12. 工业上可用 K2CO3溶液吸收二氧化碳,化学方程式为 该反应属于( )A、化合反应 B、复分解反应 C、分解反应 D、置换反应13. 小陈在进行CO与Fe2O3反应的实验时,观到如下现象:红色粉末变黑,澄清石灰水变浑浊,硬质玻璃管内固体质量减小,装有澄清石灰水的装置质量增加。对于上述实验现象的分析错误的是( ) A、一氧化碳具有还原性 B、生成的黑色物质能被磁铁吸引 C、本实验如果要制得5.6gFe,则通入CO的质量要远大于4.2g D、硬质玻璃管内减小的质量等于装有澄清石灰水装置增加的质量14. 金属X与非金属¥可以直接化合成化合物Z。甲、乙两人做X和Y化合的实验,每人所用X和Y的质量各不相同,但总质量是12g,甲、乙所用X和Y的质量和得到的Z的质量如下表:
A、一氧化碳具有还原性 B、生成的黑色物质能被磁铁吸引 C、本实验如果要制得5.6gFe,则通入CO的质量要远大于4.2g D、硬质玻璃管内减小的质量等于装有澄清石灰水装置增加的质量14. 金属X与非金属¥可以直接化合成化合物Z。甲、乙两人做X和Y化合的实验,每人所用X和Y的质量各不相同,但总质量是12g,甲、乙所用X和Y的质量和得到的Z的质量如下表:X的质量/g
Y的质量/g
得到Z的质量/g
甲
8
4
11
乙
7
5
11
则X、Y所发生的反应(化学方程式中省略反应条件)可能是( )
A、2Al+3Cl2=2AlCl3 B、Fe+S=FeS C、2Cu+O2=2CuO D、4Fe+3O2=2Fe2O315. 用100t含氧化铁80%的赤铁矿石,可炼出铁的质量为 ( )A、14t B、20t C、56t D、80t二、填空题
-
16. 某科学兴趣小组欲分离和混合溶液,得到都含单一溶质的两种溶液.他们设计了如图所示的实验流程。

供选试剂:溶液、溶液、溶液、盐酸、稀硫酸
(1)步骤①中,试剂a是。
(2)沉淀B表面残留少量滤液,需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向步骤③的最后一次洗涤液中加入的试剂是(双选,填序号).
A.溶液 B.溶液 C.溶液 D.和混合溶液
17. 某次实验后,废液缸中残留物由稀硫酸、氢氧化钠、碳酸钠和氯化钡等试剂混合而成。同学们讨论后得到共识:上层溶液中一定含有Na+、Cl- , 但对于其他离于还不能确认。为了确定该溶液中所含有的离子,同学们将残留物进行过滤,对滤渣和滤液所做的实验和现象如下:①取少量滤渣于试管中,滴加足量稀盐酸,有气泡产生;
②取少量滤液于试管中,滴加几滴酚酞试液,滤液变红色;
③取少量滤液于试管中,滴加几滴稀硫酸,有白色沉淀产生;
④取少量滤液于试管中,滴加几滴氯化钡溶液,没有沉淀产生。请回答下列问题:
(1)、仅通过步骤①的实验现象,可以确定该废液缸的液体中一定没有的离子是;(2)、小组同学讨论后的共识上层溶液中一定含有Na+、Cl- , 原因是18. 已知D是生活中最常见的液态化合物,G、F、X是单质,通常情况下,E为难溶于水的白色固体,反应⑥为实验室制气体化合物Ⅰ的常用方法,物质间转化关系如图所示,部分产物已略去。温州百优教育请回答下列问题: (1)、反应①~⑦中属于复分解反应的有。(2)、写出反应⑦的实验现象19. 我国不少地方有端午吃“灰水粽”的习俗。所谓“灰水粽”是指用草木灰的浸出液浸泡糯米做成的粽子,清香软糯。草木灰中富含K2CO3 , 可能还含有少量K2SO4和KCl。某兴趣小组为了检验草木灰的成分,开展如下实验:
(1)、反应①~⑦中属于复分解反应的有。(2)、写出反应⑦的实验现象19. 我国不少地方有端午吃“灰水粽”的习俗。所谓“灰水粽”是指用草木灰的浸出液浸泡糯米做成的粽子,清香软糯。草木灰中富含K2CO3 , 可能还含有少量K2SO4和KCl。某兴趣小组为了检验草木灰的成分,开展如下实验:①取适量草木灰于烧杯中,加足量水浸泡,过滤得到草木灰的浸出液。
②取少量浸出液于试管中,向试管中加入少量BaCl2溶液,浸出液中产生白色沉淀。
③将上述溶液过滤,取滤液于另一支试管中,加入少量AgNO3溶液和稀硝酸,滤液中产生白色沉淀。请回答下列问题:
(1)、 请判断步骤②中的实验现象能否说明草木灰中含有 并说明理由: 。(2)、 有同学指出步骤②中加入的 BaCl2溶液会干扰步骤③,应将 溶液换成溶液。20. 数据显示, 目前我国平均每年产生4亿部以上废旧手机,废旧手机回收处理作为“朝阳产业”拥有很大的发展潜力。从废旧手机的某些部件中可以回收银和铜,其操作流程如图所示。 (1)、滤液中一定含有的溶质为。 (填化学式)(2)、步骤Ⅱ加入的适量的X是一种盐,则X是。(3)、金属Y可选用 。 (写一种)21. 有一包白色粉末,可能由NaOH、Na2CO3、BaCl2、K2SO4中的一种或几种组成。为确定其成分,某科学研究小组同学做了如图所示实验。
(1)、滤液中一定含有的溶质为。 (填化学式)(2)、步骤Ⅱ加入的适量的X是一种盐,则X是。(3)、金属Y可选用 。 (写一种)21. 有一包白色粉末,可能由NaOH、Na2CO3、BaCl2、K2SO4中的一种或几种组成。为确定其成分,某科学研究小组同学做了如图所示实验。 (1)、操作Ⅰ是。(2)、白色粉末的成分是。22. 化学反应除四种基本反应类型外,还有一类非常重要的反应——氧化还原反应,请根据所学知识,回答下列问题。(1)、初中的化学反应一定属于氧化还原反应的是____。A、化合反应 B、分解反应 C、置换反应 D、复分解反应(2)、化学反应 , 该反应的氧化剂是 , 还原剂是 , 这个化学反应在初中化学反应的基本类型中属于。
(1)、操作Ⅰ是。(2)、白色粉末的成分是。22. 化学反应除四种基本反应类型外,还有一类非常重要的反应——氧化还原反应,请根据所学知识,回答下列问题。(1)、初中的化学反应一定属于氧化还原反应的是____。A、化合反应 B、分解反应 C、置换反应 D、复分解反应(2)、化学反应 , 该反应的氧化剂是 , 还原剂是 , 这个化学反应在初中化学反应的基本类型中属于。三、实验与探究题
-
23. 用氢气还原氧化铜的方法测定某氧化铜样品的含量(杂质不参与反应),同学们设计了如下实验装置,准确称取10克干燥样品进行实验。
 (1)、实验中,乙装置的作用是。(2)、充分反应后,丁装置的质量增加了1.8克,则样品中含氧化铜的质量分数为。(3)、下列原因,可能会导致测得的氧化铜的质量分数偏大的是。
(1)、实验中,乙装置的作用是。(2)、充分反应后,丁装置的质量增加了1.8克,则样品中含氧化铜的质量分数为。(3)、下列原因,可能会导致测得的氧化铜的质量分数偏大的是。A 样品的质量太多
B 空气中的水分被丁处浓硫酸吸收
C 通入的氢气量不足
D 丁处浓硫酸的质量太多
24. 科学兴趣小组进行稀硫酸化学性质的探究。回答下列问题:(1)将稀硫酸分别加入图中的试管中,无明显现象的是(填字母序号),要证明该试管中已发生了化学反应,以下方案可行的是(填数字序号)。
①滴入酚酞溶液无明显现象 ②测得试管中溶液的小于7
③滴入溶液有白色沉淀出现 ④滴入溶液无蓝色沉淀出现

(2)上述实验结束后,兴趣小组继续探究。
实验步骤
实验现象
步骤1:将试管A中物质全部倒入试管E中
产生气泡且白色沉淀增加
步骤2:过滤,得到滤液
/
步骤3:向滤液中逐滴滴加氢氧化钠溶液
开始无明显现象,一段时间后出现白色沉淀
①步骤2得到的滤液中,一定含有的溶质是(填化学式)。
②步骤3中,产生的白色沉淀是(填化学式)。
25. 一氧化碳通常是通过燃烧碳的方法制备的,制得的一氧化碳中往往含有少量二氧化碳。小滨用这种的不纯的一氧化碳为原料来模拟工业炼铁实验,设计了如图所示的微型实验装置ABCDE 五个部分(夹持设备已略去)。已知: 一氧化碳为有毒气体,为防止刚生成的铁被空气氧化,反应结束后需继续通一会儿气,直至装置冷却。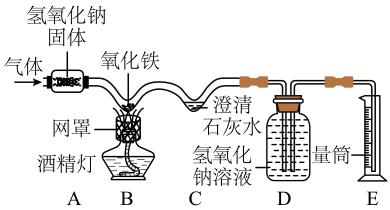 (1)、在实验装置A中,小滨设计放入潮解的氢氧化钠,原因是。(2)、写出B处玻璃管中发生反应的现象:。(3)、C中反应的化学方程式为:。(4)、 装置D的作用是。26. 豆腐是中国传统美食,其制作过程:挑选黄豆→浸泡→磨浆→过滤→煮浆→点浆成型。某兴趣小组想探究点浆时加入的凝固剂成分是什么?
(1)、在实验装置A中,小滨设计放入潮解的氢氧化钠,原因是。(2)、写出B处玻璃管中发生反应的现象:。(3)、C中反应的化学方程式为:。(4)、 装置D的作用是。26. 豆腐是中国传统美食,其制作过程:挑选黄豆→浸泡→磨浆→过滤→煮浆→点浆成型。某兴趣小组想探究点浆时加入的凝固剂成分是什么?【查阅资料】常用凝固剂有 CaSO4、MgCl2
【作出猜想】猜想1: CaSO4 猜想2: MgCl2 猜想3: CaSO4和 MgCl2
(1)、【实验探究】取少量凝固剂,加入足量水配制成溶液,按如下方法进行实验:实验序号
实验步骤
实验现象
实验结论
1
取少量溶液于试管中,滴加硝酸钡溶液
产生白色沉淀
猜想1成立
2
取少量溶液于试管中,滴加足量硝酸钡溶液,静置,取上层清液,滴加__溶液
先有白色沉淀产生,后无明显现象
猜想1成立
(2)、【分析评价】有同学认为实验1不严谨,理由。【拓展延伸】不同凝固剂对豆腐品质的影响如下表:
凝固剂
得豆腐率/%
保水性/%
硬度
耐嚼性
266.45±0.56
77.71±0.26
67.75±0.05
21.78±1.34
123.95±1.33
66.27±2.94
188.44±9.58
81.02±1.12
(3)、南北方的豆腐风味不同。南方豆腐质地软嫩、细腻,可推知南方豆腐常使用的凝固剂是。(4)、下列说法正确的是____(填字母)。A、豆腐含有蛋白质等营养素 B、凝固剂种类与豆腐的品质没有关系 C、使用氯化镁凝固剂制作得豆腐率更高 D、豆腐的硬度越大,豆腐的保水性越差27. 生石灰(氧化钙)是常见的干燥剂,小科对久置的生石灰干燥剂开展了以下探究活动。【提出问题】久置在空气中的生石灰样品的成分是什么?
【做出猜想】可能是CaO、Ca(OH)2、CaCO3中的一种或几种。
【查阅资料】Ca(OH)2在水中微溶,加热到500℃时会发生分解反应,生成CaO和 CaCO3加热到900℃时会发生分解反应,生成CaO和(
【实验探究】小科设计如下实验进行探究。

步骤一:取少量生石灰样品放入烧杯中,加入一定量的水搅拌。
(1)、小科用手触摸烧杯壁,烧杯壁发烫,说明样品中含有。(2)、小科还观察到烧杯①中有不溶物。他认为样品中含有CaCO3 , 小科的这种说法是否正确?请说明理由。步骤二:
(3)、“?”处向烧杯①中加入 , 观察到溶液中有气泡出现,说明样品中有(4)、【拓展延伸】为探究生石灰样品中是否含有 Ca(OH)2 , 请设计一种实验方案(写出实验步骤和判断依据)。四、综合题
-
28. 金属钢的硬度大、熔点高、常温下酎酸䂸腐蚀,是航海、医疗等不可缺少的材料。钛铁矿(主要成分为)是工业冶炼金属钛的主要原料,制备金属钛的工艺流程如图所示。
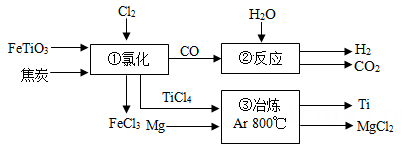 (1)、②的反应方程式为 , 从氧化还原角度分析,这个反应体现了的性。(2)、写出③中制取金属钣的化学反应方程式:。29. 已知 受热易分解,各生成对应的两种氧化物。 的分解温度为66~68℃, CuCO3的分解温度为200~220℃。设固体的组成为 , 小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。请根据图示回答下列问题:
(1)、②的反应方程式为 , 从氧化还原角度分析,这个反应体现了的性。(2)、写出③中制取金属钣的化学反应方程式:。29. 已知 受热易分解,各生成对应的两种氧化物。 的分解温度为66~68℃, CuCO3的分解温度为200~220℃。设固体的组成为 , 小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如右图。请根据图示回答下列问题: (1)、写出CD段发生反应的化学方程式为。(2)、若将 24.0g剩余固体继续加热到更高的温度,发现固体质量少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式为。(3)、通过计算可得a:b=。30. 鉴别5瓶失去标签的溶液:稀盐酸、稀硫酸、NaOH溶液、CuSO4 溶液和BaCl2溶液。(1)、观察5瓶溶液的颜色,溶液呈色的是CuSO4溶液。(2)、取少量四种无色溶液分别放入四支试管中,再分别滴加CuSO4溶液,可鉴别出NaOH溶液和BaCl2溶液。写出CuSO4溶液和NaOH 溶液反应的化学方程式:。(3)、对剩余两瓶溶液如何进行鉴别,请简要写出鉴别方法:。31. 某矿石由和组成,用它制备氢氧化镁的流程如图所示。
(1)、写出CD段发生反应的化学方程式为。(2)、若将 24.0g剩余固体继续加热到更高的温度,发现固体质量少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式为。(3)、通过计算可得a:b=。30. 鉴别5瓶失去标签的溶液:稀盐酸、稀硫酸、NaOH溶液、CuSO4 溶液和BaCl2溶液。(1)、观察5瓶溶液的颜色,溶液呈色的是CuSO4溶液。(2)、取少量四种无色溶液分别放入四支试管中,再分别滴加CuSO4溶液,可鉴别出NaOH溶液和BaCl2溶液。写出CuSO4溶液和NaOH 溶液反应的化学方程式:。(3)、对剩余两瓶溶液如何进行鉴别,请简要写出鉴别方法:。31. 某矿石由和组成,用它制备氢氧化镁的流程如图所示。
【査阅资料】部分氢氧化物形成沉淀时所对应的溶液值,如表所示。
沉淀物
开始沉淀时溶液的值
1.9
4.2
9.1
完全沉淀时溶液的值
3.2
6.7
11.1
(1)、形成溶液A的过程中所涉及的化学方程式:。(写出一个即可)(2)、在溶液A中加入熟石灰后要控制pH在7~9之间是为了除去H+和(填写离子符号)。(3)、溶液B与适量熟石灰反应制得氢氧化镁,过滤时检验沉淀是否洗涤干净,可在最后一次洗涤液中加入(填选项序号)试剂进行判断。①氯化钠 ②碳酸钠 ③碳酸钡 ④稀盐酸
(4)、若不考虑制备过程中原材料的损失,要制得氢氧化镁5.8g,则原矿石中氧化镁至少有g。32. 小明发现实验室有一瓶忘了塞瓶塞的氢氧化钠溶液。为探究该溶液的变质程度并测定溶液中各成分的质量分数,进行了如下实验:Ⅰ.取 20g该溶液,加入过量的氯化钡溶液,过滤,得到滤渣和滤液。将滤渣洗涤、干燥后称量,其质量为1.97g。
Ⅱ.向滤液中逐滴加入质量分数为5%的硫酸镁溶液,生成沉淀的质量与加入硫酸镁溶液的质量关系如图所示。
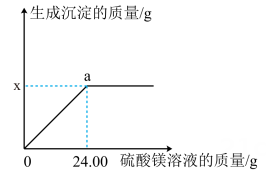 (1)、求该瓶溶液中碳酸钠的质量分数。(2)、小明认为实验Ⅰ中,可用稀硝酸和硝酸银溶液验证滤液中含有氯化钡,你是否同意,并说明理由。(3)、若图中生成沉淀的质量x=2.91,则a点对应的溶液中有种溶质。
(1)、求该瓶溶液中碳酸钠的质量分数。(2)、小明认为实验Ⅰ中,可用稀硝酸和硝酸银溶液验证滤液中含有氯化钡,你是否同意,并说明理由。(3)、若图中生成沉淀的质量x=2.91,则a点对应的溶液中有种溶质。