【浙教版】科学九上 2.2金属的化学性质 巩固提升练
试卷更新日期:2025-09-15 类型:同步测试
一、选择题
-
1. 已知金属M与硫酸铜反应的化学方程式为 则下列分析正确的是( )A、M可能是铝 B、M的金属活动性比铜强 C、M不可能是锌 D、该反应属于复分解反应2. 下列事实中,能用金属活动性解释的是 ( )
①铝制品比铁制品更耐腐蚀 ②用硫酸铜溶液和铁可以制取铜③用稀盐酸可以除铁锈 ④金属铜不能与稀硫酸反应
A、①② B、①②③ C、①②④ D、②④3. 小科发现菜刀长时间不用会生锈,金属在什么情况下容易被锈蚀?小科设计了如图所示实验,放置2~3天,发现只有丙瓶中的铁钉生锈了。下列分析错误的是( ) A、乙瓶中用凉开水的目的是保证瓶内没有氧气 B、铁钉在潮湿的空气中容易生锈 C、为防止菜刀生锈,可将菜刀放在干燥通风处 D、本实验的对照组是甲4. 完成图甲所示的实验后,把a、b两支试管中的物质全部倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤,再向滤渣中加入适量稀盐酸,产生无色气泡。根据上述信息,判断下列说法正确的是()
A、乙瓶中用凉开水的目的是保证瓶内没有氧气 B、铁钉在潮湿的空气中容易生锈 C、为防止菜刀生锈,可将菜刀放在干燥通风处 D、本实验的对照组是甲4. 完成图甲所示的实验后,把a、b两支试管中的物质全部倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤,再向滤渣中加入适量稀盐酸,产生无色气泡。根据上述信息,判断下列说法正确的是() A、滤渣中含有三种固体物质 B、原a、b试管中溶液都一定呈浅绿色 C、滤渣质量一定大于所加铁粉的总质量 D、滤液中一定含有 可能含有5. 小金在已调平的托盘天平左右两盘上各放一个相同质量的烧杯,往烧杯中分别加入相同溶质质量分数的硝酸银溶液,天平再次平衡,如图所示。现往烧杯中分别放入已打磨的相同质量的铁片和铜片。下列相关说法正确的是
A、滤渣中含有三种固体物质 B、原a、b试管中溶液都一定呈浅绿色 C、滤渣质量一定大于所加铁粉的总质量 D、滤液中一定含有 可能含有5. 小金在已调平的托盘天平左右两盘上各放一个相同质量的烧杯,往烧杯中分别加入相同溶质质量分数的硝酸银溶液,天平再次平衡,如图所示。现往烧杯中分别放入已打磨的相同质量的铁片和铜片。下列相关说法正确的是 A、反应一段时间后,天平会失去平衡 B、右盘烧杯中的溶液会逐渐变成黄色 C、反应后取出铁片,铁片总质量变大 D、实验能说明铁的化学性质比铜活泼6. 为研究铁生锈的因素,将铁钉置于不同环境中,一周后生锈最严重的是( )。A、
A、反应一段时间后,天平会失去平衡 B、右盘烧杯中的溶液会逐渐变成黄色 C、反应后取出铁片,铁片总质量变大 D、实验能说明铁的化学性质比铜活泼6. 为研究铁生锈的因素,将铁钉置于不同环境中,一周后生锈最严重的是( )。A、 B、
B、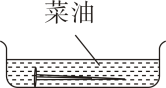 C、
C、 D、
D、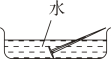 7. 将质量相等的 Mg、 Al、 Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能是图中的 ( )A、
7. 将质量相等的 Mg、 Al、 Zn三种金属分别放入质量和质量分数均相等的三份稀硫酸中,反应结束后,生成氢气的质量关系不可能是图中的 ( )A、 B、
B、 C、
C、 D、
D、 8. 用图像能较清晰地反映化学变化中离子的个数关系。将一定质量的铁片放入某一溶液中(含 和Ag+数量相同),反应一段时间后烧杯内相关离子数量关系可能成立的是 ( )
8. 用图像能较清晰地反映化学变化中离子的个数关系。将一定质量的铁片放入某一溶液中(含 和Ag+数量相同),反应一段时间后烧杯内相关离子数量关系可能成立的是 ( ) A、
A、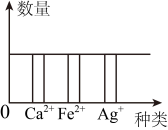 B、
B、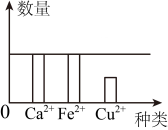 C、
C、 D、
D、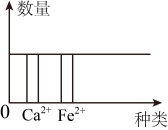 9. 中国科学家成功制备出石墨双炔包覆的锑纳米空心立方盒,可用作钠离子电池负极材料,把纳米销颗粒转化为锑是制备过程中的关键一步, 反应的化学方程式如下:该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应10. 科学兴趣小组对金属R的活动性进行探究时发现:将R 放入稀硫酸中,有气泡产生,同时生成+2价的盐;将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式中,正确的是( )A、 B、 C、 D、11. 以下是某同学对生活中一些现象的解释,其中正确的是( )。A、铁制品表面涂油漆只是为了美观 B、水在标准大气压下的沸点是100℃,所以不管用什么锅煮水,水的温度都不会超过100℃ C、煤气燃烧时,这是化学能转化为热能 D、水结冰后体积增大,说明分子的大小随温度变化而改变12. 小科通过实验探究某种金属R的活动性强弱,并根据实验现象编制检索表如图,根据检索表可知,金属R的活动性强弱排序正确的是 ( )
9. 中国科学家成功制备出石墨双炔包覆的锑纳米空心立方盒,可用作钠离子电池负极材料,把纳米销颗粒转化为锑是制备过程中的关键一步, 反应的化学方程式如下:该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应10. 科学兴趣小组对金属R的活动性进行探究时发现:将R 放入稀硫酸中,有气泡产生,同时生成+2价的盐;将R放入ZnSO4溶液中无任何变化。根据以上信息,下列化学方程式中,正确的是( )A、 B、 C、 D、11. 以下是某同学对生活中一些现象的解释,其中正确的是( )。A、铁制品表面涂油漆只是为了美观 B、水在标准大气压下的沸点是100℃,所以不管用什么锅煮水,水的温度都不会超过100℃ C、煤气燃烧时,这是化学能转化为热能 D、水结冰后体积增大,说明分子的大小随温度变化而改变12. 小科通过实验探究某种金属R的活动性强弱,并根据实验现象编制检索表如图,根据检索表可知,金属R的活动性强弱排序正确的是 ( ) A、Fe> Ag>R B、Ag>R> Fe C、R> Fe> Ag D、Fe>R> Ag13. 向质量均为m的两种不同金属a和b 中分别滴加50g相同浓度的稀硫酸,反应过程中产生氢气的质量与所加稀硫酸的质量关系如图所示,则下列说法不正确的是( )
A、Fe> Ag>R B、Ag>R> Fe C、R> Fe> Ag D、Fe>R> Ag13. 向质量均为m的两种不同金属a和b 中分别滴加50g相同浓度的稀硫酸,反应过程中产生氢气的质量与所加稀硫酸的质量关系如图所示,则下列说法不正确的是( )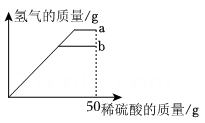 A、滴加50g稀硫酸后的溶液质量关系ma>mb。 B、滴加50g稀硫酸后溶液中均含有两种溶质 C、若金属a是铁,则金属b可能是锌 D、两种金属的活动性均排在H前面14. 在硫酸铜溶液中加入过量铁粉是古法制铜的重要原理,下列说法正确的是 ( )A、溶液颜色不变 B、溶液质量不变 C、反应结束后,固体只有铜 D、该实验可以说明铁的活动性比铜强15. 在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入质量相等、溶质质量分数相同的稀盐酸,然后在左边烧杯中放入镁,在右边的烧杯中放入与镁质量相等的铝。.待充分反应后,下列分析错误的是( )、A、天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余 B、天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余 C、天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余 D、天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余
A、滴加50g稀硫酸后的溶液质量关系ma>mb。 B、滴加50g稀硫酸后溶液中均含有两种溶质 C、若金属a是铁,则金属b可能是锌 D、两种金属的活动性均排在H前面14. 在硫酸铜溶液中加入过量铁粉是古法制铜的重要原理,下列说法正确的是 ( )A、溶液颜色不变 B、溶液质量不变 C、反应结束后,固体只有铜 D、该实验可以说明铁的活动性比铜强15. 在已经调平的托盘天平两边各放一只等质量的烧杯,向烧杯中各加入质量相等、溶质质量分数相同的稀盐酸,然后在左边烧杯中放入镁,在右边的烧杯中放入与镁质量相等的铝。.待充分反应后,下列分析错误的是( )、A、天平保持平衡,左边烧杯中,酸没有剩余,镁可能有剩余 B、天平保持平衡,右边烧杯中,酸没有剩余,铝一定有剩余 C、天平失去平衡,右边烧杯中,酸可能剩余,铝一定没剩余 D、天平失去平衡,左边烧杯中,酸一定剩余,镁一定没剩余二、填空题
-
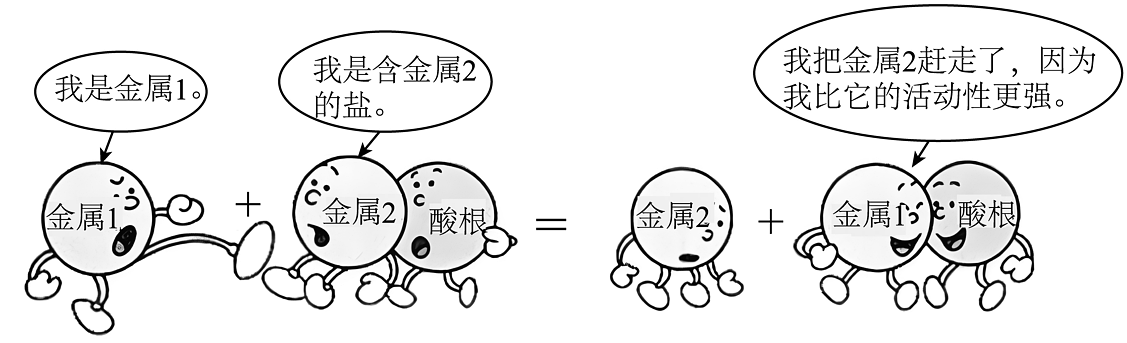
16. 如图形象地表示了金属和盐溶液发生反应的情况,图中金属1和含金属2的盐可以是铁单质和硫酸铜,请写出此反应的化学反应方程式。并写出实验反应的现象。
 17. 人类在认识金属活动性规律的过程中经历了漫长的探索。
17. 人类在认识金属活动性规律的过程中经历了漫长的探索。材料一:1625年德国化学家格劳贝尔意外发现,有些金属放入酸中会“消失”。
材料二:贝采利乌斯是最早对金属活动性排序的科学家,他依靠定性的推测,对元素的电化次序排序为: Ag、Cu、Zn、Mg、Na。其中 Na的电正性最强, Ag的电负性最强。
(1)、根据材料一,用Ag、Cu、Mg三种金属重复格劳贝尔实验,会“消失”的金属是。(2)、由材料二可推测金属元素的电负性越强,金属活动性越。18. 室外的铁制栏杆在多雨季节易生锈,园园对铁生锈的条件进行了探索,实验装置如图。3天后,发现只有装置C中的铁丝生锈了。 (1)、装置A中生石灰的作用是 。(2)、装置B、C中的实验现象说明与 接触是铁生锈的条件之一。19. 杭州奥体中心游泳馆凭借黑科技的水循环系统,可以在池水常年不换的情况下依然干净清澈。在该水循环系统中,特意采用了精度更高的硅藻土过滤,这一技术使得池水能直接饮用。(1)、 硅藻土的主要成分是SiO2 , SiO2中 Si的化合价为价:(2)、SiO2是制备硅及其化合物的重要原料,其中制取粗硅的反应原理是 则X的化学式为 , 该反应属于基本反应类型中的反应。20. 为了提高煤的利用率,减少环境污染。科研人员设计了如图所示的综合利用方案,回答问题:
(1)、装置A中生石灰的作用是 。(2)、装置B、C中的实验现象说明与 接触是铁生锈的条件之一。19. 杭州奥体中心游泳馆凭借黑科技的水循环系统,可以在池水常年不换的情况下依然干净清澈。在该水循环系统中,特意采用了精度更高的硅藻土过滤,这一技术使得池水能直接饮用。(1)、 硅藻土的主要成分是SiO2 , SiO2中 Si的化合价为价:(2)、SiO2是制备硅及其化合物的重要原料,其中制取粗硅的反应原理是 则X的化学式为 , 该反应属于基本反应类型中的反应。20. 为了提高煤的利用率,减少环境污染。科研人员设计了如图所示的综合利用方案,回答问题: (1)、在一定条件下将煤转化为可燃性气体,此过程可认为是碳与水的反应,其微观过程如图中①所示,则该反应中属于氧化物的是(填字母),该反应类型属于四大基本反应中的。(2)、一定条件下,一氧化碳和氢气可按照 1:2的体积比反应(标准状况下),若只生成一种产物(X),如图中②所示,就能实现“零排放”,则产物(X)可能是____。A、甲烷CH4 B、甲醇CH4O C、甲醛CH2O21. 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。人类冶炼不同金属的大致年代如图甲所示
(1)、在一定条件下将煤转化为可燃性气体,此过程可认为是碳与水的反应,其微观过程如图中①所示,则该反应中属于氧化物的是(填字母),该反应类型属于四大基本反应中的。(2)、一定条件下,一氧化碳和氢气可按照 1:2的体积比反应(标准状况下),若只生成一种产物(X),如图中②所示,就能实现“零排放”,则产物(X)可能是____。A、甲烷CH4 B、甲醇CH4O C、甲醛CH2O21. 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。人类冶炼不同金属的大致年代如图甲所示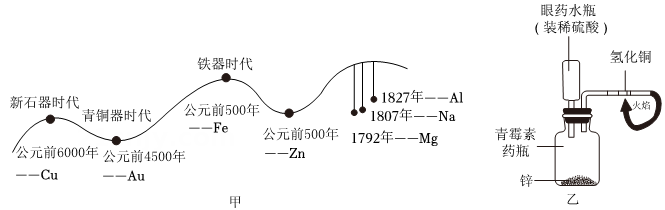 (1)、 人类使用的金属材料中,铜先被冶炼出来。请结合金属活动性顺序分析其主要原因:;(2)、 图乙是某项目化小组设计的制取氢气并还原氧化铜的“微型”实验装置图。
(1)、 人类使用的金属材料中,铜先被冶炼出来。请结合金属活动性顺序分析其主要原因:;(2)、 图乙是某项目化小组设计的制取氢气并还原氧化铜的“微型”实验装置图。①实验中可观察到的现象有。 (写出一点即可)
②实验中氢气的作用有。 (写出两点)
22. 金属和金属材料在生产生活中有广泛用途。(1)、生活中不宜用钢丝球擦洗铝制品,原因是。(2)、为了探究X、Y、Z三种金属的活动性顺序,某小组同学做了以下三个实验:①将X放入Y的盐溶液中,有Y固体析出;②将Y放入Z.韵盐溶液中,有Z固体析出;③将X放入Z的盐溶液中,有Z固体析出。经过讨论,实验(填序号)是多余的,可得出三种金属的活动性由强到弱的顺序为。(3)、 向 Mg(NO3)2、AgNO3和 Cu(NO3)2的混合溶液中加入一定量的铁粉, 充分反应后过滤,得到滤渣和滤液。往滤渣中加入稀硫酸,有气泡产生,产生气泡的化学方程式为。滤渣中一定有。三、实验与探究题
-
23. 小明同学取镁、铝、锌三种金属,分别放入盛有质量和质量分数都相等的稀盐酸的锥形瓶中,实验装置如图1,得到如图2所示的气压变化曲线。
 (1)、镁、铝、锌与稀盐酸反应产生的相同气体是 (填化学式)。(2)、铝对应的曲线是B,反应速率先慢后快,其主要原因是 .(3)、从图2分析,以下结论正确的是(填序号)。
(1)、镁、铝、锌与稀盐酸反应产生的相同气体是 (填化学式)。(2)、铝对应的曲线是B,反应速率先慢后快,其主要原因是 .(3)、从图2分析,以下结论正确的是(填序号)。①金属镁对应的气压变化曲线是A
②M点时参加反应的镁锌质量相等
③实验时取用的镁铝质量可能相等
24. 科学学习小组对钢铁锈蚀进行探。【提出问题】铁锈蚀与哪些因素有关。
【查阅资料】碳粉可加快铁的锈蚀,碳粉不与盐酸反应;氧化铁能与盐酸反应,不产生气体。
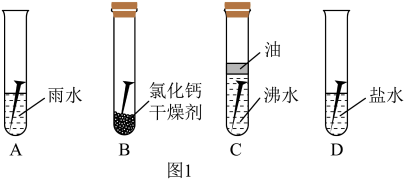
【设计实验】
实验一:定性探究铁锈蚀的因素。
取四枚大小相同的洁净某型号无锈铁钉,分别放入四支相同的试管,进行图1实验。现象如下表。
试管编号
A
B
C
D
一周后铁钉表面现象
有一层铁锈
无明显变化
无明显变化
有较厚铁锈
(1)、对比A、B、C试管中实验现象,说明铁锈蚀化学反应的发生,需要空气中的。(2)、对比A和D试管中实验现象,说明铁锈蚀快慢与(填化学式)有关。实验二:定量探究影响铁锈蚀的因素。
小组同学设计了图2装置,检查气密性,将5克铁粉和2克碳粉加入三颈烧瓶,并在t1时刻加入2毫升饱和食盐水后,再将一只装有5毫升稀盐酸的注射器插到烧瓶上(没有推动注射器活塞),采集数据。
(3)、根据图3,说明铁生锈是(填“放热”或“吸热”)反应。(4)、据图2、图4分析t3时刻后压强突然变大,原因是。25. 科学小组在比较铝、铜金属活动性强弱时,将等量未打磨的铝片(含铝的氧化膜)分别放入一定浓度的等量氯化铜(CuCl2)溶液和硫酸铜(CuSO4)溶液中。发现前者铝片表面覆盖红色固体,溶液蓝色逐渐变浅,一段时间后有气泡产生,而后者无明显变化。【问题1】为什么未打磨的铝片在两种溶液中会产生不同的现象?
【猜想】
(1)、可能是离子破坏了铝的氧化膜。【实验与结论】
取等量未打磨的铝片,进行了A、B实验,如图1。观察到A实验无现象,B实验铝片表面覆盖红色固体,溶液蓝色逐渐变浅,一段时间后有气泡产生,说明猜想是正确的。

【问题2】铝片与氯化铜溶液反应为什么会出现气泡?
【猜想】可能是氯化铜溶液呈酸性,铝片与溶液中的H反应产生气泡。
【实验与结论】
(2)、小科用测得氯化铜溶液的pH<7,证实了自己的猜想。【拓展与应用】
(3)、一位同学提出可以将A、B实验替换成C、D实验来解决问题1,如图2。请你对该方案进行评价: 。(4)、根据实验结果,请解释生活中为什么不能用铝质器皿盛放咸菜:。26. 小浙通过实验知道金属锌能与可溶性的硝酸银反应,他产生疑问:“金属锌是否能与不溶性的氯化银反应?”,于是他进行如下研究: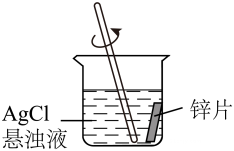
【实验步骤】
①取10mL 的AgNO3溶液于烧杯中,逐滴加入 NaCl 溶液至过量。
②过滤后再用蒸馏水洗涤沉淀3次,向第3次所得洗涤液中加入AgNO3溶液,无明显现象。
③将洗涤后的沉淀放入另一烧杯中,加入50mL 蒸馏水,将锌片加入烧杯中,并搅拌(如图)。
④10分钟后,将烧杯中的混合物进行过滤。过滤后,向滤液中滴加AgNO3溶液,观察现象。
【验证与推理】
(1)、步骤②中,向第3次洗涤液加入AgNO3溶液的目的是。(2)、步骤③中,锌片放入前需进行预处理,消除表面氧化膜对实验的影响,预处理的具体操作是。(3)、步骤④中若观察到有白色沉淀生成,可得出的结论是。(4)、小浙观察到锌片表面有灰黑色固体生成。取生成的灰黑色固体于试管中,加入稀硫酸,若发现 , 证明有 Ag生成。27. 1.某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图1所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。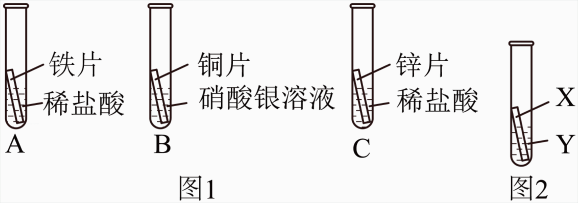 (1)、一段时间后,观察到实验B中的现象 。(2)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,补做了一个实验,装置均如图2所示,且实现了探究目的。
(1)、一段时间后,观察到实验B中的现象 。(2)、乙同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,补做了一个实验,装置均如图2所示,且实现了探究目的。乙同学的实验:X是 金属,Y是 溶液。
(3)、将表面锈蚀的铁钉放入烧杯中,然后加入溶质质量分数为14.6%的稀盐酸,产生氢气的质量和加入稀盐酸的质量如图所示。生成氢气的质量为多少克?
四、综合题
-
28. 随着手机、电脑等移动设备的普及,人们对充电设备的要求越来越高,氮化镓充电设备因体积小、功率大深受消费者喜爱。(1)、氮化镓(GaN)是充电设备中的核心材料。查阅资料得知,氮化镓中氮元素的化合价与氨气(NH3)中氮元素的化合价相同。由此可知,氮化镓中镓元素的化合价为。(2)、氮化镓的制取可通过镓与氨气在高温下发生置换反应来实现,该反应的化学方程式为。29. 小柯同学想测定“Cu﹣Zn”合金和“Cu﹣Ag”合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。(1)、你认为能测出其铜的质量分数的是合金。(2)、小柯同学取该合金的粉末32.5克,与足量的该盐酸充分反应,经测定,产生了0.2克气体,请计算该合金中铜的质量分数。(3)、若想测出该盐酸的质量分数,你认为实验时必须提供和测出哪些数据?答:________(填序号)。A、产生气体的质量 B、参加反应的稀盐酸的质量 C、参加反应的合金的质量30. 有铁粉和铜粉的均匀混合物,甲、乙、丙三位同学分别取该混合物与稀硫酸反应,所得数据如下表所示:
甲
乙
丙
取用金属混合物的质量/g
10
10
20
取用稀硫酸的质量/g
100
120
100
反应后过滤,得干燥固体的质量/g
4
4
13
请分析数据,回答下列问题:
(1)、金属混合物中 Cu的质量分数(2)、计算丙同学所得溶液中溶质的质量分数(计算结果精确到0.1%)31. 《天工开物》记载了锡的冶炼方法:入砂(指锡砂)数百斤,丛架木炭亦数百斤,鼓鞲(指鼓入空气)熔化,用铅少许,(锡)沛然流注。其反应原理为C+SnO2Sn+CO2↑。(1)、上述反应属于化学基本反应类型中的反应。(2)、炼锡时加入少许铅形成合金,产物更易熔化流出,原因是。(3)、现有151kg含SnO220%的锡砂,理论上可以炼出锡的质量是多少?(写出计算过程)32. “嫦娥五号”返回器携带回地球的月壤样品对全面、科学地探测月球地质、资源等有重要的意义。 (1)、地球和月球上都存在单质形式的金、银,说明它们的化学性质。(2)、月球上存在天然的铁、铝等金属颗粒而地球上没有,原因是。(3)、从金、银、铁、铝的混合金属中回收金、银:将混合金属放入一定量的硝酸银溶液中充分反应后过滤,得到滤渣和浅绿色溶液,向滤渣中加入一定量稀盐酸,有气泡产生。
(1)、地球和月球上都存在单质形式的金、银,说明它们的化学性质。(2)、月球上存在天然的铁、铝等金属颗粒而地球上没有,原因是。(3)、从金、银、铁、铝的混合金属中回收金、银:将混合金属放入一定量的硝酸银溶液中充分反应后过滤,得到滤渣和浅绿色溶液,向滤渣中加入一定量稀盐酸,有气泡产生。①滤渣中一定含有的金属是。
②硝酸银溶液和铁反应的化学方程式为。
(4)、已知人类冶炼和使用金属的历史年代数据如图所示,你的结论是。