【浙教版】科学 九上1.4常见的碱 巩固提升练
试卷更新日期:2025-09-04 类型:同步测试
一、选择题
-
1. 运输氢氧化钠固体的包装箱上应张贴的标识是( )A、
 B、
B、 C、
C、 D、
D、 2. 向一定量硫酸铜溶液中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是
2. 向一定量硫酸铜溶液中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是  A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、B 点时溶液pH=7 D、A点到 B 点硫酸钠质量不变3. 实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )A、浓盐酸——防止挥发 B、NaOH溶液——防止与CO2反应 C、浓硫酸——防止吸水 D、生石灰——防止与氧气反应4. 为测定某氢氧化钠固体是否变质,小科同学取适量样品配制成溶液,加入锥形瓶中,再逐滴加入稀盐酸至过量,并利用传感器测定CO2的含量,如图所示。下列结论中错误的是()
A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、B 点时溶液pH=7 D、A点到 B 点硫酸钠质量不变3. 实验室许多药品都需密封保存,下列对药品密封保存原因的解释,错误的是( )A、浓盐酸——防止挥发 B、NaOH溶液——防止与CO2反应 C、浓硫酸——防止吸水 D、生石灰——防止与氧气反应4. 为测定某氢氧化钠固体是否变质,小科同学取适量样品配制成溶液,加入锥形瓶中,再逐滴加入稀盐酸至过量,并利用传感器测定CO2的含量,如图所示。下列结论中错误的是() A、氢氧化钠固体已变质 B、氢氧化钠固体已完全变质 C、100s时溶液的pH>7 D、200s时溶液中的溶质只有一种5. 下列四个图象中,能正确反应对应变化关系的是( )A、向一定量的氢氧化钠溶液中滴加稀盐酸
A、氢氧化钠固体已变质 B、氢氧化钠固体已完全变质 C、100s时溶液的pH>7 D、200s时溶液中的溶质只有一种5. 下列四个图象中,能正确反应对应变化关系的是( )A、向一定量的氢氧化钠溶液中滴加稀盐酸 B、向一定量的稀盐酸中加入大理石
B、向一定量的稀盐酸中加入大理石 C、向一定量的稀盐酸中加入铁粉
C、向一定量的稀盐酸中加入铁粉 D、加热一定量的高锰酸钾固体
D、加热一定量的高锰酸钾固体 6. 根据下列实验操作及实验现象,所得实验结论正确的是()
6. 根据下列实验操作及实验现象,所得实验结论正确的是()选项
实验操作
实验现象
实验结论
A
在某氢氧化钠溶液样品中,加入足量的氯化钙溶液,过滤,在滤液中滴入2滴酚酞试液
产生白色沉淀,酚酞不变红
该氢氧化钠溶液一定全部变质
B
将浓盐酸和大理石反应放出的气体通入澄清石灰水
石灰水始终未浑浊
该石灰水一定变质
C
向稀盐酸中加入一定量的氢氧化钠固体
溶液温度升高
氢氧化钠与盐酸一定发生了化学反应
D
将充满二氧化碳气体的试管倒扣在盛有氢氧化钠溶液的水槽中
试管内液面上升
二氧化碳与氢氧化钠一定发生了反应
A、A B、B C、C D、D7. 已知溶液的导电性与单位体积内离子的数目、离子所带电荷多少有关,单位体积内离子数目越多,导电性越强;离子所带电荷越多,导电性越强(如两个氯离子和一个硫酸根离子导电性相当).现向含有和的混合液中通入气体,下列测得溶液导电性(用“电流强度I”表示)变化与通入气体体积(V)关系图象正确的是( )A、 B、
B、 C、
C、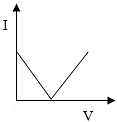 D、
D、 8. 如图是一种简易喷泉实验装置。先推动注射器(a)使少量溶液进入小药瓶(b),然后松手,可以观察到注射器活塞向上移动,小药瓶中出现彩色喷泉。下列组合能形成红色喷泉的是( )
8. 如图是一种简易喷泉实验装置。先推动注射器(a)使少量溶液进入小药瓶(b),然后松手,可以观察到注射器活塞向上移动,小药瓶中出现彩色喷泉。下列组合能形成红色喷泉的是( )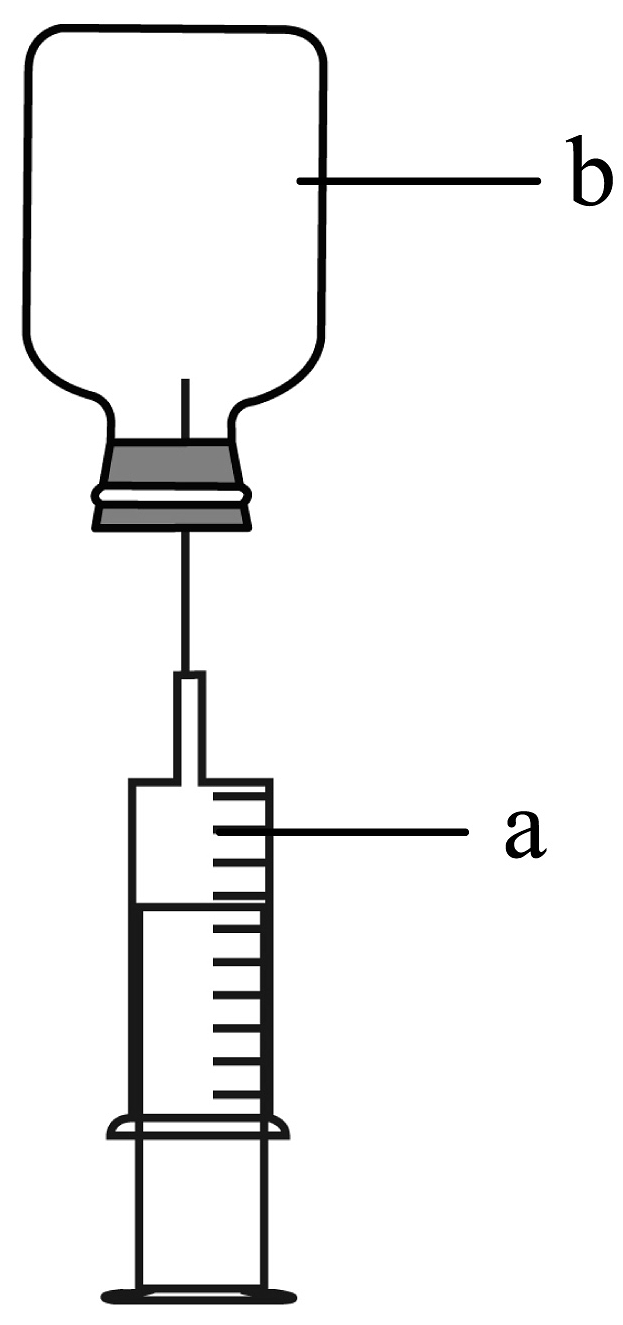 A、b中放 , a中放滴有无色酚酞的氢氧化钠溶液 B、b中放 , a中放滴有紫色石蕊的氢氧化钠溶液 C、b中放 , a中放滴有无色酚酞的氢氧化钠溶液 D、b中放 , a中放滴有紫色石蕊的氢氧化钠溶液9. 某化学小组利用数字化传感器探究氢氧化钠与二氧化碳的反应。在烧瓶内收集满CO2, 如图I所示,T 开K, 将注射器内的液体同时迅速注入烧瓶内,关闭K, 一段时间后,同时振荡烧瓶,观察到甲中有白 色沉淀生成,乙中无明显现象。通过压强传感器测得烧瓶内压强随时间的变化如图Ⅱ所示,曲线①和曲 线②分别表示甲、乙两个烧瓶内的压强变化。下列说法错误的是( )
A、b中放 , a中放滴有无色酚酞的氢氧化钠溶液 B、b中放 , a中放滴有紫色石蕊的氢氧化钠溶液 C、b中放 , a中放滴有无色酚酞的氢氧化钠溶液 D、b中放 , a中放滴有紫色石蕊的氢氧化钠溶液9. 某化学小组利用数字化传感器探究氢氧化钠与二氧化碳的反应。在烧瓶内收集满CO2, 如图I所示,T 开K, 将注射器内的液体同时迅速注入烧瓶内,关闭K, 一段时间后,同时振荡烧瓶,观察到甲中有白 色沉淀生成,乙中无明显现象。通过压强传感器测得烧瓶内压强随时间的变化如图Ⅱ所示,曲线①和曲 线②分别表示甲、乙两个烧瓶内的压强变化。下列说法错误的是( ) A、上述实验可以证明氢氧化钠与二氧化碳能发生反应 B、通过图Ⅱ可知,吸收大量的CO2 最好选用澄清石灰水 C、图Ⅱ中AB 段曲线上升的原因是用注射器注入液体,压缩烧瓶内的气体,压强增大 D、图Ⅱ中点C、点 E 对应的实验操作是振荡烧瓶10. 航天员的舱外服会放有一种药饼,药饼的主要成分是与氢氧化钠性质相似的氢氧化锂(LiOH)【其它成分不参加反应】。下列关于药饼说法正确的是A、取部分药饼溶于水后可以和碳酸钠反应 B、药饼放在舱外服中,主要作用是减少二氧化碳气体的含量 C、将药饼放入稀盐酸中,液体温度降低 D、取少量药饼溶于水,滴入紫色石蕊试液会变红色11. 随着气温降低,同学们越来越喜欢食用“自嗨锅”等自热食品。小科同学对自热包的发热原理很感兴趣,经过一系列调查,发现自热包的主要成分有:生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、盐、焦炭粉等。自热包加水后产生的化学变化如下:①氧化钙和水反应:CaO+H2O=Ca(OH)2;②铁粉、铝粉和盐在有水的环境下,构成原电池,反应如下:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+2H2O+X=4Fe(OH)3↓;2Fe(OH)3=Fe2O3+3H2O,根据上述信息,判断下列有关说法错误的是( )A、X是一种气体,可用向下排空气法收集 B、②中铝粉是催化剂,反应前后其质量不变 C、①反应会放出大量的热,使用过程要注意安全,防止烫伤 D、自热包中活性炭的作用是吸附反应物,使反应不过分剧烈12. 向氯化铁溶液中滴入几滴氢氧化钠溶液,可观察到的现象是( )A、
A、上述实验可以证明氢氧化钠与二氧化碳能发生反应 B、通过图Ⅱ可知,吸收大量的CO2 最好选用澄清石灰水 C、图Ⅱ中AB 段曲线上升的原因是用注射器注入液体,压缩烧瓶内的气体,压强增大 D、图Ⅱ中点C、点 E 对应的实验操作是振荡烧瓶10. 航天员的舱外服会放有一种药饼,药饼的主要成分是与氢氧化钠性质相似的氢氧化锂(LiOH)【其它成分不参加反应】。下列关于药饼说法正确的是A、取部分药饼溶于水后可以和碳酸钠反应 B、药饼放在舱外服中,主要作用是减少二氧化碳气体的含量 C、将药饼放入稀盐酸中,液体温度降低 D、取少量药饼溶于水,滴入紫色石蕊试液会变红色11. 随着气温降低,同学们越来越喜欢食用“自嗨锅”等自热食品。小科同学对自热包的发热原理很感兴趣,经过一系列调查,发现自热包的主要成分有:生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、盐、焦炭粉等。自热包加水后产生的化学变化如下:①氧化钙和水反应:CaO+H2O=Ca(OH)2;②铁粉、铝粉和盐在有水的环境下,构成原电池,反应如下:2Fe+O2+2H2O=2Fe(OH)2;4Fe(OH)2+2H2O+X=4Fe(OH)3↓;2Fe(OH)3=Fe2O3+3H2O,根据上述信息,判断下列有关说法错误的是( )A、X是一种气体,可用向下排空气法收集 B、②中铝粉是催化剂,反应前后其质量不变 C、①反应会放出大量的热,使用过程要注意安全,防止烫伤 D、自热包中活性炭的作用是吸附反应物,使反应不过分剧烈12. 向氯化铁溶液中滴入几滴氢氧化钠溶液,可观察到的现象是( )A、 B、
B、 C、
C、 D、
D、 13. 一定温度下,向含有适量酚酞溶液的稀盐酸中慢慢滴加氢氧化钠溶液,溶液温度随加入氢氧化钠溶液质量变化的曲线如图所示。下列叙述正确的是
13. 一定温度下,向含有适量酚酞溶液的稀盐酸中慢慢滴加氢氧化钠溶液,溶液温度随加入氢氧化钠溶液质量变化的曲线如图所示。下列叙述正确的是 A、该化学反应吸热 B、M点时溶液呈红色 C、N点时溶液pH最大 D、P点时溶液中至少含两种溶质14. 向一定量的 NaOH溶液中逐滴加入CuCl2溶液至过量,下列有关量的变化关系图正确的是A、
A、该化学反应吸热 B、M点时溶液呈红色 C、N点时溶液pH最大 D、P点时溶液中至少含两种溶质14. 向一定量的 NaOH溶液中逐滴加入CuCl2溶液至过量,下列有关量的变化关系图正确的是A、 B、
B、 C、
C、 D、
D、 15. 某同学进行稀盐酸和氢氧化钠溶液反应的实验操作,记录并绘制了烧杯中溶液的pH随滴入液体体积的变化曲线。依据图中信息,下列说法正确的是( )
15. 某同学进行稀盐酸和氢氧化钠溶液反应的实验操作,记录并绘制了烧杯中溶液的pH随滴入液体体积的变化曲线。依据图中信息,下列说法正确的是( )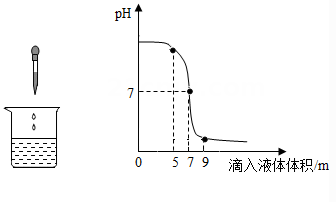 A、该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中 B、当滴入液体体积为5mL 时,所得溶液呈酸性 C、当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应 D、当滴入液体体积为9mL 时,溶液中的溶质为NaCl和NaOH
A、该实验是将氢氧化钠溶液滴入盛有稀盐酸的烧杯中 B、当滴入液体体积为5mL 时,所得溶液呈酸性 C、当滴入液体体积为7mL时,盐酸和氢氧化钠恰好完全反应 D、当滴入液体体积为9mL 时,溶液中的溶质为NaCl和NaOH二、填空题
-
16. 随着工业迅速发展,大气污染成为了我们面临的一个巨大危机。其中,酸雨和工业生产中排放的二氧化硫、氮氧化物等酸性气体密切相关。
(1)酸雨是指的酸性降水,它会使土壤酸化,施用适量可改良土壤酸性。
(2)这些造成酸雨的气体可以用碱溶液来吸收,如氢氧化钠溶液能够吸收气体,请写出该反应方程式:。
17. 小科、小红、小刚为了在兴趣课上表演化学魔术,用同样材料但不同的方法制作了各自表演的道具:小科在一张滤纸上用酚酞绘制了一些图案,用吹风机吹干备用,等表演时通过向滤纸上喷稀氢氧化钠溶液,便可使白纸显示神奇的红色图案;
小红在制作时用稀氢氧化钠溶液绘制图案,并自然晾干备用,等表演时喷洒酚酞试液便可达到同样效果;
(1)、小刚对小红的做法提出了质疑:NaOH 因吸收空气中的CO2而变质,将导致表演失败。但小红认为没有关系,因为她的理由是变质后生成的 , 其水溶液也能使酚酞试液变红色。(2)、老师肯定了小红的理由,但否定了小红的做法,否定的理由与NaOH的性有关。18. 灵灵比较氢氧化钠和氢氧化钙的性质,做了下面的实验,请回答下列问题。 (1)、对比甲、乙实验,说明具有吸水性的固体是:。(2)、取出培养皿并配置溶液,久置于空中,则两个培养皿中会出现浑浊的溶液是:。(3)、丙、丁处反应产生的气体是。19. 实验桌上有一瓶敞口放置已久的 NaOH溶液,为探究其是否变质,小丽进行了如下探究:
(1)、对比甲、乙实验,说明具有吸水性的固体是:。(2)、取出培养皿并配置溶液,久置于空中,则两个培养皿中会出现浑浊的溶液是:。(3)、丙、丁处反应产生的气体是。19. 实验桌上有一瓶敞口放置已久的 NaOH溶液,为探究其是否变质,小丽进行了如下探究:实验步骤
现象
步骤一
取少量溶液样品于试管中,向其中滴加足量的氯化钙溶液。
产生白色沉淀
步骤二
过滤,向滤液中滴加酚酞溶液。
酚酞溶液变红
(1)、由实验可知,该NaOH 溶液(选填“没有变质”、“部分变质”或“全部变质”);(2)、若步骤一与步骤二顺序调换,(填“能”或“不能”)得出上述结论;(3)、小丽第二次滴加的试剂除用指示剂外,还可以用替代(写出一种试剂)。20. 电导率和 pH 传感器可辅助探究复分解反应的实质。某兴趣小组运用电导率和 pH 传感 器探究硫酸和氯氧化钡溶液的反应。实验装置如图甲所示,实验数据如图乙所示。注:电导 率是以数字表示的溶液传导电流的能力;单位以微西门子每厘米 (μS/cm ) 表示。根据以上 信息回答下列问题: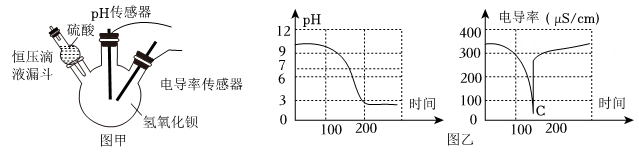 (1)、 实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的离子 (写离 子符号) ;(2)、 如图乙,C点电导率最低的原因是;(3)、 将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似____。A、HCl B、CuSO4 C、MgSO4 D、NaNO321. 向一瓶久置的氢氧化钾溶液中逐滴加入稀盐酸并振荡,反应过程如图所示。请回答:
(1)、 实验开始时,溶液电导率较高的原因是溶液含有大量自由移动的离子 (写离 子符号) ;(2)、 如图乙,C点电导率最低的原因是;(3)、 将恒压滴液漏斗中液体换成以下哪种溶液,测得电导率图像与图乙相似____。A、HCl B、CuSO4 C、MgSO4 D、NaNO321. 向一瓶久置的氢氧化钾溶液中逐滴加入稀盐酸并振荡,反应过程如图所示。请回答: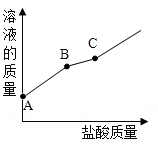 (1)、该氢氧化钾溶液变质程度为(选填“部分变质” 或“全部变质”)。(2)、请写出氢氧化钾变质的原理(用化学方程式表示)。(3)、C点溶液中所含的溶质是(用化学式表示)。22. 学习小组同学用如图所示的装置进行实验。打开分液漏斗的活塞,将NaOH 浓溶液加入锥形瓶 A 中,关闭活塞,打开弹簧夹,观察到A 中产生白色沉淀,烧杯B中液面降低。
(1)、该氢氧化钾溶液变质程度为(选填“部分变质” 或“全部变质”)。(2)、请写出氢氧化钾变质的原理(用化学方程式表示)。(3)、C点溶液中所含的溶质是(用化学式表示)。22. 学习小组同学用如图所示的装置进行实验。打开分液漏斗的活塞,将NaOH 浓溶液加入锥形瓶 A 中,关闭活塞,打开弹簧夹,观察到A 中产生白色沉淀,烧杯B中液面降低。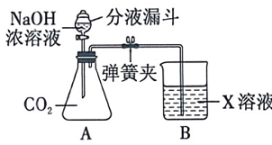 (1)、 写出CO2与NaOH 溶液发生反应的化学方程式: 。(2)、若X 是一种碱,则其化学式可能是(只写一种)。(3)、学习小组同学用的X是( , 实验结束后,同学们又分别做了以下三组实验:①取少量 A 中溶液,测其pH,pH>7。②取少量A 中溶液,向其中加入( 溶液,无明显现象,再测其pH,pH>7。③取少量 A 中溶液,测其pH,pH>7,再向其中加入 溶液,产生白色沉淀。
(1)、 写出CO2与NaOH 溶液发生反应的化学方程式: 。(2)、若X 是一种碱,则其化学式可能是(只写一种)。(3)、学习小组同学用的X是( , 实验结束后,同学们又分别做了以下三组实验:①取少量 A 中溶液,测其pH,pH>7。②取少量A 中溶液,向其中加入( 溶液,无明显现象,再测其pH,pH>7。③取少量 A 中溶液,测其pH,pH>7,再向其中加入 溶液,产生白色沉淀。查阅资料可知 CaCl2溶液呈中性。
以上三组实验事实中,能说明A中溶液一定含有NaOH 的是(填序号)。
三、实验与探究题
-
23. 小嘉所在的项目化学习小组留意到实验室常用氢氧化钠溶液来吸收CO2 , 而氢氧化钙也能与CO2反应,那么实验室可否用石灰水来吸收CO2呢?学习小组对此展开探究。
【提出猜想】
小明:可用饱和石灰水吸收CO2;小亮:不可用饱和石灰水吸收CO2。
为了验证他们的观点,小组同学设计了图1实验装置并用数字传感器记录数据。
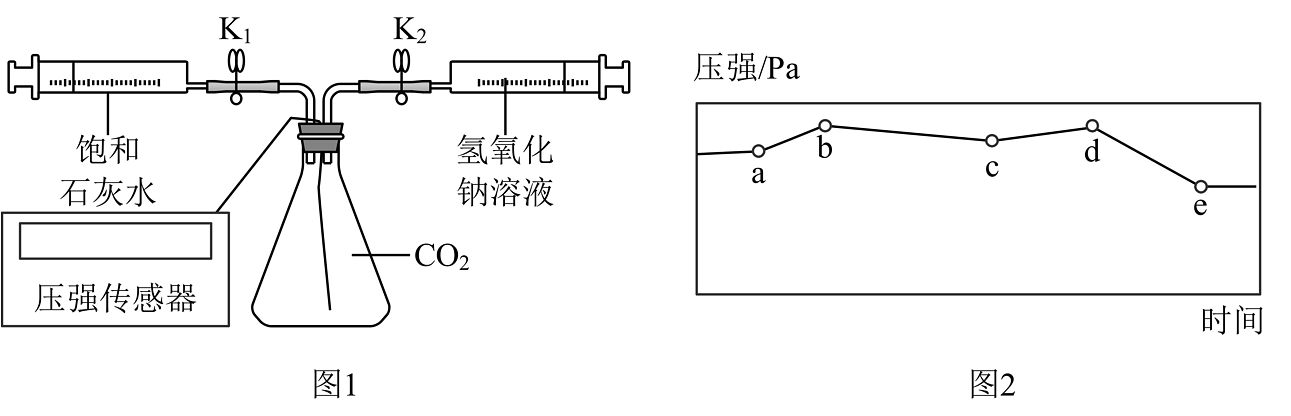
【进行实验】
①连接仪器,检查装置气密性。
②按要求装入药品。夹紧K1、K2 , 打开压强传感器绘制初始波形图至a点(图2)。
③打开K1 , 向装置中注入50mL饱和石灰水,完毕后再微微振荡装置,记录波形图。
④打开K2 , 向装置中注入50mL氢氧化钠溶液,记录波形图。
【分析与结论】
(1)、ab段压强增大的原因是。(2)、通过两点的比较,说明小明的猜想不成立。通过数字化实验,同学们明白了实验室不能用石灰水来吸收CO2。(3)、小嘉认为de段压强明显减小的原因也可能是CO2溶于水造成的,请分析整个波形图,说说你的观点。24. 实验室有两瓶久置的A、B试剂,小科对这两瓶试剂成分进行探究,已获悉原试剂成分组合有两种可能:①稀盐酸和氯化钠溶液;②碳酸钠溶液和氢氧化钠溶液。按以下流程展开探究: (1)、【成分预测】若完成步骤1后,现象1为试管内溶液均不变色,则可能的组合是(选填“①”或“②”)。(2)、【结果分析】小科完成步骤1后,发现现象1为试管内溶液均变红色,继续进行步骤2,现象2为试管中均出现白色沉淀。请对现象2作出合理解释:。(3)、【继续探究】在步骤2中继续滴加CaCl2溶液至过量,发现装有B试剂的试管中红色不消褪,则B试剂原来是溶液。(4)、【评价反思】小科认为在步骤2中用稀盐酸代替CaCl2溶液也能检验A、B试剂。你是否同意他的观点。若同意请说明如何判断,若不同意请说明理由。25. 通过观察和实验等方法获取证据是科学探究的重要环节。
(1)、【成分预测】若完成步骤1后,现象1为试管内溶液均不变色,则可能的组合是(选填“①”或“②”)。(2)、【结果分析】小科完成步骤1后,发现现象1为试管内溶液均变红色,继续进行步骤2,现象2为试管中均出现白色沉淀。请对现象2作出合理解释:。(3)、【继续探究】在步骤2中继续滴加CaCl2溶液至过量,发现装有B试剂的试管中红色不消褪,则B试剂原来是溶液。(4)、【评价反思】小科认为在步骤2中用稀盐酸代替CaCl2溶液也能检验A、B试剂。你是否同意他的观点。若同意请说明如何判断,若不同意请说明理由。25. 通过观察和实验等方法获取证据是科学探究的重要环节。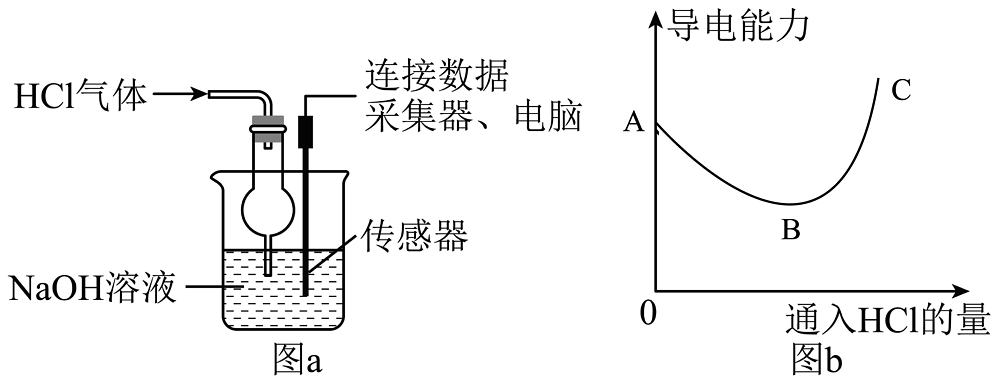 (1)、向少量Fe(OH)3沉淀中加入稀盐酸,观察到 , 可判断发生了反应。(2)、向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。
(1)、向少量Fe(OH)3沉淀中加入稀盐酸,观察到 , 可判断发生了反应。(2)、向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。①甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,观察到 , 可判断Ca(OH)2与HCl发生了反应。
②乙同学将氢氧化钙溶液与稀盐酸混合,然后检验了混合液中含有Ca2+和Cl- , 他据此认为Ca(OH)2与HCl发生了反应,且生成了CaCl2.你认为乙同学的推测是否正确?请说出你的观点并阐述理由:。
(3)、如图a所示,向NaOH稀溶液中缓缓通入HCl气体,测定该过程中溶液导电能力的变化,实验结果如图b,溶液体积、温度的变化可忽略。分析B→C段变化,溶液导电能力上升的原因是。26. 将二氧化碳通入氢氧化钠溶液中,没有明显现象产生,因而无法判断两者是否发生了化学反应。对于没有明显现象的反应我们可以用以下的思维模型(如图甲)进行分析实验。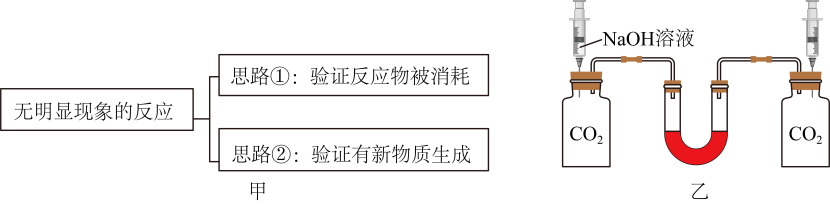 (1)、向氢氧化钠溶液通入适当过量二氧化碳,再滴加无色酚酞,溶液变红色,能否说明氢氧化钠没有被消耗,请说明理由。(2)、将二氧化碳通入氢氧化钠溶液中,再向其中滴入稀盐酸,观察到有气泡产生,则证明二氧化碳和氢氧化钠发生了化学反应。该方案对应上述思维模型中思路(填数字)。(3)、如图乙所示方案,在U形管左右两侧的装置相同,两个集气瓶中装有等量二氧化碳,左侧注射器中为氢氧化钠溶液,为验证氢氧化钠与二氧化碳确实发生了反应,则右侧的注射器中的液体应为。(4)、某同学提出图甲的模型可以增加一个思路③:反应前后的温度变化。有同学不同意,因为有些物质混合后会放热,但并未发生化学反应。比如:。27. 小舟在学习“常见的碱,过程中,将新配制的饱和溶液滴入到溶液中,发现没有出现预期的红褐色沉淀。这是为什么呢?小舟查阅资料,获取如下信息:
(1)、向氢氧化钠溶液通入适当过量二氧化碳,再滴加无色酚酞,溶液变红色,能否说明氢氧化钠没有被消耗,请说明理由。(2)、将二氧化碳通入氢氧化钠溶液中,再向其中滴入稀盐酸,观察到有气泡产生,则证明二氧化碳和氢氧化钠发生了化学反应。该方案对应上述思维模型中思路(填数字)。(3)、如图乙所示方案,在U形管左右两侧的装置相同,两个集气瓶中装有等量二氧化碳,左侧注射器中为氢氧化钠溶液,为验证氢氧化钠与二氧化碳确实发生了反应,则右侧的注射器中的液体应为。(4)、某同学提出图甲的模型可以增加一个思路③:反应前后的温度变化。有同学不同意,因为有些物质混合后会放热,但并未发生化学反应。比如:。27. 小舟在学习“常见的碱,过程中,将新配制的饱和溶液滴入到溶液中,发现没有出现预期的红褐色沉淀。这是为什么呢?小舟查阅资料,获取如下信息:
①微溶于水;②溶液呈酸性。于是他提出以下猜想:
猜想一:没有参加化学反应。猜想二:滴入的溶液中数量太少。
猜想三:溶液呈酸性,沉淀不能存在。
(1)、小舟用pH试纸测和混合液的酸碱度,测得pH<7说明溶液中没有。该现象(选填“支持”或“不支持”)猜想一。(2)、为增加的数量,换用浓NaOH溶液滴加到溶液中(如图甲),若猜想二正确,则观察到的现象是。(3)、经过实验,猜想三验证成立。然后,小舟将溶液逐滴滴加到饱和溶液中(如图乙),先观察到红褐色沉淀产生,持续滴加后沉淀又消失了,请你解释沉淀会消失的原因。四、综合题
-
28. 小科按图示操作进行酸和碱反应的实验。
 (1)、盛放NaOH溶液的试剂瓶应密封储存,原因是。(2)、步骤③中判断两者恰好完全反应的实验现象是。(3)、酸碱反应的实质是:。29. 图甲是关于氢氧化钠化学性质的思维导图,请据图回答问题。
(1)、盛放NaOH溶液的试剂瓶应密封储存,原因是。(2)、步骤③中判断两者恰好完全反应的实验现象是。(3)、酸碱反应的实质是:。29. 图甲是关于氢氧化钠化学性质的思维导图,请据图回答问题。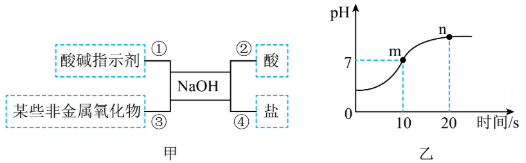 (1)、性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈色。(2)、性质②,将氢氧化钠溶液滴入稀盐酸中、图乙表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是(填化学式)(3)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。30. 对知识的归纳和总结是学好科学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的化学性质(如图)。
(1)、性质①,将无色酚酞溶液滴入氢氧化钠溶液中,溶液呈色。(2)、性质②,将氢氧化钠溶液滴入稀盐酸中、图乙表示该反应过程中溶液pH的变化曲线,n点溶液中的溶质是(填化学式)(3)、依据性质③,除去硫酸厂在生产过程中产生的二氧化硫气体,化学方程式为。30. 对知识的归纳和总结是学好科学的重要方法。在学习了碱的性质后,小红同学总结了氢氧化钙的化学性质(如图)。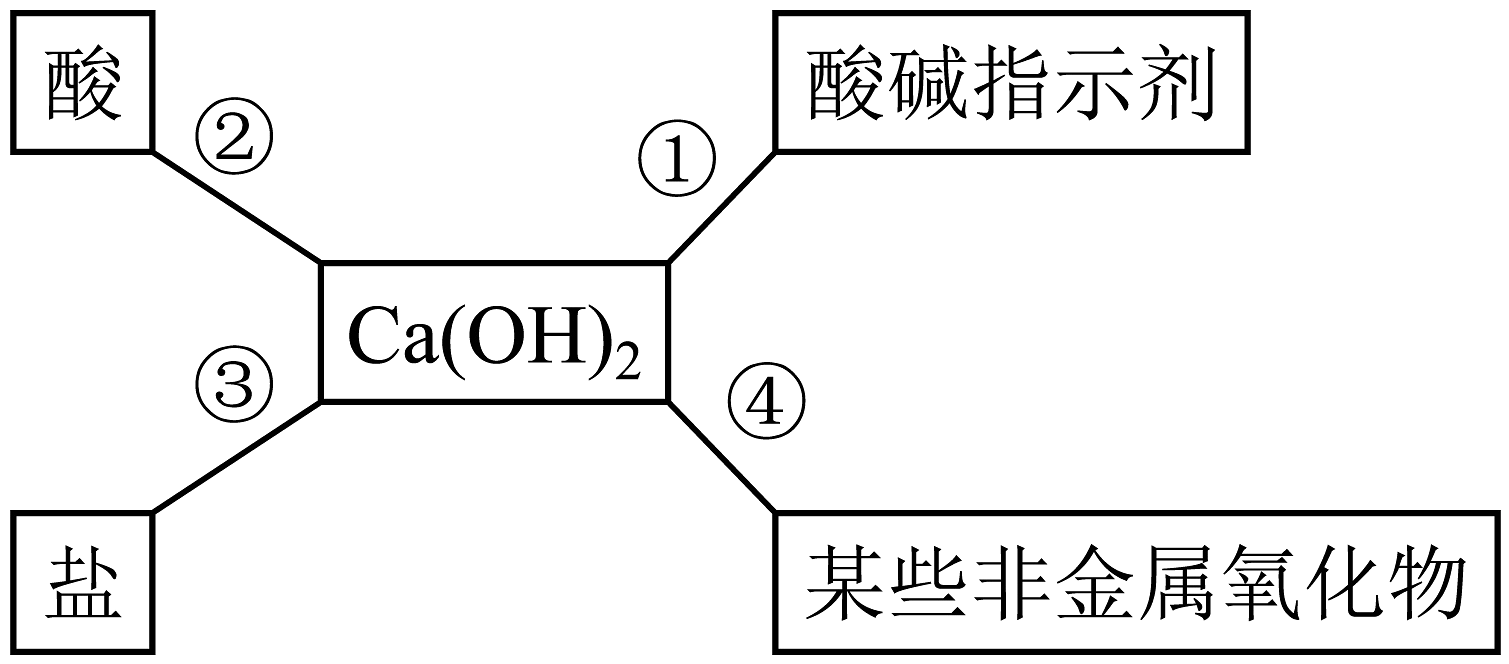 (1)、为了验证氢氧化钙与①反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成色。(2)、利用氢氧化钙与③反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式。(3)、工业上采用石灰浆雾滴技术除去废气中的二氧化硫,在此对石灰浆进行雾化处理的目的是。31. 为探究实验室中久置的氢氧化钠溶液是否变质及变质程度,兴趣小组的同学进行了有关思考和实验。(1)、变质原因:(用化学方程式表示)。(2)、检验样品是否变质
(1)、为了验证氢氧化钙与①反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成色。(2)、利用氢氧化钙与③反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式。(3)、工业上采用石灰浆雾滴技术除去废气中的二氧化硫,在此对石灰浆进行雾化处理的目的是。31. 为探究实验室中久置的氢氧化钠溶液是否变质及变质程度,兴趣小组的同学进行了有关思考和实验。(1)、变质原因:(用化学方程式表示)。(2)、检验样品是否变质请写出实验方案: , 即说明其已经变质。
(3)、检验样品是否完全变质方案1:取少量样品于试管中,加入一定量的 Ba(OH)2溶液,往上层清液中滴加少量无色酚酞试液,若溶液呈红色,说明未完全变质。另一同学不同意此方案,理由是。
方案2:取少量样品于试管中,加入 , 过滤,往滤液中通入CO2气体,若观察到有白色沉淀生成,则说明未完全变质。
32. 如图所示的三个实验均可验证酸与碱能发生反应: (1)、根据实验一回答:①加稀盐酸前,一定能观察到的实验现象是;②该实验通过稀盐酸与反应的现象,验证了酸与碱能发生反应.(2)、实验二通过两只试管中的现象对比,可以判断稀盐酸与 能反应,该实验除需控制所加水和稀盐酸的温度、体积相同外,还需控制相同.(3)、实验三中,加入X可验证稀硫酸与碱能发生反应,符合此条件的X是下列物质中的____。A、酚酞 B、CuO C、 D、
(1)、根据实验一回答:①加稀盐酸前,一定能观察到的实验现象是;②该实验通过稀盐酸与反应的现象,验证了酸与碱能发生反应.(2)、实验二通过两只试管中的现象对比,可以判断稀盐酸与 能反应,该实验除需控制所加水和稀盐酸的温度、体积相同外,还需控制相同.(3)、实验三中,加入X可验证稀硫酸与碱能发生反应,符合此条件的X是下列物质中的____。A、酚酞 B、CuO C、 D、