黑龙江省大庆市2025年中考化学真题
试卷更新日期:2025-08-12 类型:中考真卷
一、选择题:本题10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项符合要求。
-
1. 大庆素有“绿色油化之都”的美誉,下列在石油综合利用中属于物理变化的是( )A、生产合成纤维 B、生产化肥 C、生产塑料 D、分馏得到汽油2. 下列图示实验操作错误的是( )A、液体的倾倒
 B、给液体加热
B、给液体加热 C、浓硫酸的稀释
C、浓硫酸的稀释 D、读取液体体积
D、读取液体体积 3. 家务劳动蕴含化学知识,下列做法错误的是( )A、用食醋清洗水壶中的水垢 B、用钢丝球擦洗铝制品表面的污渍 C、用含有氢氧化钠的炉具清洁剂去除油污 D、清洗铁锅后及时擦干防止生锈4. “分类法”是学习化学的重要方法之一,下列分类正确的是( )
3. 家务劳动蕴含化学知识,下列做法错误的是( )A、用食醋清洗水壶中的水垢 B、用钢丝球擦洗铝制品表面的污渍 C、用含有氢氧化钠的炉具清洁剂去除油污 D、清洗铁锅后及时擦干防止生锈4. “分类法”是学习化学的重要方法之一,下列分类正确的是( )选项
单质
氧化物
有机物
混合物
A
金刚石
H2O
葡萄糖
空气
B
碳纤维
CaO
尿素
冰水混合物
C
黄铜
Al2O3
聚乙烯
18K 黄金
D
液氮
Ca3(PO4)2
甲醛
医用酒精
A、A B、B C、C D、D5. 中国春节已正式列入联合国教科文组织非物质文化遗产名录,2025年迎来了首个“非遗版”春节。阖家团聚,年年有余(鱼),烹饪时加入黄酒和食醋生成的乙酸乙酯 使鱼肉别具香味,下列关于乙酸乙酯的说法正确的是( )A、乙酸乙酯的相对分子质量为88g B、1个乙酸乙酯分子由 14个原子构成 C、乙酸乙酯分子由碳、氢、氧元素组成 D、乙酸乙酯中碳、氢、氧三种元素的质量比为2:4:16. 古代文献体现先贤智慧,下列古代生产生活涉及的化学方程式正确的是( )A、“铁为胆水 (CuSO4溶液)所薄, 上生赤煤”: B、“煤饼烧石(主要成分是 CaCO3)成灰(含 CaO)” C、“有火井……取井火(主要成分是CH4)煮之”:( D、“水银……加热还复为丹(含 HgO)”: Hg+O2 HgO
7. 下列实验设计能达到实验目的的是( )A、验证分子不断运动
HgO
7. 下列实验设计能达到实验目的的是( )A、验证分子不断运动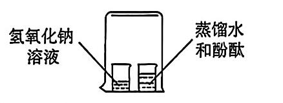 B、除去氢气中的氯化氢气体
B、除去氢气中的氯化氢气体 C、探究催化剂对过氧化氢分解速率的影响
C、探究催化剂对过氧化氢分解速率的影响 D、测定空气里氧气的含量
D、测定空气里氧气的含量 8. 下列图像能正确反映对应变化关系的是( )
8. 下列图像能正确反映对应变化关系的是( ) A、服用一定量含有 Al(OH)3的药片治疗胃酸过多 B、将用砂纸打磨干净的镁条在空气中点燃 C、一定温度下,向一定量不饱和石灰水中加入少量生石灰,再恢复至原温度 D、向硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液9. 硼酸的溶解度曲线如图(忽略硼酸溶解时温度变化)。下列说法正确的是( )
A、服用一定量含有 Al(OH)3的药片治疗胃酸过多 B、将用砂纸打磨干净的镁条在空气中点燃 C、一定温度下,向一定量不饱和石灰水中加入少量生石灰,再恢复至原温度 D、向硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液9. 硼酸的溶解度曲线如图(忽略硼酸溶解时温度变化)。下列说法正确的是( )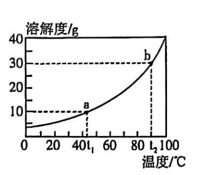 A、加水稀释,硼酸的溶解度变小 B、t1℃时,向a点溶液中再加入一定量硼酸可达到b点 C、t2℃时,向 25g水中加入 10g硼酸,充分溶解后可得到饱和的硼酸溶液 D、b点溶液的溶质质量分数是 a点的3倍10. 工业上用重晶石(主要成分为硫酸钡 )制备碳酸钡的工艺流程如图所示。
A、加水稀释,硼酸的溶解度变小 B、t1℃时,向a点溶液中再加入一定量硼酸可达到b点 C、t2℃时,向 25g水中加入 10g硼酸,充分溶解后可得到饱和的硼酸溶液 D、b点溶液的溶质质量分数是 a点的3倍10. 工业上用重晶石(主要成分为硫酸钡 )制备碳酸钡的工艺流程如图所示。
下列说法错误的是( )
A、为了使焙烧更充分可将重晶石粉碎 B、反应1 的化学方程式为 , 则物质X 的化学式为( C、操作1、操作2均用到的玻璃仪器有漏斗、烧杯、玻璃棒 D、反应2的基本反应类型为复分解反应二、填空题:本题5小题,共30分。
-
11. 为培养学生创新思维和实践能力,我市某校化学实验小组积极开展一系列微项目实践活动。(1)、自制简易净水器:利用(填名称)作絮凝剂,该物质溶于水后生成胶状物吸附杂质使其沉降;利用吸附水中色素和异味。(2)、自制加热包:原理为氧化钙与水反应放热,化学方程式为。(3)、自制冷敷袋(如图1):可溶性物质溶于水时会吸热,这种物质是(填“氯化钠”或“硝酸铵”)。(4)、自制简易灭火器(如图2):白醋与小苏打反应生成二氧化碳灭火,利用二氧化碳的性质是。
 12. 下图是实验室制取气体的几种常用装置,请回答下列问题:
12. 下图是实验室制取气体的几种常用装置,请回答下列问题: (1)、写出图中标号①仪器的名称。(2)、实验室用过氧化氢溶液与二氧化锰制氧气,为了控制反应速率,应选用的发生装置为(填字母)。(3)、实验室用高锰酸钾制氧气的化学方程式为 , 用装置 D收集氧气,验满的方法为。(4)、甲烷是天然气的主要成分,若用E收集甲烷,气体的进气口为(填“c”或“d”)。13. 钙是人体内含量最高的金属元素,下图为钙在元素周期表中的相关信息及原子结构示意图,请回答下列问题:
(1)、写出图中标号①仪器的名称。(2)、实验室用过氧化氢溶液与二氧化锰制氧气,为了控制反应速率,应选用的发生装置为(填字母)。(3)、实验室用高锰酸钾制氧气的化学方程式为 , 用装置 D收集氧气,验满的方法为。(4)、甲烷是天然气的主要成分,若用E收集甲烷,气体的进气口为(填“c”或“d”)。13. 钙是人体内含量最高的金属元素,下图为钙在元素周期表中的相关信息及原子结构示意图,请回答下列问题: (1)、钙元素的相对原子质量为 , 位于元素周期表第周期。(2)、钙原子和氦原子最外层都有两个电子,二者的化学性质(填“相似”或“不相似”)。(3)、钙元素是人体必需的(填“常量”或“微量”)元素。某钙片有效成分为碳酸钙,食用后在人体中转化为钙离子被吸收,请用化学方程式表示其转化过程: 。14. 某同学结合元素化合价构建了氯及其化合物的部分“价-类”二维图,如图1。
(1)、钙元素的相对原子质量为 , 位于元素周期表第周期。(2)、钙原子和氦原子最外层都有两个电子,二者的化学性质(填“相似”或“不相似”)。(3)、钙元素是人体必需的(填“常量”或“微量”)元素。某钙片有效成分为碳酸钙,食用后在人体中转化为钙离子被吸收,请用化学方程式表示其转化过程: 。14. 某同学结合元素化合价构建了氯及其化合物的部分“价-类”二维图,如图1。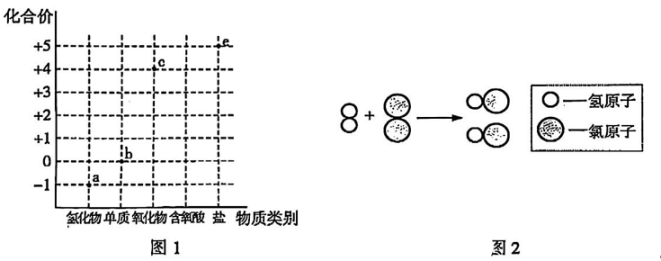
请回答下列问题:
(1)、物质a的稀溶液常用于除铁锈,请写出该反应的化学方程式。(2)、配平实验室制备物质b的化学方程式:MnO2+HCl(浓) MnCl2+Cl2↑+H2O
(3)、图2为物质b在点燃条件下转化为物质a的微观示意图.请写出该反应的化学方程式。(4)、物质c常用于自来水消毒,请写出其化学式。(5)、物质d为次氯酸(HClO),请在图1中用“▲”标出物质d的位置。(6)、物质e为氯酸钾,受热分解后,氯元素的质量分数(填“变大”、“变小”或“不变”)。15. “波尔多液”具有杀菌作用,常作为农药使用。某化工厂利用废弃铜料(只含铜和铁)和石灰石制备“波尔多液”,同时得到副产品绿矾( 工艺流程如图所示(部分反应条件和产物已略去)。
请回答下列问题:
(1)、固体 A 生成固体 B 的化学方程式为。(2)、溶液 A 的溶质是(填化学式)。(3)、物质X的化学式为。(4)、溶液B通过蒸发浓缩、、过滤得到绿矾,整个过程需控制温度不宜过高、隔绝空气,目的是、。(5)、反应①的化学方程式为。三、实验题:本题2小题,共22分。
-
16. 目前,全球能源结构正在向多元、清洁、低碳转型。氢能是人类未来的理想能源之一,制氢、储氢、释氢、用氢是氢能研究的热点。
项目一:制氢
根据生产来源和碳排放量不同,氢气分类如图1。
 (1)、“绿氢”是利用可再生能源发电制氢,生产中实现二氧化碳零排放。电解水产生的氢气和氧气的体积比为。(2)、“灰氢”是化石燃料制氢,可利用甲烷与水蒸气在高温条件下生成二氧化碳和氢气的方法制得,请写出该反应的化学方程式 , 从生成物的角度分析,该方法造成的环境问题是(填字母)。
(1)、“绿氢”是利用可再生能源发电制氢,生产中实现二氧化碳零排放。电解水产生的氢气和氧气的体积比为。(2)、“灰氢”是化石燃料制氢,可利用甲烷与水蒸气在高温条件下生成二氧化碳和氢气的方法制得,请写出该反应的化学方程式 , 从生成物的角度分析,该方法造成的环境问题是(填字母)。A.酸雨 B.温室效应增强 C.臭氧空洞
(3)、“蓝氢”是“灰氢”制法结合碳捕集和封存技术,实现低碳制氢,其中一种方法是利用氢氧化钠溶液实现“碳捕集”,如图2。①氢氧化钠溶液喷成雾状的目的是。
②捕捉室内发生反应的化学方程式为:、
紫氢是以来源丰富的水为原料,利用核能生产的氢气;金氢是自然产生或存于地壳中的天然氢。
(4)、项目二:储氢物理储氢:在高压下把氢气压缩储存于钢瓶中,从微观角度解释,氢气能被压缩储存的原因是。
(5)、化学储氢:可利用 Mg-Cu储氢合金与氢气反应生成金属氢化物 中氢元素的化合价为。(6)、项目三:释氢MgH2的一种释氢过程如图3所示,释氢开始时反应速率较快,然后逐渐减小。据图分析,反应速率逐渐减小的原因是。
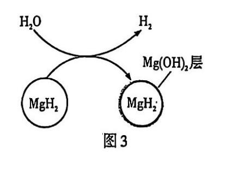 (7)、项目四:用氢
(7)、项目四:用氢氢气是理想的燃料,原因是(写出一条即可)。
17. 我市某校化学兴趣小组在老师的指导下进行“黑面包”趣味实验。取20g蔗糖 放入烧杯中,加少量水润湿,注入 10mL浓硫酸,搅拌,蔗糖先变黑后膨胀形成“黑面包”(如图1),同时还闻到了刺激性气味。
已知:①SO2能使澄清石灰水变浑浊;
②SO2具有还原性,能与酸性高锰酸钾溶液反应;
③SO2具有漂白性,能使品红溶液褪色。
变黑的原因:生成了黑色的炭
(1)、浓硫酸将蔗糖中氢、氧元素按水的组成比脱去,生成黑色的炭,体现了浓硫酸的作用。(2)、II.膨胀的原因:生成了气体【提出问题】气体的成分是什么?
【猜想与假设】猜想一:CO2 猜想二:SO2 猜想三:( 和
大家讨论后一致认为猜想一是错误的,原因是。
(3)、为了验证猜想二和猜想三,只需检验(填化学式)是否存在即可。(4)、【实验探究】对气体成分进行检验,部分实验装置如图2。
A中酸性高锰酸钾溶液的作用是。
(5)、B中品红溶液不褪色,说明。(6)、C中澄清石灰水变浑浊,反应的化学方程式为。(7)、【实验结论】综上所述,猜想成立。
四、计算题:本题1 小题,共8分。
-
18. 小庆和小铁同学利用实验室的粗盐,模拟侯氏制碱法制备碳酸钠。操作过程如下:(1)、粗盐提纯
除去难溶性杂质后的食盐水中还含有少量可溶性杂质,为除去其中的 和MgCl2 , 选用的除杂试剂为①过量NaOH 溶液 ②过量 溶液 ③过量 溶液,请写出一种合理的加入顺序(仅填序号)。过滤后向滤液中加适量的盐酸,蒸发结晶得到 NaCl 固体。
(2)、配制饱和食盐水已知20℃时NaCl的溶解度为36.0g,配制50g饱和食盐水需量取水的体积为mL(水的密度可近似看做1g/cm3 , 结果保留一位小数)。
(3)、模拟侯氏制碱法具体原理为:I 取一定量的饱和食盐水,通入足量的氨气和二氧化碳充分反应,过滤后得到8.4g碳酸氢钠固体,加热完全分解生成碳酸钠的质量为多少克?(写出计算过程)