(浙教版)科学九年级上册 第1章物质及其变化 专练3 工艺流程题
试卷更新日期:2025-08-11 类型:同步测试
一、分离提纯
-
1. 分离提纯是获取物质的重要方法,其思路有两种:一是除去杂质,二是提取目标产物。如图是海水综合利用的部分流程(操作已省略),下列说法不正确的是( )
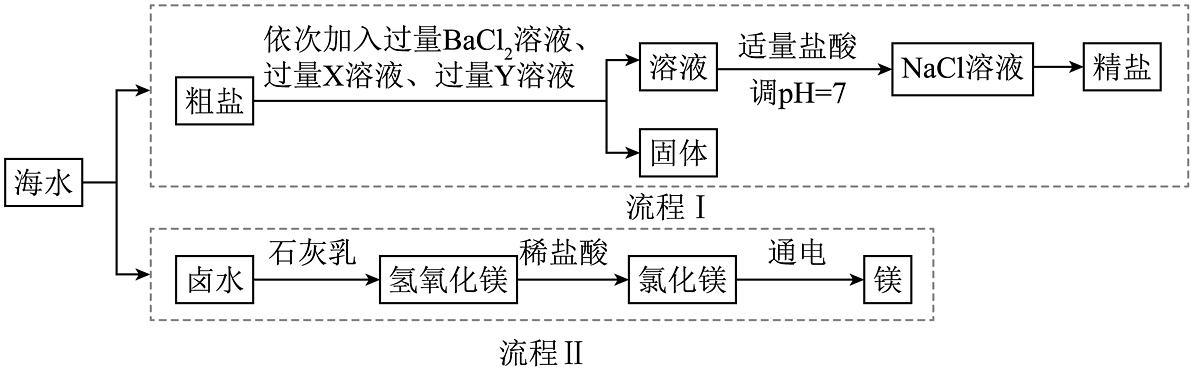
已知:该粗盐中含泥沙、MgCl2、CaCl2、Na2SO4等杂质。
A、流程Ⅰ中X、Y溶液的顺序不能颠倒 B、流程Ⅱ中的石灰乳可用生石灰替代 C、流程Ⅱ中提纯氯化镁是通过“提取目标产物”的思路实现的 D、混合物分离提纯的方法是由混合物中各组分的性质差异决定的2. 粗盐中含有等杂质,工业提纯粗盐的工艺流程如图所示: (1)、步骤①反应的化学方程式为。该反应的基本反应类型为。(2)、步骤④加入适量盐酸的目的是除去滤液中的和(填化学式)。(3)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有(填化学式)。3. 如图是模拟海水制盐的流程图:
(1)、步骤①反应的化学方程式为。该反应的基本反应类型为。(2)、步骤④加入适量盐酸的目的是除去滤液中的和(填化学式)。(3)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有(填化学式)。3. 如图是模拟海水制盐的流程图: (1)、操作X的名称是。(2)、实验①加入过量Ca(OH)2溶液的目的是。(3)、写出实验②发生的其中一个反应。(4)、精盐水中氯化钠的质量粗盐水中氯化钠的质量。(填“大于”“等于”或“小于”)(5)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有。
(1)、操作X的名称是。(2)、实验①加入过量Ca(OH)2溶液的目的是。(3)、写出实验②发生的其中一个反应。(4)、精盐水中氯化钠的质量粗盐水中氯化钠的质量。(填“大于”“等于”或“小于”)(5)、若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有。二、化工生产
-
4. 我国古代纺织业常用氢氧化钾作漂洗的洗涤剂。古人将贝壳(主要成分是碳酸钙)灼烧成贝壳灰(主要成分是氧化钙),再与碳酸钾溶液(可从草木灰中获得)反应制得氢氧化钾,生产流程如图所示:

(1)物质X的化学式为。
(2)写出反应④中发生的化学方程式。
(3)为了减少碳排放,流程中的物质Y可以来源于反应(选填“①”“②”或“③”)。
5. 我国制碱工业先驱侯德榜发明了“侯氏联合制碱法”。其模拟流程如图: (1)、“侯氏联合制碱法”的主要产品“纯碱”是指(填化学式);(2)、操作a的名称是(3)、请写出反应B的化学方程式;(4)、在该模拟流程中,能被循环利用的物质是6. 氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、、)为原料,生产氯气和氢氧化钠,模拟流程如图:
(1)、“侯氏联合制碱法”的主要产品“纯碱”是指(填化学式);(2)、操作a的名称是(3)、请写出反应B的化学方程式;(4)、在该模拟流程中,能被循环利用的物质是6. 氯碱工业以粗盐(主要成分是NaCl,含少量泥沙、、)为原料,生产氯气和氢氧化钠,模拟流程如图: (1)、试剂A与试剂B的组合为(填序号)。
(1)、试剂A与试剂B的组合为(填序号)。①KOH ②NaOH ③ ④
(2)、操作A需使用玻璃棒,玻璃棒的作用是。(3)、流程中Mg元素必须转化成(填化学式)才能完全除去。(4)、该工业副产品 , 氢能是未来最理想的能源,从环保角度分析,氢能最突出的优点是。氢氧燃料电池已经被应用,氢氧燃料电池是一种将化学能转化为能的装置。目前还不能作为燃料被广泛应用,其理由(答一条即可)。7. 葡萄糖酸亚铁【(C6H11O7)2Fe】 是常用的补铁剂。工业上制备葡萄糖酸亚铁的方法之一是由刚制备的碳酸亚铁与葡萄糖酸反应而得。其流程如图:
用下图装置制备 回答下列问题:

 (1)、 为了成功制得碳酸亚铁,开始实验时应该先打开K1(填打开或关闭 待 B 中反应即将结束时再打开 关闭(2)、 碳酸亚铁过滤时需在表面保留水层的原因是。(3)、反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是。(4)、 葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的都是。
(1)、 为了成功制得碳酸亚铁,开始实验时应该先打开K1(填打开或关闭 待 B 中反应即将结束时再打开 关闭(2)、 碳酸亚铁过滤时需在表面保留水层的原因是。(3)、反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是。(4)、 葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的都是。三、定型定量分析
-
8. 定性检测和定量测定是科学学习中经常用到的方法。为分析久置于空气中的氢氧化钠是否变质以及变质的程度,科学兴趣小组设计并进行了如下实验:
【定性检测】为判断氢氧化钠是否变质,兴趣小组先按以下流程进行实验:
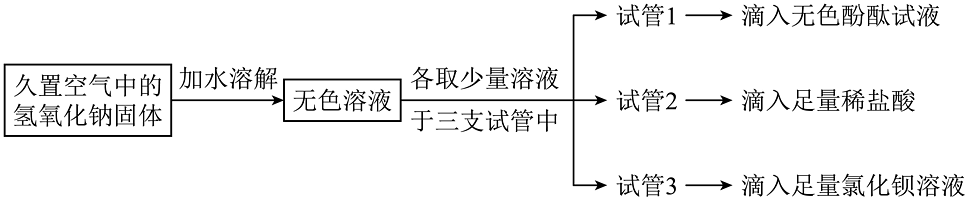 (1)、以上三个实验中不能达到实验目的的是试管(填试管序号)中的实验;(2)、通过上述实验现象,小组同学已确定该氢氧化钠固体已经变质,为进一步判断是部分变质还是全部变质,他们又在上述实验基础上选择其中一支试管继续实验,从而得出该氢氧化钠固体已经部分变质,实验方案为。
(1)、以上三个实验中不能达到实验目的的是试管(填试管序号)中的实验;(2)、通过上述实验现象,小组同学已确定该氢氧化钠固体已经变质,为进一步判断是部分变质还是全部变质,他们又在上述实验基础上选择其中一支试管继续实验,从而得出该氢氧化钠固体已经部分变质,实验方案为。【定量测定】
为了测定10g该氢氧化钠样品中碳酸钠的质量分数,设计了如图的实验方案:
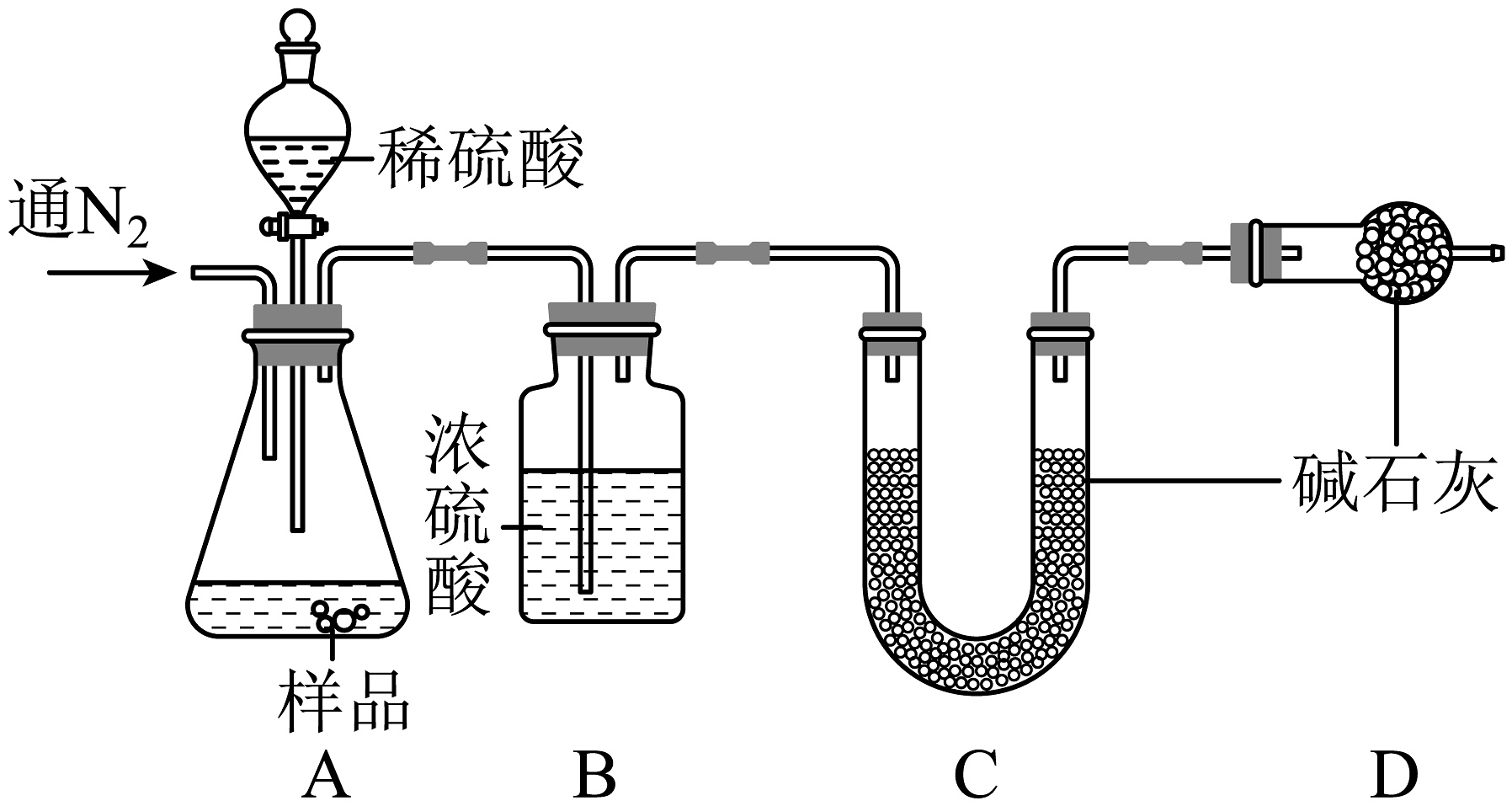
提示】碱石灰可以吸收水和二氧化碳
【实验步骤和数据】
①组装装置,检查气密性;②加入药品,称量C处装置质量为100g,再向A处装置中滴入足量稀硫酸:③完全反应后通入N2;④称量C处装置质量为104.4g。
【实验分析】
(3)、利用实验数据可得该部分变质氢氧化钠样品中碳酸钠的质量分数为;(4)、完全反应后通入N2的目的是。四、项目化工艺
-
9. 某兴趣小组在印染活动中结合纺织印染核心工艺流程,以“探究古代碱煮原理—探索现代酸洗工艺——探寻织物pH调节剂”为线索,开展探究活动 (如图) 。
 (1)、 【古代碱煮原理】古人将草木灰、蚌壳分别处理后混合,获得碱性更强的KOH 处理布料,布料表面变得更光滑。其中涉及到的化学方程式有 其中X为。(2)、 【现代酸洗工艺】 “酸洗”目的是用酸液除去布料上残留的碱液。现用98%浓硫酸稀释后处理布料,写出实验室稀释浓硫酸方法:。(3)、 【织物pH调节剂】碱煮、酸洗等处理后的布料经漂白、染色、质检合格方可出厂。质检要求合格布料的pH范围为4.5~7.5。如图是盐酸和醋酸滴入相同NaOH 溶液中pH变化图像。小组同学认为盐酸不宜作为布料pH调节剂,其原因是:。
(1)、 【古代碱煮原理】古人将草木灰、蚌壳分别处理后混合,获得碱性更强的KOH 处理布料,布料表面变得更光滑。其中涉及到的化学方程式有 其中X为。(2)、 【现代酸洗工艺】 “酸洗”目的是用酸液除去布料上残留的碱液。现用98%浓硫酸稀释后处理布料,写出实验室稀释浓硫酸方法:。(3)、 【织物pH调节剂】碱煮、酸洗等处理后的布料经漂白、染色、质检合格方可出厂。质检要求合格布料的pH范围为4.5~7.5。如图是盐酸和醋酸滴入相同NaOH 溶液中pH变化图像。小组同学认为盐酸不宜作为布料pH调节剂,其原因是:。
-