2025年山东省中考化学真题
试卷更新日期:2025-07-17 类型:中考真卷
一、选择题:本题共15小题。1~10小题,每小题2分:11~15小题,每小题3分,共35分。每小题只有一个选项符合题目要求。
-
1. 科学与生活交融,安全与健康同行,下列做法正确的是( )A、煤炉取暖时注意通风 B、电器起火时用水灭火 C、霉变花生清洗后食用 D、用稀甲醛溶液泡海鲜2. 下列做法符合绿色化学理念的是( )A、使用可降解的塑料制品 B、废旧电池深埋地下 C、大力推广使用火力发电 D、工业烟尘高空排放3. 下列有关水和溶液的说法正确的是( )A、河水经静置、过滤后所得液体属于纯净物 B、电解水实验说明水由氢气和氧气组成 C、物质溶于水形成溶液时,溶质以分子或离子形式存在 D、均一、稳定的无色液体一定是溶液4. 柴米油盐中品人生百味。下列说法正确的是( )A、柴、煤和天然气等燃料都属于可再生资源 B、“稻米飘香”体现了分子是在不断运动的 C、大量摄入油脂有益于人体健康 D、食盐的主要成分NaCl由分子构成5. 某同学用0.40 g氢氧化钠固体和100 mL水配制溶液并测其pH。下列操作不正确的是( )A、
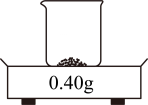 称量
B、
称量
B、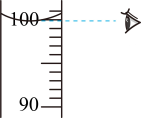 量取
C、
量取
C、 溶解
D、
溶解
D、 测pH
6. 硅化镁(Mg2Si)在半导体制造领域具有重要的应用价值. Mg和Si在元素周期表中的信息如图。下列说法正确的是( )
测pH
6. 硅化镁(Mg2Si)在半导体制造领域具有重要的应用价值. Mg和Si在元素周期表中的信息如图。下列说法正确的是( )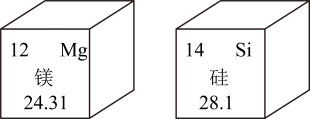 A、Mg的原子结构示意图为
A、Mg的原子结构示意图为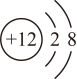 B、一个硅原子的质量为28.09g
C、Si是地壳中含量最多的金属元素
D、Mg与Si的本质区别是质子数不同
7. 下列物质的性质和用途对应关系正确的是( )A、石墨有金属光泽,可用作电极材料 B、酒精有可燃性,可用作燃料 C、盐酸能与某些金属反应,可用于金属除锈 D、熟石灰能与碳酸钠反应,可用于改良酸性土壤8. NaCl和KNO2的溶解度曲线如图,下列说法不正确的是( )
B、一个硅原子的质量为28.09g
C、Si是地壳中含量最多的金属元素
D、Mg与Si的本质区别是质子数不同
7. 下列物质的性质和用途对应关系正确的是( )A、石墨有金属光泽,可用作电极材料 B、酒精有可燃性,可用作燃料 C、盐酸能与某些金属反应,可用于金属除锈 D、熟石灰能与碳酸钠反应,可用于改良酸性土壤8. NaCl和KNO2的溶解度曲线如图,下列说法不正确的是( )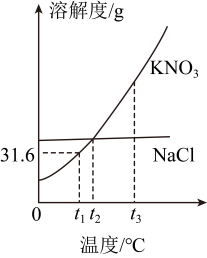 A、与NaCl相比,KNO3的溶解度受温度影响更大 B、t1℃时,饱和KNO3溶液的溶质质量分数为31.6% C、t2℃时, NaCl与KNO3的溶解度相等 D、将t3℃的饱和KNO3溶液降低温度,一定有晶体析出9. 利用醋酸能与硫酸钙反应的性质,可用白醋浸泡鸡蛋制作无壳鸡蛋。下列说法不正确的是( )A、醋酸能解离出H+ B、碳酸钙属于氧化物 C、制作过程中鸡蛋壳表面有气泡产生 D、醋酸与碳酸钙的反应属于复分解反应10. 我国科研团队不断改进CH4-CO2干气重整技术,将CO2定向转化为高附加值的化学品,实现了CO2资源化利用。CH4与CO2反应的微观示意图如下。下列说法正确的是( )
A、与NaCl相比,KNO3的溶解度受温度影响更大 B、t1℃时,饱和KNO3溶液的溶质质量分数为31.6% C、t2℃时, NaCl与KNO3的溶解度相等 D、将t3℃的饱和KNO3溶液降低温度,一定有晶体析出9. 利用醋酸能与硫酸钙反应的性质,可用白醋浸泡鸡蛋制作无壳鸡蛋。下列说法不正确的是( )A、醋酸能解离出H+ B、碳酸钙属于氧化物 C、制作过程中鸡蛋壳表面有气泡产生 D、醋酸与碳酸钙的反应属于复分解反应10. 我国科研团队不断改进CH4-CO2干气重整技术,将CO2定向转化为高附加值的化学品,实现了CO2资源化利用。CH4与CO2反应的微观示意图如下。下列说法正确的是( )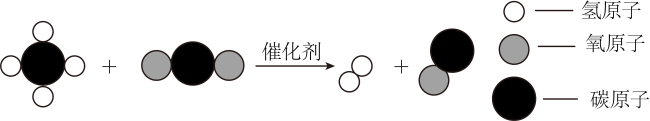 A、反应物和生成物都是由分子构成的化合物 B、反应物都含碳元素,都属于有机物 C、生成物都有可燃性,点燃前需验纯 D、反应前后分子的数目保持不变11. 某品牌汽车安全气囊的产气药剂主要有NaN3(气体发生剂)、Fe2O3(主氧化剂)、NaHCO3(冷却剂)等物质。当汽车发生猛烈碰撞时,点火器点火引发NaN3迅速分解,产生的气体使气囊迅速鼓起,主要反应过程如图(部分反应条件已略去)。下列说法不正确的是( )
A、反应物和生成物都是由分子构成的化合物 B、反应物都含碳元素,都属于有机物 C、生成物都有可燃性,点燃前需验纯 D、反应前后分子的数目保持不变11. 某品牌汽车安全气囊的产气药剂主要有NaN3(气体发生剂)、Fe2O3(主氧化剂)、NaHCO3(冷却剂)等物质。当汽车发生猛烈碰撞时,点火器点火引发NaN3迅速分解,产生的气体使气囊迅速鼓起,主要反应过程如图(部分反应条件已略去)。下列说法不正确的是( )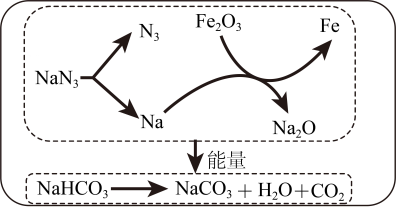 A、NaN3→N2的化学反应速率很快 B、NaN3→Na的化学方程式为:2NaN32Na+3N2↑ C、Fe2O3→Fe的反应中各元素化合价均发生变化 D、NaHCO3→Na2CO3的反应吸收能量12. 利用下列装置进行实验,能达到实验目的的是( )
A、NaN3→N2的化学反应速率很快 B、NaN3→Na的化学方程式为:2NaN32Na+3N2↑ C、Fe2O3→Fe的反应中各元素化合价均发生变化 D、NaHCO3→Na2CO3的反应吸收能量12. 利用下列装置进行实验,能达到实验目的的是( )装置




目的
除去H2中的少量HCl
鉴别稀盐酸和稀硫酸
证明某气体为H2
从食盐水中提取食盐
选项
A
B
C
D
A、A B、B C、C D、D13. 兴趣小组利用图1装置进行实验,测量木条和蜡烛燃烧至熄灭过程中集气瓶内O2的体积分数,数据如图2。下列说法不正确的是( )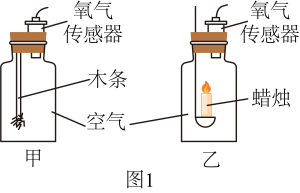
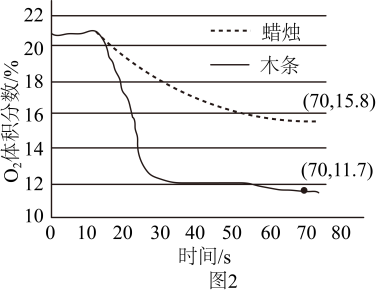 A、实验开始时,两集气瓶内O2的体积分数均约为21% B、木条、蜡烛均熄灭后,集气瓶内O2的体积分数:甲<乙 C、70s时,甲集气瓶内CO2的体积分数为88.3% D、可以通过调节O2的体积分数调控燃烧14. 兴趣小组利用下列装置(夹持装置已略去)进行实验。并依据现象从微观角度分析密闭体系中气体的变化情况。下列分析不正确的是( )
A、实验开始时,两集气瓶内O2的体积分数均约为21% B、木条、蜡烛均熄灭后,集气瓶内O2的体积分数:甲<乙 C、70s时,甲集气瓶内CO2的体积分数为88.3% D、可以通过调节O2的体积分数调控燃烧14. 兴趣小组利用下列装置(夹持装置已略去)进行实验。并依据现象从微观角度分析密闭体系中气体的变化情况。下列分析不正确的是( )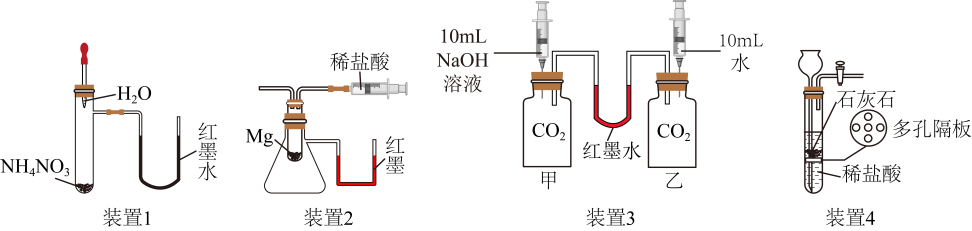
选项
操作及现象
分析
A
装置1:挤压胶头滴管。U形管内液面左高右低
气体分子间隔变小
B
装置2:将液体全部注入,U形管内液面左低右高
气体分子数目增多
C
装置3:同时将液体全部注入,U形管内液面左高右低
消耗的气体分子数目:甲>乙
D
装置4:反应一段时间。关闭活塞,试管内液面逐渐下降
气体分子数目增多
A、A B、B C、C D、D15. 某果蔬洗盐的成分为NaCl、Na2CO3和NaHCO3.某同学设计实验测定各成分质量分数。取两份质量均为m g的样品。利用下列装置(部分夹持装置已略去)进行实验。实验Ⅰ:连接装置1、3.加入足量稀硫酸,充分反应,测得NaOH溶液质量增加a g;
实验Ⅱ:另取装置3,与装置2连接。加热样品,充分反应,测得NaOH溶液质量增加b g.
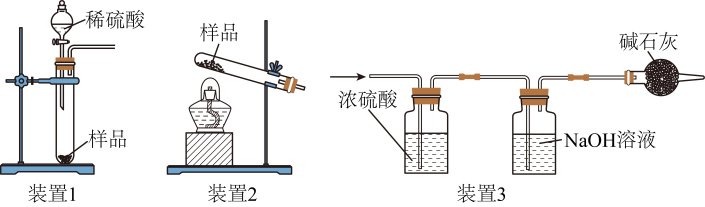
已知:①碱石灰可防止空气中的CO2进入NaOH溶液:
②2NaHCONa2CO3+H2O+CO2↑
下列说法不正确的是( )
A、m g样品中碳元素的质量为 B、Na2CO3的质量分数为 C、NaCl的质量分数为 D、实验1中若用稀盐酸代替稀硫酸,测得NaCl的质量分数偏小二、非选择题:本题共6小题,共65分。
-
16. 化学与人类的衣、食、住、行有着密切关系,不断推动人类社会的进步。(1)、多彩生活。“衣”你而定
①蚕丝是织造丝绸的主要原料,其主要成分为。
②某防晒服标签上标注其面料成分为85.9%锦纶、14.1%氨纶。其中铝纶属于A.有机高分子材料 B.无机非金属材料 C.金属材料
(2)、现代农业,仓丰食足合理施用化肥可提高粮食产量。某地小麦出现了叶色发黄现象,种植户追施了尿素。尿素[CO(NH2)2]中氮元素的质量分数为(结果精确至0.1%).
(3)、“嫦娥”探月,太空坑“基”我国计划在月球就地取材,制备月境印。月壤中含有二氧化硅、氧化铝、氧化铁等。其中氧化铝的化学式为。
(4)、智慧交通,向“芯”而行智能驾驶系统需要高算力硅芯片。制粗硅时发生反应:2C+SiO2Si+CO2↑,该反应的反应类型为____(填标号)。
A、复分解反应 B、分解反应 C、置换反应17. 兴趣小组对长征系列运载火箭的推进剂开展调查并进行归纳整理。推进期
信息
推进剂Ⅰ
偏二甲肼
最早使用,稳定。原料剧毒
四氧化二氮
推进剂Ⅱ
煤油
设环保,成本低
液氧
推进剂Ⅲ
液氢
环保
液氧
推进剂Ⅳ
复合固体推进剂
稳定,可长期储存
(1)、偏二甲肼与四氧化二氮反应的化学方程式为C2H8N23N2+2CO2+4H2O。偏二甲肼中碳元素与氢元素的原子个数比为(填最简整数比)。(2)、利用沸点不同从石油中分离出煤油。该过程中发生的变化属于(选填“物理变化”或“化学变化”)。(3)、使用推进剂Ⅲ时,清洁无污染的原因是。(4)、在长征系列火箭中,推进剂Ⅰ最早使用且技术成熟,利用表中信息分析,开发其它推进剂的理由是(回答1条即可)。18. 利用化学反应脱除、消耗贮藏环境中的CO2 , 可达到果蔬保鲜的目的。某果蔬保鲜剂如图: (1)、消石灰[Ca(OH)2]可由生石灰与水反应制得。该反应的化学方程式为 ,(2)、某同学取一包使用一段时间的保鲜剂[成分为Ca(OH)2和CaCO3],测定其吸收CO2的质量。用足量蒸馏水溶解、、洗涤、干燥,称量所得固体的质量为5.0g.根据实验数据计算该保鲜剂吸收CO2的质量(写出计算步骤,结果精确至0.1g).19. 化学实验是进行科学探究的重要方式。利用下列装置(部分夹持装置已略去)进行实验。
(1)、消石灰[Ca(OH)2]可由生石灰与水反应制得。该反应的化学方程式为 ,(2)、某同学取一包使用一段时间的保鲜剂[成分为Ca(OH)2和CaCO3],测定其吸收CO2的质量。用足量蒸馏水溶解、、洗涤、干燥,称量所得固体的质量为5.0g.根据实验数据计算该保鲜剂吸收CO2的质量(写出计算步骤,结果精确至0.1g).19. 化学实验是进行科学探究的重要方式。利用下列装置(部分夹持装置已略去)进行实验。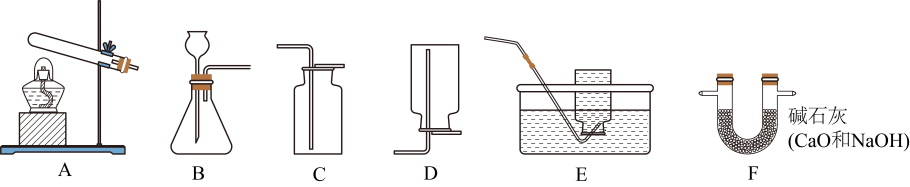
回答下列问题:
(1)、配制200g溶质质量分数为10%的过氧化氢溶液,需要取用溶质质量分数为30%的过氧化氢溶液的质量为g(结果精确至0.1g).(2)、用10%的过氧化氢溶液和二氧化锰制取一瓶干燥的O2 , 反应的化学方程式为 , 所选仪器的连接顺序为(按气流方向,用字母表示)。(3)、用坩埚钳夹取一块木炭,在酒精灯上加热至燃烧,再将其插入集满O2的集气瓶中,木炭燃烧更剧烈、发出白光、放出热量。由此实验可得出促进燃烧的方法为。燃烧停止后,为检验集气瓶中是否有CO2 , 需加入的试剂为。20. 暖身贴可持续发热,能用于身体局部热敷。某品牌暖身贴的发热包内含有铁粉、活性炭、吸水树脂(具有吸水、保水功能)、盐。兴趣小组对发热包的发热原理开展探究活动。(1)、验证发热包中含有铁粉将未使用的发热包中原料取出,进行实验。
步骤
操作
现象
结论
Ⅰ
将磁铁帘近原料
部分团色粉末被磁铁吸引
原料中含有铁质
Ⅱ
将磁铁吸引的黑色粉末加入试管内,加入适量振荡
黑色粉末溶解,产生气泡,溶液变成浅绿色
(2)、探究发热包的发热原理打开使用后的发热包,发现其中有红棕色物质。同学们猜想发热包的发热原理可能与铁钉(含Fe、C等)生锈的原理相同。利用图1装置(夹持装置已略去)进行实验。
步骤Ⅰ:组装好仪器后,需进行的操作为。
步骤Ⅱ:向三颈烧瓶内加入一定量铁粉、活性炭和氯化钠,向注射器内加入少量蒸馏水。
步施Ⅲ:进行以下操作,测得装置内O2的体积分数和温度变化如图2.正确的操作规序为(用①②③④表示)
①推动注射器,向装置内注入蒸馏水,静置1000s.
②打开止水夹a、b,向装置内迅速充满干燥的空气,关闭止水夹a、b、静置1000s.
③打开止水夹a、b,向装置内迅速充满干燥的CO2。关闭止水夹a、b,静置1000s.
④打开止水夹a、b.向装置内迅速充满干燥的O2 , 关闭止水夹a、b.静置1000s、
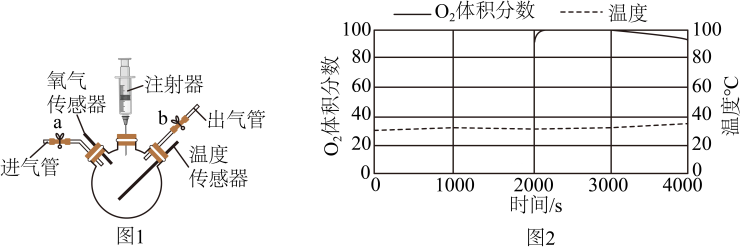
由实验可知。发热包的发热原理与铁钉生锈的原理(选填“相同”或“不同”)。
(3)、拓展应用另取图1装置,加入未使用的发热包中原料,并注入少量蒸馏水。一段时间后,装置内O2的体积分数降至2.8%,由此预测该原料还可用作____(填标号)。
A、除味剂 B、脱氧剂 C、补铁剂(4)、反思交流经过本次探究,结合已有知识可知“铁生锈”有利有弊,我们要辩证地看待问题,让科学更好地服务于生活。结合实例谈一谈对“铁生锈”利弊的理解。
21. 我国的铜矿产资源比较丰富,需要根据矿石种类的不同选用适当的方法冶炼。(1)、我国古代即有湿法炼铜的技术,南北朝时期又将湿法炼铜中铜盐的范围扩大到所有的可溶性铜盐(如CuCl2),铁与氯化铜溶液反应的化学方程式为。(2)、蓝铜矿的主要成分Cu2(OH)2(CO3)2可溶于稀硫酸。先用稀硫酸浸取矿石,再电解浸取液使铜沉积。电解时能量的主要转化形式为。(3)、黄铜矿的主要成分为CuFeS2 , 其冶炼过程大致如下: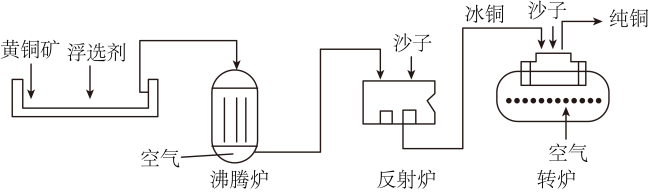
①为了增强浮选剂对矿石的富集效果,提高沸腾炉中化学反应的反应速率和原料利用率,需预先对矿石进行的操作为。
②沸腾炉中,发生反应2CuFeS22FeS+Cu2S+X,X的化学式为。
③反射炉中。沙子与杂质形成熔渣浮于上层,CuS和FeS熔融生成的“冰铜”沉于下层。Cu2S中硫元素的化合价为-2,则铜元素的化合价为。
④转炉中,沙子与杂质形成炉渣,Cu2S在高温条件下发生的反应过程如下:
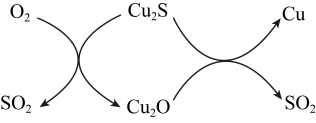
判断生成的气体能否直接排放并说明原因::Cu2O→Cu的化学方程式为。
(4)、兴趣小组利用如图装置(夹持装置已略去)对我国古代“竖炉炼铜”进行模拟实验,实验原理为C+2CuO2Cu+CO2↑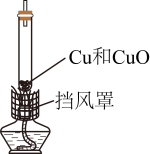
①依据上述化学方程式计算C与CuO的质量比为(填最简整数比)。烘干CuO粉末和木炭后,将木炭在研钵中研磨,按此质量比进行实验,效果不佳。
②为获得最佳实验效果,控制C与CuO的总质量一定,按不同质量比进行实验所得反应后物质状态如表,由实验知C和CuO质量比为1:10时实验效果最佳,判断依据是。利用数据分析其原因可能是。
C与CuO的质量比
反应后物质状态(°✔”代表有。“×”代表无)
红色块状金圆
金属光泽
黑色物质
1:9
√
×
少量
1:10
√
√
几乎无
1:11
√
×
很少
1:12
√
×
少量
1:13
√
×
较多