5 酸和碱之间的反应
试卷更新日期:2025-07-13 类型:同步测试
一、选择题
-
1. 如图是一种简易的自动化彩色喷泉实验。注射器中是滴有紫包菜汁的氢氧化钠溶液 , 小药瓶中充满氯化氢气体(极易溶于水)。实验开始时推动注射器使少量溶液进入小药瓶,然后松开手,可以观察到注射器活塞向左移动,小药瓶中出现了美丽的彩色喷泉。已知紫包菜汁的变色范围如表所示,则以下说法错误的是( )
颜色
粉红色
紫色
蓝色
绿色
黄色
 A、紫包菜汁可以用做酸碱指示剂 B、滴有紫包菜汁的氢氧化钠溶液呈绿色 C、液体颜色为粉红色时小药瓶中所含的溶质是 D、若实验中氢氧化钠过量,则小药瓶中液体颜色变化依次为:粉红色→紫色→蓝色→绿色2. 在水溶液中能大量共存,且溶液为无色透明的一组物质是( )A、CaCl2、Na2CO3、KNO3 B、NaCl、Ba(NO3)2、NaOH C、NaNO3、FeCl3、HCl D、H2SO4、NaOH、Na2CO33. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列情形能说明两者恰好完全中和的是 ( )A、滴入适量氯化铁溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与Cl-的个数比为1: 1 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀4. 生活中处处有化学,在实际生活中下列物质的用途与其化学性质无关的是( )A、用盐酸除热水瓶中的水垢 B、用Al(OH)3可治疗胃酸过多 C、用熟石灰改良酸性土壤 D、用干冰进行人工降雨5. 在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是( )A、
A、紫包菜汁可以用做酸碱指示剂 B、滴有紫包菜汁的氢氧化钠溶液呈绿色 C、液体颜色为粉红色时小药瓶中所含的溶质是 D、若实验中氢氧化钠过量,则小药瓶中液体颜色变化依次为:粉红色→紫色→蓝色→绿色2. 在水溶液中能大量共存,且溶液为无色透明的一组物质是( )A、CaCl2、Na2CO3、KNO3 B、NaCl、Ba(NO3)2、NaOH C、NaNO3、FeCl3、HCl D、H2SO4、NaOH、Na2CO33. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列情形能说明两者恰好完全中和的是 ( )A、滴入适量氯化铁溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、测得反应后溶液中Na+与Cl-的个数比为1: 1 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀4. 生活中处处有化学,在实际生活中下列物质的用途与其化学性质无关的是( )A、用盐酸除热水瓶中的水垢 B、用Al(OH)3可治疗胃酸过多 C、用熟石灰改良酸性土壤 D、用干冰进行人工降雨5. 在做酸碱反应的实验时,向盛有氢氧化钠溶液的烧杯中,逐渐加入稀盐酸。烧杯内相关物质的质量与加入稀盐酸质量的变化关系不正确的是( )A、 B、
B、 C、
C、 D、
D、 6. 下列实验中,根据现象得出的结论,正确的是( )
6. 下列实验中,根据现象得出的结论,正确的是( )选项
实验
现象
结论
A
CO2通入紫色石蕊试液
石蕊试液变红
CO2具有酸的性质
B
黄豆和芝麻混合后振荡
总体积变小
分子之间有空隙
C
稀H2SO4溶液中滴入NaOH溶液
无明显现象
H2SO4和NaOH没有发生化学反应
D
冷却CuSO4热饱和溶液
有晶体析出
CuSO4的溶解度随温度降低而减小
A、A B、B C、C D、D7. 等质量的氢氧化钠溶液和稀盐酸混合后,若所得溶液 , 则( )A、所用氢氧化钠溶液和稀盐酸的溶质质量分数相等 B、混合溶液中钠离子与氯离子个数相等 C、混合前后水分子总数不变 D、混合前后阳离子总数不变8. 如图所示,当胶头滴管中的液体滴入到锥形瓶中时,会引起气球膨胀的是( )
A
B
C
D
锥形瓶
MnO2
Zn
H2O
HCl 气体
胶头滴管
H2O2溶液
稀 H2SO4
浓 H2SO4
石灰水
A、A B、B C、C D、D9. 小科按图示操作进行酸和碱反应的实验,下列有关分析正确的是 ( ) A、①中放氢氧化钠溶液的瓶塞甲是玻璃塞 B、③中反应的现象是溶液由红色变为无色 C、⑤中稀释浓硫酸时,倒入的乙物质是水 D、⑥中酚酞试液用完后,滴管应及时清洗10. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( )
A、①中放氢氧化钠溶液的瓶塞甲是玻璃塞 B、③中反应的现象是溶液由红色变为无色 C、⑤中稀释浓硫酸时,倒入的乙物质是水 D、⑥中酚酞试液用完后,滴管应及时清洗10. 稀HCl和NaOH溶液混合后无明显现象,要证明两者已发生化学反应,下列操作及实验现象(或结果),不能证明反应发生的是( ) A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于711. 向一定量的 Ba(OH)2溶液中逐滴加入稀硫酸至过量,有关量的变化关系图正确的是( )A、
A、在混合液中加金属Zn,无气泡产生 B、在混合液中加无色酚酞,溶液呈无色 C、在混合液中加AgNO3溶液,有白色沉淀 D、用pH试纸测混合液的pH,测得pH等于711. 向一定量的 Ba(OH)2溶液中逐滴加入稀硫酸至过量,有关量的变化关系图正确的是( )A、 B、
B、 C、
C、 D、
D、 12. 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是()
12. 向一定量的硫酸铜和稀硫酸的混合溶液中滴加氢氧化钠溶液,产生的沉淀质量与加入的氢氧化钠溶液质量关系如图所示。下列说法错误的是() A、0~a段无沉淀生成是由于存在H+ B、a~c段出现的沉淀是Cu(OH)2 C、b点溶液中含硫酸 D、d点溶液的pH>713. 如图“五环旗”的上面3个环各代表一种液体,下面2个环各代表一种酸碱指示剂,两环相交部分表示指示剂跟有关液体混合后显示的颜色,下列选项中显示颜色不正确的是( )
A、0~a段无沉淀生成是由于存在H+ B、a~c段出现的沉淀是Cu(OH)2 C、b点溶液中含硫酸 D、d点溶液的pH>713. 如图“五环旗”的上面3个环各代表一种液体,下面2个环各代表一种酸碱指示剂,两环相交部分表示指示剂跟有关液体混合后显示的颜色,下列选项中显示颜色不正确的是( )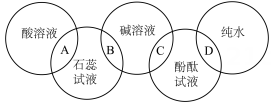 A、A部分为红色 B、B部分为蓝色 C、C部分为红色 D、D部分为蓝色14. 向一定量的稀硫酸中逐滴加入氢氧化钠溶液至过量,水和硫酸钠的质量随氢氧化钠溶液质量变化的关系图,下列说法正确的是( )
A、A部分为红色 B、B部分为蓝色 C、C部分为红色 D、D部分为蓝色14. 向一定量的稀硫酸中逐滴加入氢氧化钠溶液至过量,水和硫酸钠的质量随氢氧化钠溶液质量变化的关系图,下列说法正确的是( ) A、甲表示的物质为 , 乙表示的物质为 B、加入b克NaOH溶液时,还有剩余 C、加入a克NaOH溶液时,所得溶液中的阴离子为 D、加入c克NaOH溶液时,所得溶液呈中性15. 在甲图中,A、B、C、D表示4%的氢氧化钠水溶液和3.65%盐酸溶液的混合物;乙图表示各溶液的温度(所有溶液的起始温度均为22℃)。由于溶液较稀,故其密度均看作是1g/mL。下列有关图示的说法错误的是( )
A、甲表示的物质为 , 乙表示的物质为 B、加入b克NaOH溶液时,还有剩余 C、加入a克NaOH溶液时,所得溶液中的阴离子为 D、加入c克NaOH溶液时,所得溶液呈中性15. 在甲图中,A、B、C、D表示4%的氢氧化钠水溶液和3.65%盐酸溶液的混合物;乙图表示各溶液的温度(所有溶液的起始温度均为22℃)。由于溶液较稀,故其密度均看作是1g/mL。下列有关图示的说法错误的是( ) A、A点对应的溶液中离子数量最多 B、B点对应的溶液中滴加酚酞,酚酞变红色 C、C点相应的溶液中生成的水最多 D、往D点相应溶液中加入足量镁粉不产生气体16. 下列关于科学实验中“操作-现象-结论”的描述正确的是( )
A、A点对应的溶液中离子数量最多 B、B点对应的溶液中滴加酚酞,酚酞变红色 C、C点相应的溶液中生成的水最多 D、往D点相应溶液中加入足量镁粉不产生气体16. 下列关于科学实验中“操作-现象-结论”的描述正确的是( )操作
现象
结论
A
在某固体物质中加入稀盐酸
产生大量气泡
该物质一定是碳酸盐
B
在某溶液中加入氯化钡溶液和稀硝酸
产生白色沉淀
该溶液中一定含硫酸根离子
C
点燃未知气体,在火焰上罩一干冷小烧杯
烧杯内壁有水珠
该气体组成一定含有氢元素
D
将某固体的水溶液滴在pH试纸上
pH试纸变蓝色
该固体一定是碱
A、A B、B C、C D、D二、填空题
-
17. 科学家们对酸的认识经历了以下几个不同的阶段:
①1776年:法国化学家拉瓦锡在分析了几种酸的成分后提出“一切酸中都含有氧”。
②1811年:英国化学家戴维发现五氧化二碘(I2O5)只有溶于水后才具有酸性(HIO3),于是提出“只有氢才是酸不可缺少的元素”。
③1887年:瑞典化学家阿累尼乌斯经过多年实验与思考创立电离学说,指出“酸是能够在水溶液中产生氢离子 (H+)的化合物”。
④……
请结合以上信息回答下列问题:
(1)、从目前的认识来看,拉瓦锡的观点存在欠缺。请写出一种不符合他观点的酸的化学式:。(2)、根据戴维的发现推断,CO2能否使浸过紫色石蕊试液后干燥处理的纸花变色:。 (填“能”或“不能”)(3)、电离学说还指出碱是能够在水溶液中产生氢氧根离子(OH-)的化合物。根据以上观点,酸碱中和反应的实质就是H+和OH-结合成的过程。18. 通过学习,小明发现有些化学反应有明显现象,如(填化学式)和稀硫酸溶液的反应,可以看到蓝色絮状沉淀消失,该反应属于反应(填化学反应类型)。有些化学没有明显现象,如稀盐酸和氢氧化钠溶液的反应,小明设置了如图的装置进行实验,通过反应后U形管液面左低右高的现象来证明两者发生反应,出现这一现象的原因是。 19. 酸和碱反应是一类重要的化学反应。小科同学利用图1实验研究稀盐酸与氢氧化钠溶液反应的过程,并测量反应过程中溶液的pH和温度的变化情况,得到图2和图3,请回答下列问题:
19. 酸和碱反应是一类重要的化学反应。小科同学利用图1实验研究稀盐酸与氢氧化钠溶液反应的过程,并测量反应过程中溶液的pH和温度的变化情况,得到图2和图3,请回答下列问题: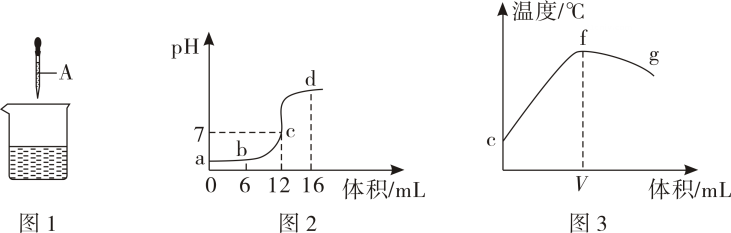 (1)、胶头滴管中A溶液的溶质是:(填化学式)。(2)、结合上图小科同学推断出图3中V的值为。(3)、下列说法正确的是____(可多选)A、图2中b点所示溶液中的溶质是NaCl和HCl B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加 D、图3中e→f变化趋势可说明该反应是放热反应.20. 如图是稀盐酸滴入装有氢氧化钠溶液的试管中,恰好完全反应的微观示意图,图中小球代表反应前后溶液中的离子种类。
(1)、胶头滴管中A溶液的溶质是:(填化学式)。(2)、结合上图小科同学推断出图3中V的值为。(3)、下列说法正确的是____(可多选)A、图2中b点所示溶液中的溶质是NaCl和HCl B、取图2中d点所示溶液加热蒸干所得固体为纯净物 C、图2中c→d所示溶液中NaCl的质量不断增加 D、图3中e→f变化趋势可说明该反应是放热反应.20. 如图是稀盐酸滴入装有氢氧化钠溶液的试管中,恰好完全反应的微观示意图,图中小球代表反应前后溶液中的离子种类。 (1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、微粒“O”代表的是(用符号表示)。21. 氢氧化钠与稀硫酸反应是否放出热量? 为探究此问题进行了实验。
(1)、请写出稀盐酸与氢氧化钠反应的实质:。(2)、微粒“O”代表的是(用符号表示)。21. 氢氧化钠与稀硫酸反应是否放出热量? 为探究此问题进行了实验。
 (1)、小陈同学按图甲实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由。(2)、小黄同学用乙图实验,可以根据现象证明该反应放出热量。(3)、小张同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量数据后绘制图像。由图丙可知,当反应进行到50s时溶液中的溶质是。(填溶质的化学式)22. 酸碱盐的用途十分广泛,请选择下列物质的序号填空。
(1)、小陈同学按图甲实验:在烧杯中先加入一定量的稀硫酸溶液,然后再加入适量的氢氧化钠固体,观察到温度计示数变大,于是得到“反应放出热量”的结论。你认为是否正确并说明理由。(2)、小黄同学用乙图实验,可以根据现象证明该反应放出热量。(3)、小张同学是将稀硫酸不断的滴入氢氧化钠溶液中,并用数字化仪器测量数据后绘制图像。由图丙可知,当反应进行到50s时溶液中的溶质是。(填溶质的化学式)22. 酸碱盐的用途十分广泛,请选择下列物质的序号填空。①熟石灰 ②浓硫酸 ③稀硫酸 ④稀盐酸 ⑤食盐 ⑥小苏打
(1)、能用于改良酸性土壤的是。(2)、通常可用于某些气体的干燥剂的是。23. 如图表示氢氧化钠溶液与盐酸反应的微观示意图。根据图示回答相关问题: (1)、图中 A 表示的微粒是(用微粒符号表示)
(1)、图中 A 表示的微粒是(用微粒符号表示)
(2)、该反应的实质是
(3)、下列物质能证明反应后盐酸有剩余的是____A、金属锌
B、酚酗试液
C、碳酸钠溶液
D、硝酸银溶液24. 小科在做稀盐酸和氢氧化钠溶液的反应的实验时,在烧杯中先加入某种溶液,再往烧杯逐滴滴加另一种液体,测得杯中溶液的pH随滴加液体体积变化的曲线如图所示。请判断a点所示溶液中含有的溶质是。
三、实验与探究题
-
25. 氢氧化钠溶液和稀盐酸混合没有明显现象,它们是否发生了反应呢?某科学兴趣小组设计如图甲所示实验进行探究。他们在盛有一定量稀盐酸的烧杯中放置pH传感器和温度传感器,然后开启电磁搅拌器,从滴定管中逐滴加入氢氧化钠溶液;计算机显示两种传感器所得的数据曲线如图乙和图丙。
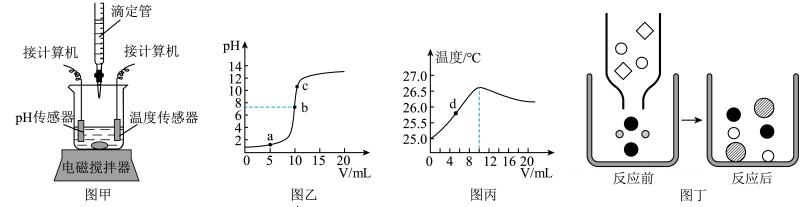 (1)、下列关于图乙、图丙的说法正确的是____(填字母)。A、图乙a点的溶液滴加无色酚酞试液变红色 B、图乙中 c 点表示的溶液中 Na+个数大于 Cl-个数 C、图丙中d点的溶液,滴加适量碳酸钠溶液会产生气泡(2)、由图丙可知,该反应为(选填“吸热”或“放热”)反应。(3)、图丁是图甲中氢氧化钠溶液和稀盐酸混合后相关变化的微观示意图,则反应后的“●”表示的微粒是(填微粒符号)。26. 化学兴趣小组同学做酸和碱的中和反应实验时,往溶液中滴入几滴酚酞溶液,发现酚酞溶液刚变红瞬间又褪成无色。同学们进行讨论并提出了如下猜想。
(1)、下列关于图乙、图丙的说法正确的是____(填字母)。A、图乙a点的溶液滴加无色酚酞试液变红色 B、图乙中 c 点表示的溶液中 Na+个数大于 Cl-个数 C、图丙中d点的溶液,滴加适量碳酸钠溶液会产生气泡(2)、由图丙可知,该反应为(选填“吸热”或“放热”)反应。(3)、图丁是图甲中氢氧化钠溶液和稀盐酸混合后相关变化的微观示意图,则反应后的“●”表示的微粒是(填微粒符号)。26. 化学兴趣小组同学做酸和碱的中和反应实验时,往溶液中滴入几滴酚酞溶液,发现酚酞溶液刚变红瞬间又褪成无色。同学们进行讨论并提出了如下猜想。猜想一:可能是酚酞溶液变质;
猜想二:可能与溶液的浓度有关;
猜想三:可能是酚酞溶液在滴入过程中被氧化……
(1)、甲同学认为猜想一是不对的,其理由是。(2)、取3mL不同浓度的溶液,分别滴入3滴酚酞溶液,观察现象。得到溶液的浓度与酚酞溶液褪色时间的关系如图所示。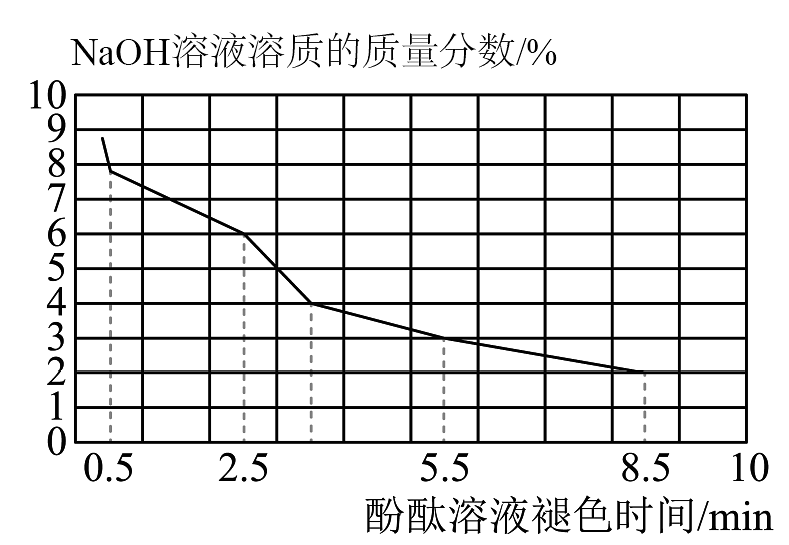
①根据上图所示,溶液溶质的质量分数(选填“越大”或“越小”),酚酞溶液由红色褪为无色的时间越短。
②做酸和碱的中和反应实验时,滴加酚酞溶液的目的是。
(3)、乙同学设计如下实验验证猜想三是否正确。请根据操作和结论推断该同学观察到的实验现象。实验操作
取3mL3%的氢氧化钠溶液于试管中,加热煮沸后,滴加植物油,冷却至室温后,向下方氢氧化钠溶液中滴加几滴酚酞溶液,轻轻振荡
实验现象
实验结论
酚酞溶液先变红后褪色与无关
27. 某化学兴趣小组用实验室常用药品(或溶液)对“KOH溶液与稀硫酸是否恰好完全反应”进行探究,该小组设计了两种不同方案,如下:【知识卡片】1.KOH与NaOH化学性质相似。2.溶液显中性
(1)、【实验探究】
方案一:某同学先向试管中加入2mLKOH溶液,再滴入几滴酚酞溶液,溶液变红,然后慢慢滴入稀硫酸,边滴边振荡,直至溶液恰好变为无色,边滴边振荡的原因是;②从微观的角度分析,该反应的实质是;
(2)、方案二:实验步骤
实验现象
结论
取2mLKOH溶液于试管中,滴入一定量的稀硫酸,振荡后加入镁条
若
稀硫酸过量
若没有明显现象
KOH溶液与稀硫酸恰好完全反应
(3)、另有同学提出方案二不能证明KOH溶液与稀硫酸恰好完全反应,其原因是。(4)、以上方案外,下列物质单独使用,也可以证明“KOH溶液与稀硫酸是否恰好完全反应”__(填序号)A、pH试纸 B、铁丝 C、氧化铜 D、紫色石蕊溶液28. 通过观察和实验等方法获取证据是科学探究的重要环节。向氢氧化钙溶液中滴加稀盐酸,无明显现象。两位同学欲获取反应发生的证据。 (1)、甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,观察到 , 可判断与发生了反应。(2)、乙同学向稀溶液中缓缓通入气体,如图a所示。测定该过程中溶液导电能力的变化,实验结果如图b(溶液体积、温度的变化可忽略)。
(1)、甲同学向滴有酚酞溶液的氢氧化钙溶液中,逐滴滴加稀盐酸至足量,观察到 , 可判断与发生了反应。(2)、乙同学向稀溶液中缓缓通入气体,如图a所示。测定该过程中溶液导电能力的变化,实验结果如图b(溶液体积、温度的变化可忽略)。①分析A→B段变化,其他条件相同,导电能力:(选填“>”、“<”或“=”)。
②分析B→C段变化,溶液的导电能力除了与离子种类有关,还与有关。
29. 将NaOH溶液与稀H2SO4混合,观察不到明显现象。为确定两溶液是否发生化学反应,小明设计了以下实验探究方案:(1)、 方案一:向装有一定量 NaOH 溶液的烧杯中滴入几滴指示剂,再逐滴滴加稀H2SO4 , 并不断振荡,观察到溶液由红色变为无色。据此判断两溶液发生了化学反应。实验中小明滴入的指示剂为。(2)、方案二:先用pH试纸测定NaOH溶液的pH,再滴加稀H2SO4 , 并不断振荡,测定混合溶液的pH,发现pH逐渐减小且小于7。据此判断两溶液发生了化学反应。①写出用pH试纸测定 NaOH 溶液的pH 的操作: 。
②方案中“测得pH小于7”是为了排除对实验的干扰。
(3)、方案三:向装有一定量稀H2SO4的试管中滴加NaOH溶液,充分振荡后再滴加Na2CO3溶液,发现没有气泡产生。据此判断两溶液发生了化学反应,理由是:。四、综合题
-
30. 小科按图示操作进行酸和碱反应的实验。
 (1)、盛放NaOH溶液的试剂瓶应密封储存,原因是;(2)、步骤③中判断两者恰好完全反应的实验现象是;(3)、酸碱反应的实质是:(用离子方程式表示)。31. 将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答:
(1)、盛放NaOH溶液的试剂瓶应密封储存,原因是;(2)、步骤③中判断两者恰好完全反应的实验现象是;(3)、酸碱反应的实质是:(用离子方程式表示)。31. 将40g稀盐酸逐滴加入到20g溶质质量分数为4%的氢氧化钠溶液中,边滴加边搅拌。随着稀盐酸的滴加,溶液的pH变化如图一所示,溶液的温度变化如图二所示(不考虑反应过程中热量损失)。试回答: (1)、图二从A到B过程中,溶液的pH逐渐(填“增大”或“减小”);(2)、图二C点时溶液中溶质有;(3)、计算稀盐酸中溶质的质量分数。32. 实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图所示.请回答下列问题:
(1)、图二从A到B过程中,溶液的pH逐渐(填“增大”或“减小”);(2)、图二C点时溶液中溶质有;(3)、计算稀盐酸中溶质的质量分数。32. 实验室有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8g10%的NaOH溶液.然后往烧杯中滴加该盐酸.反应过程中溶液的pH与滴入盐酸的质量关系如图所示.请回答下列问题: (1)、配制了8g10%的NaOH溶液,需要水的质量为g;(2)、计算该盐酸的溶质质量分数;(写出计算过程)
(1)、配制了8g10%的NaOH溶液,需要水的质量为g;(2)、计算该盐酸的溶质质量分数;(写出计算过程)