4 常见的碱及其性质
试卷更新日期:2025-07-13 类型:同步测试
一、选择题
-
1. 宏观辨识与微观探析是科学学习的重要思想方法。借助它们有助于理解物质具有性质或发生变化的规律,以下对宏观事实的微观解释错误的是( )
选项
宏观事实
微观解释
A
氨水呈碱性
NH3·H2O能电离出OH—
B
用稀盐酸辨别氯化钠溶液与碳酸钠溶液
氯离子和钠离子结合生成氯化钠
C
CuSO4溶液呈蓝色
溶液中存在Cu2+
D
稀盐酸和稀硫酸具有相似的化学性质
两种溶液中都含有H+
A、A B、B C、C D、D2. 某化学小组利用数字化传感器探究氢氧化钠与二氧化碳的反应。在烧瓶内收集满CO2, 如图I所示,T 开K, 将注射器内的液体同时迅速注入烧瓶内,关闭K, 一段时间后,同时振荡烧瓶,观察到甲中有白 色沉淀生成,乙中无明显现象。通过压强传感器测得烧瓶内压强随时间的变化如图Ⅱ所示,曲线①和曲 线②分别表示甲、乙两个烧瓶内的压强变化。下列说法错误的是( ) A、上述实验可以证明氢氧化钠与二氧化碳能发生反应 B、通过图Ⅱ可知,吸收大量的CO2 最好选用澄清石灰水 C、图Ⅱ中AB 段曲线上升的原因是用注射器注入液体,压缩烧瓶内的气体,压强增大 D、图Ⅱ中点C、点 E 对应的实验操作是振荡烧瓶3. 向某硫酸和硫酸铜的混合溶液中加入一定浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( )
A、上述实验可以证明氢氧化钠与二氧化碳能发生反应 B、通过图Ⅱ可知,吸收大量的CO2 最好选用澄清石灰水 C、图Ⅱ中AB 段曲线上升的原因是用注射器注入液体,压缩烧瓶内的气体,压强增大 D、图Ⅱ中点C、点 E 对应的实验操作是振荡烧瓶3. 向某硫酸和硫酸铜的混合溶液中加入一定浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是( ) A、a点溶液中含有两种溶质 B、bc段发生反应的类型为置换反应 C、根据图中数据可以计算出氢氧化钠溶液的浓度 D、d点溶液中主要存在的离子为Na+、Cu2+、OH-、S042-4. 一定温度下,向含有适量酚酞溶液的稀盐酸中慢慢滴加氢氧化钠溶液,溶液温度随加入氢氧化钠溶液质量变化的曲线如图所示。下列叙述正确的是
A、a点溶液中含有两种溶质 B、bc段发生反应的类型为置换反应 C、根据图中数据可以计算出氢氧化钠溶液的浓度 D、d点溶液中主要存在的离子为Na+、Cu2+、OH-、S042-4. 一定温度下,向含有适量酚酞溶液的稀盐酸中慢慢滴加氢氧化钠溶液,溶液温度随加入氢氧化钠溶液质量变化的曲线如图所示。下列叙述正确的是 A、该化学反应吸热 B、M点时溶液呈红色 C、N点时溶液pH最大 D、P点时溶液中至少含两种溶质5. 向一定量的 NaOH溶液中逐滴加入CuCl2溶液至过量,下列有关量的变化关系图正确的是A、
A、该化学反应吸热 B、M点时溶液呈红色 C、N点时溶液pH最大 D、P点时溶液中至少含两种溶质5. 向一定量的 NaOH溶液中逐滴加入CuCl2溶液至过量,下列有关量的变化关系图正确的是A、 B、
B、 C、
C、 D、
D、 6. 小宁同学搜集了一些日常生活用品并查阅了其有效成分如表所示。下列分析不正确的是( )
6. 小宁同学搜集了一些日常生活用品并查阅了其有效成分如表所示。下列分析不正确的是( )物品名称
洁厕灵
炉具清洁剂
食品干燥剂
苏打粉
有效成分
HCl
NaOH
CaO
NaHCO3
A、食品干燥剂在吸水过程中会放热 B、苏打粉可以用于馒头的制作 C、生活中可用洁厕灵清除卫生间的水垢[水垢主要成分为CaCO3和Mg(OH)2] D、若洁厕灵与炉具清洁剂混合后呈碱性,则溶液中阴离子只有OH-7. 小科为了探究氢氧化钙的性质做了以下实验。下列实验中能观察到蓝色絮状沉淀的是A、 B、
B、 C、
C、 D、
D、 8. “化学棋”游戏规则:①每粒棋子代表一种物质,②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉,③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子( )
8. “化学棋”游戏规则:①每粒棋子代表一种物质,②吃子:所选棋子能与棋盘(如图)中的某棋子发生反应,则棋盘中的该棋子被吃掉,③连吃:前一次反应的生成物能与另一棋子发生反应时,则该棋子也被吃掉。若一次就可连续吃掉棋盘上的所有棋子,应选择的棋子( ) A、
A、 B、
B、 C、
C、 D、
D、 9. 我国研制的宇航服内含有氢氧化锂(LiOH),其化学性质与氢氧化钠相似,下列有关氢氧化锂化学性质说法正确的是( )A、能与二氧化碳反应 B、能与氧化铁反应 C、能与氯化钠溶液反应 D、能与碳酸钡反应10. 科学学习小组做导电性实验,按照图连接好线路发现灯泡不发光,往烧杯中加水溶解后灯泡发光,欲使灯泡熄灭可向烧杯中加入的物质是( )
9. 我国研制的宇航服内含有氢氧化锂(LiOH),其化学性质与氢氧化钠相似,下列有关氢氧化锂化学性质说法正确的是( )A、能与二氧化碳反应 B、能与氧化铁反应 C、能与氯化钠溶液反应 D、能与碳酸钡反应10. 科学学习小组做导电性实验,按照图连接好线路发现灯泡不发光,往烧杯中加水溶解后灯泡发光,欲使灯泡熄灭可向烧杯中加入的物质是( )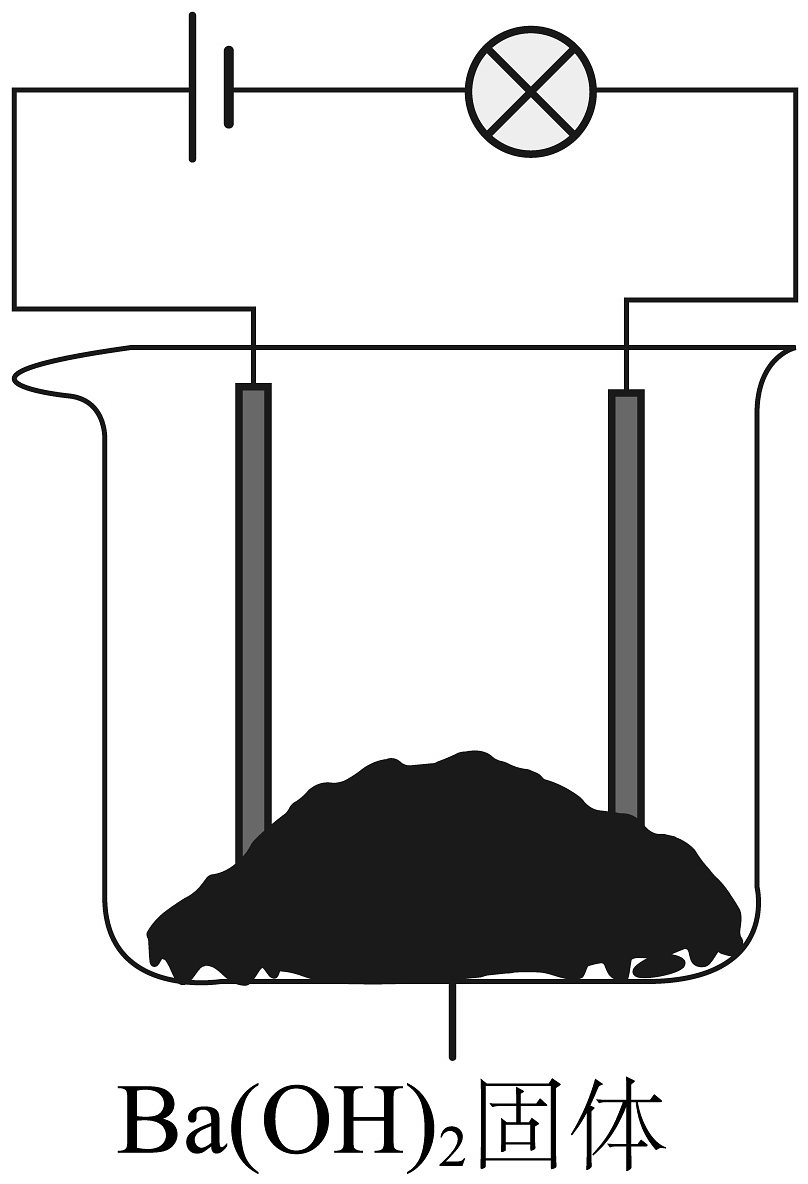 A、CuSO4溶液 B、NaNO3溶液 C、NaOH溶液 D、HCl溶液11. 将一定质量的Ba(OH)2 溶液与Na2CO3 溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是
A、CuSO4溶液 B、NaNO3溶液 C、NaOH溶液 D、HCl溶液11. 将一定质量的Ba(OH)2 溶液与Na2CO3 溶液混合恰好完全反应,向反应后的混合物中加入稀盐酸,产生气体的体积与加入稀盐酸的体积的关系如图所示,下列说法中正确的是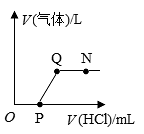 A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O12. 向一定量硫酸铜溶液中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是
A、N点时,所得溶液的pH=7 B、Q点时,所得溶液中的溶质只含有BaCl2 C、O至P段发生反应的化学方程式为NaOH+HCl=NaCl+H2O D、P至Q段发生反应的化学方程式为Ba(OH)2+2HCl=BaCl2+2H2O12. 向一定量硫酸铜溶液中逐滴加入氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法正确的是  A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、B 点时溶液pH=7 D、A点到 B 点硫酸钠质量不变
A、产生的沉淀为红褐色 B、A点时溶液中有两种溶质 C、B 点时溶液pH=7 D、A点到 B 点硫酸钠质量不变二、填空题
-
13. 用符合下列要求的物质的序号填空:
①稀硫酸 ②浓盐酸 ③浓硫酸 ④烧碱 ⑤熟石灰
(1)、具有挥发性的是。(2)、可用于干燥二氧化碳气体的是。(3)、可用于改良酸性土壤的是。14. 灵灵比较氢氧化钠和氢氧化钙的性质,做了下面的实验,请回答下列问题。 (1)、对比甲、乙实验,说明具有吸水性的固体是:。(2)、取出培养皿并配置溶液,久置于空中,则两个培养皿中会出现浑浊的溶液是:。(3)、丙、丁处反应产生的气体是。15. 某同学使用图甲所示实验装置进行实验,广口瓶内气球的体积与滴加药品质量的关系如图乙所示,其中A 点开始滴加某种药品,B点开始改滴另一种药品(不考虑 CO2溶解及滴入液体对瓶内气压的影响)。据图回答:
(1)、对比甲、乙实验,说明具有吸水性的固体是:。(2)、取出培养皿并配置溶液,久置于空中,则两个培养皿中会出现浑浊的溶液是:。(3)、丙、丁处反应产生的气体是。15. 某同学使用图甲所示实验装置进行实验,广口瓶内气球的体积与滴加药品质量的关系如图乙所示,其中A 点开始滴加某种药品,B点开始改滴另一种药品(不考虑 CO2溶解及滴入液体对瓶内气压的影响)。据图回答: (1)、实验中首先加入的试剂是;(2)、CD段气球体积变大的原因是(用化学方程式表示);(3)、D点时溶液中溶质是。16. 实验桌上有一瓶敞口放置已久的 NaOH溶液,为探究其是否变质,小丽进行了如下探究:
(1)、实验中首先加入的试剂是;(2)、CD段气球体积变大的原因是(用化学方程式表示);(3)、D点时溶液中溶质是。16. 实验桌上有一瓶敞口放置已久的 NaOH溶液,为探究其是否变质,小丽进行了如下探究:实验步骤
现象
步骤一
取少量溶液样品于试管中,向其中滴加足量的氯化钙溶液。
产生白色沉淀
步骤二
过滤,向滤液中滴加酚酞溶液。
酚酞溶液变红
(1)、由实验可知,该NaOH 溶液(选填“没有变质”、“部分变质”或“全部变质”);(2)、若步骤一与步骤二顺序调换,(填“能”或“不能”)得出上述结论;(3)、小丽第二次滴加的试剂除用指示剂外,还可以用替代(写出一种试剂)。17. 随着工业迅速发展,大气污染成为了我们面临的一个巨大危机。其中,酸雨和工业生产中排放的二氧化硫、氮氧化物等酸性气体密切相关。(1)酸雨是指的酸性降水,它会使土壤酸化,施用适量可改良土壤酸性。
(2)这些造成酸雨的气体可以用碱溶液来吸收,如氢氧化钠溶液能够吸收气体,请写出该反应方程式:。
18. 图甲装置可显示溶液中离子浓度的变化,已知溶液导电性与溶液中离子浓度的关系如图乙所示。 (1)、若试剂A是CuSO4 , 为使灯光变化出现“亮→灭→亮”现象,试剂B可能是。(2)、装置中灯泡变暗能够说明溶液中离子浓度下降,请解释其中的原理:。19. 右图是下列三种物质相互转化时的关系图,其中“→”表示物质之间能转化。
(1)、若试剂A是CuSO4 , 为使灯光变化出现“亮→灭→亮”现象,试剂B可能是。(2)、装置中灯泡变暗能够说明溶液中离子浓度下降,请解释其中的原理:。19. 右图是下列三种物质相互转化时的关系图,其中“→”表示物质之间能转化。 (1)、若要实现反应②,可向盛有氧化镁的试管中加入药品(填名称) 。(2)、若反应③中加入的是氢氧化钠溶液,则观察到的现象是 , 该发应涉及的反应类型是(填基本反应类型)。20. 如图为“领取奖杯游戏”的物质阶梯,当阶梯上相邻物质之间能发生反应时,方可向上攀登。如攀登阶梯甲能领取奖杯。
(1)、若要实现反应②,可向盛有氧化镁的试管中加入药品(填名称) 。(2)、若反应③中加入的是氢氧化钠溶液,则观察到的现象是 , 该发应涉及的反应类型是(填基本反应类型)。20. 如图为“领取奖杯游戏”的物质阶梯,当阶梯上相邻物质之间能发生反应时,方可向上攀登。如攀登阶梯甲能领取奖杯。 (1)、认识阶梯甲
(1)、认识阶梯甲①阶梯上的5种物质中,属于氧化物的是(填化学式);
②攀登过程中 Ca(OH)2和CO2反应的化学方程式为。
(2)、搭建阶梯乙请你从O2、Al、Al2O3、HCl、NaOH中选择四种物质放置在图中相应的台阶上,使攀登阶梯乙能领取奖杯,则阶梯乙最低的台阶上的物质应为(填化学式)。
三、实验与探究题
-
21. 兴趣小组借助数字技术探究“稀盐酸与氢氧化钠溶液反应”,图1是室温下稀盐酸与氢氧化钠溶液反应的实验装置,图2是反应过程中溶液的pH变化曲线。
 (1)、根据图2曲线判断,图1中的溶液B是。(2)、图2中a点所示的溶液呈现(选填“酸性”、“碱性”或“中性”)。(3)、 c 点所示的溶液中Na+个数Cl-个数。(选填“>”、 “<”或“=”)。(4)、从a点到b点pH变化的微观本质是。22. 兴趣小组的同学在学习了酸与碱的性质后,从不同角度对“稀盐酸与氢氧化钠溶液混合后是否反应”进行了如下实践探究:(1)、I.从反应物角度
(1)、根据图2曲线判断,图1中的溶液B是。(2)、图2中a点所示的溶液呈现(选填“酸性”、“碱性”或“中性”)。(3)、 c 点所示的溶液中Na+个数Cl-个数。(选填“>”、 “<”或“=”)。(4)、从a点到b点pH变化的微观本质是。22. 兴趣小组的同学在学习了酸与碱的性质后,从不同角度对“稀盐酸与氢氧化钠溶液混合后是否反应”进行了如下实践探究:(1)、I.从反应物角度实验操作:在盛有氢氧化钠溶液的试管中,滴加1滴酚酞试液,再逐滴加入稀盐酸,发现红色褪去。
实验结论:稀盐酸与氢氧化钠溶液混合后发生了化学反应。以上实验结论基于的证据是:滴加稀盐酸后发现红色褪去,说明氢氧化钠溶液中的(填离子符号)数量明显减少。
(2)、II.从生成物角度查阅资料:常温下氢氧化钠与氯化氢气体在乙醇中均易溶,而氯化钠在乙醇中微溶。
实验操作:
①在盛有浓盐酸的锥形瓶中用注射器抽取氯化氢气体(如图甲);
②将注射器中的氯化氢气体缓慢通入盛有氢氧化钠乙醇溶液的试管中(如图乙);
③观察实验现象。
实验结论:稀盐酸与氢氧化钠溶液混合后发生了化学反应。

操作①中用注射器可以在锥形瓶中抽取氯化氢气体,是因为浓盐酸具有。
(3)、以上实验结论基于的实验现象是:。(4)、乙图实验中,无水硫酸铜的作用是:。23. 在探究和是否会发生化学反应的实验中。(1)小柯同学设计了如图甲所示的实验装置。他将胶头滴管中的氢氧化钠溶液挤入锥形瓶内,观察到 , 得出和发生了化学反应。
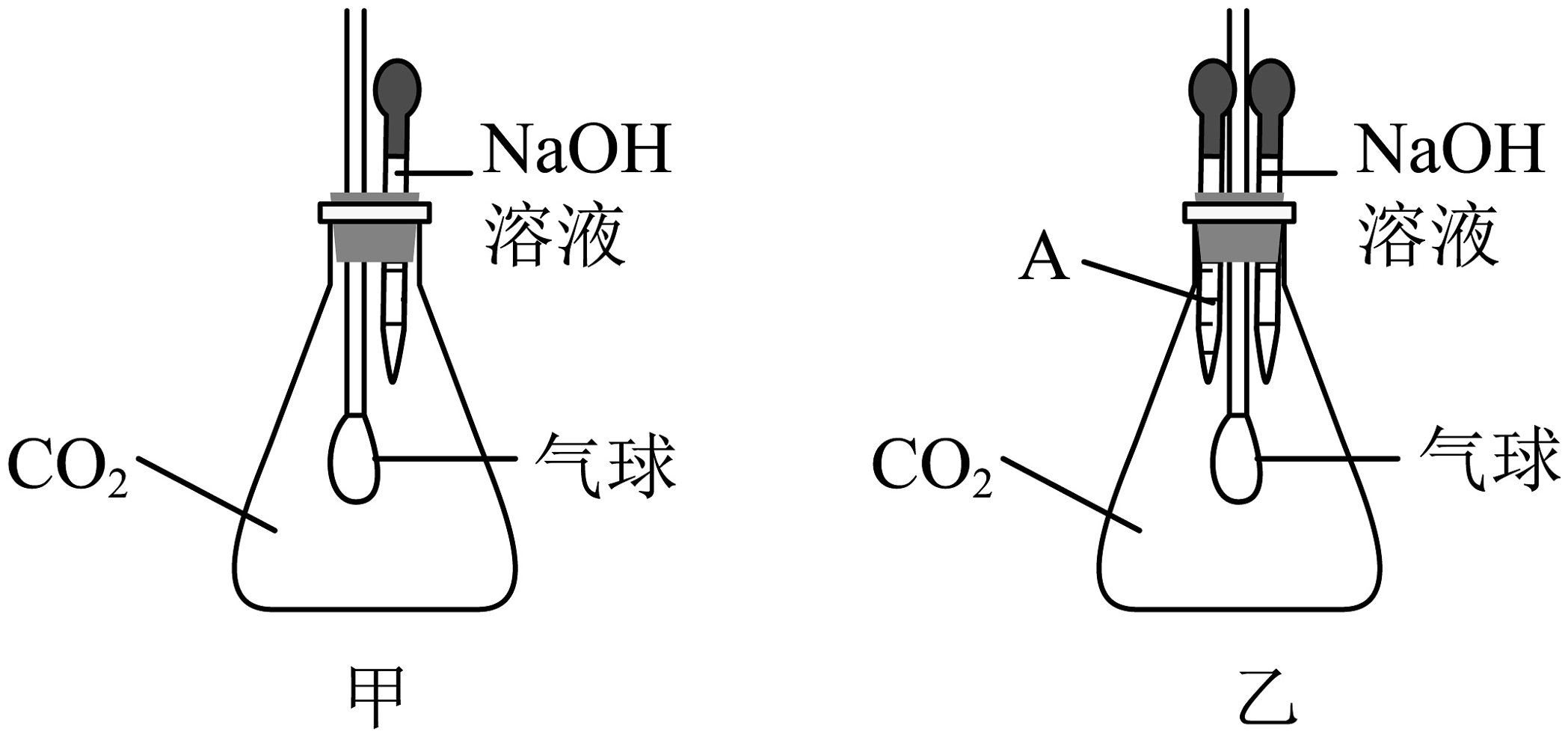
(2)小妍认为上述实验存在缺陷,于是对图甲装置进行了改进,添加了胶头滴管A(如图乙所示)。滴管A中应盛放的液体是 , 操作过程中,两种液体的滴入顺序为。
24. 试剂A、B、C分别是Na2CO3溶液、稀盐酸和Ca(OH)2溶液中的一种。某同学进行如图所示的实验,观察到试管①中无明显现象,试管②中溶液变浑浊。实验结束后,该同学把试管①、②中的物质全部倒入烧杯中,发现溶液变澄清,并有气泡冒出。
(1)由上述实验现象可知,A是。
(2)写出烧杯中溶液变澄清的反应的化学方程式:。
(3)烧杯中所得溶液的溶质可能是。(可多选,填字母)
A.NaCl、Na2CO3 B.NaCl、CaCl2、HCl C.NaCl、CaCl2 D.NaCl、CaCl2、Na2CO3
25. 在学习酸碱中和反应时,同学们发现酸与碱反应的现象并不明显。如何证明它们发生了反应? (1)、方案一:小科利用酸碱指示剂证明酸与碱发生了反应。
(1)、方案一:小科利用酸碱指示剂证明酸与碱发生了反应。
小科取一定量的氢氧化钠溶液于小烧杯中,滴加2~3滴无色酚酞试液;用胶头滴管吸取稀盐酸,逐滴滴入烧杯中,边滴边用玻璃棒搅拌,直至看到的现象时,小科认为两者发生了化学反应。(2)、方案二:小宁利用水的生成证明酸与碱发生了反应。小宁取变色硅胶、无水醋酸和氢氧化钠固体进行了如图甲所示的三个实验。
【小资料】Ⅰ.变色硅胶吸水后由蓝色变为红色;
Ⅱ.无水醋酸是一种酸,常温下为无色液体。
能证明无水醋酸与氢氧化钠固体反应的现象是。
(3)、方案三:小亮利用温度变化来证明酸与碱发生了反应。小亮使用图乙装置向氢氧化钠稀溶液中逐滴加入稀盐酸,得到图丙。
由图丙可知,酸与碱的反应为(填“吸热”或“放热”)反应。
(4)、实验时,不能用氢氧化钠固体代替氢氧化钠稀溶液进行实验的原因是。26. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小科取少量样品配制成溶液,再取少量溶液分别装入两支试管中,进行了如甲、乙所示实验。(溶液呈中性) (1)、小科认为“甲图实验说明了氢氧化钠固体没有变质”。你认为小科的观点是否正确,并说明理由。(2)、分析乙图实验的现象,可以确定样品的变质情况为(选填“未变质”、“部分变质”或“完全变质”),滴加足量的氯化钡溶液的目的是。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图(答题卡上作图)画出“生成的质量随加入稀盐酸质量变化”的大致图像。27. 某兴想小组以“探究二氧化碳能否与氢氧化钠反应”为主题展开化学反应可视化的项目式学习。
(1)、小科认为“甲图实验说明了氢氧化钠固体没有变质”。你认为小科的观点是否正确,并说明理由。(2)、分析乙图实验的现象,可以确定样品的变质情况为(选填“未变质”、“部分变质”或“完全变质”),滴加足量的氯化钡溶液的目的是。(3)、进一步探究:另取少量样品溶液,加入一定质量分数的稀盐酸,直至过量。请在丙图(答题卡上作图)画出“生成的质量随加入稀盐酸质量变化”的大致图像。27. 某兴想小组以“探究二氧化碳能否与氢氧化钠反应”为主题展开化学反应可视化的项目式学习。
【任务一】证明反应物的减少或消失
实验一:数字化实验。
(1)、按图甲所示进行实验,得到了图乙中的曲线。请分析判断,表示二氧化碳与氢氧化钠溶液反应的是哪条曲线?。【任务二】证明有新物质生成
(2)、实验二:产物转化法实验。完成下列表格第一组
第二组
步骤1
向氢氧化钠溶液中通入二氧化碳
向氢氧化钠溶液中通入二氧化碳
步骤2
向上述溶液中滴加足量CaCl2溶液。
向上述溶液中滴加足量的②
实验现象
①
有气泡产生
实验结论
氢氧化钠溶液与三氧化碳发生了反应
(3)、实验三:绿色化实验查阅资料:氢氧化钠易溶于乙醇,碳酸钠微溶于乙醇
进行实验:如图丙所示,取2mL4%的氢氧化钠乙醇溶液于试管中,·向试管中吹气约30秒。
实验现象:。
实验结论:氢氧化钠与二氧化碳发生反应。
四、综合题
-
28. 如图中有A、B、C、D、E、F六种物质,它们是硝酸铜、碳酸钠、氯化钡、稀硫酸、氢氧化钙五种溶液和单质锌,凡是用直线相连的两种物质间均可发生化学反应。试推断:
 (1)、A是;D是。(2)、C跟F反应的化学方程式为:。29. 图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8g,将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入溶液能生成一种不溶于稀硝酸的白色沉淀。
(1)、A是;D是。(2)、C跟F反应的化学方程式为:。29. 图甲中A是一种常见的酸,它能与黑色固体B反应,B质量为8g,将NaOH溶液渐渐加入到C中,生成蓝色沉淀E的质量与加入NaOH溶液的质量关系如图乙所示,在D中加入溶液能生成一种不溶于稀硝酸的白色沉淀。 (1)、NaOH溶液中溶质的质量分数是多少?(2)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是多少?30. 具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含和的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:
(1)、NaOH溶液中溶质的质量分数是多少?(2)、C溶液中加入NaOH溶液至恰好完全反应时,所得溶液溶质的质量是多少?30. 具有广泛的应用,常用菱镁矿制备。研究人员向一定质量的菱镁矿粉中加入过量的稀硫酸,充分溶解后除杂、过滤,得到只含和的混合溶液,为确定混合溶液中镁的含量,取4份混合溶液各100g,向每份混合溶液中加入一定质量的4%NaOH溶液,得到实验数据如下表所示:实验编号
①
②
③
④
NaOH溶液质量/g
10.0
20.0
30.0
40.0
质量/g
0.232
0.522
0.580
0.580
 (1)、计算100g混合溶液中含的质量(写出计算过程)。(2)、分析实验数据,在图中画出加入4%NaOH溶液质量0-30.0g过程中,产生沉淀质量对应的变化图,并标注必要的数值。
(1)、计算100g混合溶液中含的质量(写出计算过程)。(2)、分析实验数据,在图中画出加入4%NaOH溶液质量0-30.0g过程中,产生沉淀质量对应的变化图,并标注必要的数值。