2025年内蒙古中考化学真题
试卷更新日期:2025-07-11 类型:中考真卷
一、选择题(共7小题,每小题2分,共14分。每小题给出的四个选项中,只有一项符合题目要求)
-
1. 2025年4月,神舟二十号载人飞船在长征二号F遥二十运载火箭托举下顺利升空,并与中国空间站精准对接。下列相关过程以化学变化为主的是( )A、火箭与飞船合体完成组装 B、引燃推进剂实现火箭发射 C、飞船入轨后展开太阳能帆板 D、导航系统引导飞船精准对接2. 兴趣小组开展了“探究土壤酸碱性对植物生长的影响”跨学科实践活动。下列有关实验操作规范的是( )A、
 称量土样
B、
称量土样
B、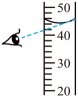 量取蒸馏水
C、
量取蒸馏水
C、 溶解土样
D、
溶解土样
D、 测酸碱度
3. 镝是一种稀土元素,可用于制造硬盘驱动器和电动汽车引擎。镝元素在元素周期表中的信息如图所示。下列说法不正确的是( )
测酸碱度
3. 镝是一种稀土元素,可用于制造硬盘驱动器和电动汽车引擎。镝元素在元素周期表中的信息如图所示。下列说法不正确的是( )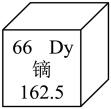 A、镝属于金属元素 B、镝的元素符号为Dy C、镝原子的核电荷数是66 D、一个镝原子的质量为162.5g4. 超临界水是将水加热到超过并加压到超过219个大气压,使水处于气、液相互交融的状态。超临界水减压转化为水蒸气的过程中,从微观角度分析发生改变的是( )A、分子的间隔 B、分子的大小 C、分子的质量 D、分子的种类5. 碳是给人类社会提供能源和材料的主要元素。下列含碳元素物质的性质与用途对应关系不正确的是( )
A、镝属于金属元素 B、镝的元素符号为Dy C、镝原子的核电荷数是66 D、一个镝原子的质量为162.5g4. 超临界水是将水加热到超过并加压到超过219个大气压,使水处于气、液相互交融的状态。超临界水减压转化为水蒸气的过程中,从微观角度分析发生改变的是( )A、分子的间隔 B、分子的大小 C、分子的质量 D、分子的种类5. 碳是给人类社会提供能源和材料的主要元素。下列含碳元素物质的性质与用途对应关系不正确的是( )选项
性质
用途
A
活性炭具有很强的吸附性
可作净水材料
B
石墨具有优良的导电性
可制铅笔芯
C
干冰容易升华
可作制冷剂
D
甲烷具有可燃性且热值高
可作气体燃料
A、A B、B C、C D、D6. 乙醇是重要的有机溶剂,工业上用乙烯与水在一定条件下制取,该反应的微观示意图如下、下列说法正确的是( )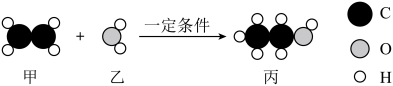 A、反应前后原子种类没有改变 B、反应前后分子数目没有改变 C、该反应中共涉及2种氧化物 D、甲中碳元素和氢元素的质量比是1:27. 小羽设计如图装置进行“可燃物燃烧条件”的验证实验。将等质量的白磷置于①②③处,观察到①处白磷燃烧,②③处白磷不燃烧。下列说法不正确的是( )
A、反应前后原子种类没有改变 B、反应前后分子数目没有改变 C、该反应中共涉及2种氧化物 D、甲中碳元素和氢元素的质量比是1:27. 小羽设计如图装置进行“可燃物燃烧条件”的验证实验。将等质量的白磷置于①②③处,观察到①处白磷燃烧,②③处白磷不燃烧。下列说法不正确的是( )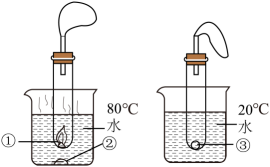 A、对比①③处现象,说明可燃物燃烧需要温度达到着火点 B、对比①②处现象,说明可燃物燃烧需要空气(氧气) C、②③处白磷均不燃烧的原因相同 D、装置中气球可以起到防止污染空气的作用
A、对比①③处现象,说明可燃物燃烧需要温度达到着火点 B、对比①②处现象,说明可燃物燃烧需要空气(氧气) C、②③处白磷均不燃烧的原因相同 D、装置中气球可以起到防止污染空气的作用二、非选择题(共5小题,共26分)
-
8. 阅读科普短文,回答下列问题。
内蒙古的特色饮品奶茶是先用砖茶制成茶汤,后加牛奶再撒少许食盐熬制而成。砖茶中含有30多种酚类物质,总称为茶多酚。茶多酚是决定茶叶色、香、味的重要成分,有降血压、抗衰老等保健功能,易溶于温水,在潮湿的空气中易被氧化。
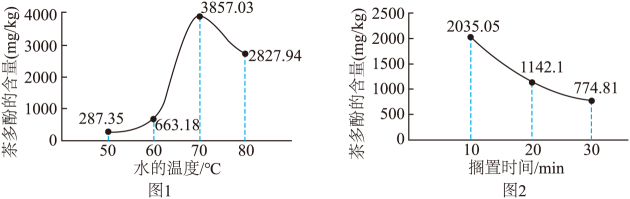
为适应快节奏生活,将制作奶茶的原料加工成奶茶粉,深受现代人们的喜爱。某种奶茶粉冲调时,溶解的茶多酚含量随水温的变化如图1所示。冲调后,恒温下测得溶解的茶多酚含量随搁置时间的变化如图2所示。
奶茶有补充营养、改善情绪等功效,但是过度饮用会导致糖分、脂肪等摄入过多,引起肥胖,不利于人体健康。
(1)、熬制奶茶的原料中富含蛋白质的物质是。(2)、茶多酚所属的物质类别为(填“混合物”或“纯净物”)。(3)、结合短文,据图1分析,奶茶粉的最佳冲调温度为℃;据图2分析,茶多酚含量随着搁置时间延长逐渐减少,原因可能是。9. 宋代《开宝本草》中记载了的制取过程,“所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。据此回答下列问题。(1)、“地上有霜”,是在“冬月”因温度降低,溶解度(域“增大”“减小”或“不变”)而结晶析出。(2)、“扫取”时常会混入泥沙,“以水淋汁”是进行溶解,再用的方法除去难溶性杂质。(3)、“煎炼”至有晶体析出时,溶液是(填“饱和”或“不饱和”)溶液。(4)、你认为通过以上制取过程能否得到纯净的 , 判断并说明理由:。10. 实验小组对Al和溶液的反应进行探究。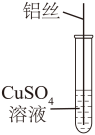 (1)、根据金属活动性顺序AlCu,小组同学一致认为Al和溶液能够发生反应。(2)、小林将铝丝浸入溶液一段时间,没有观察到明显现象。结合铝的化学性质分析,原因是。(3)、小艺对小林的实验操作进行了改进,观察到明显现象。小艺的实验操作是 , 观察到的实验现象是。11. 氧气在生产、生活和生命活动中发挥着重要作用。兴趣小组以“氧气的制备”为主题开展了项目式学习活动。
(1)、根据金属活动性顺序AlCu,小组同学一致认为Al和溶液能够发生反应。(2)、小林将铝丝浸入溶液一段时间,没有观察到明显现象。结合铝的化学性质分析,原因是。(3)、小艺对小林的实验操作进行了改进,观察到明显现象。小艺的实验操作是 , 观察到的实验现象是。11. 氧气在生产、生活和生命活动中发挥着重要作用。兴趣小组以“氧气的制备”为主题开展了项目式学习活动。I、实验室制氧气
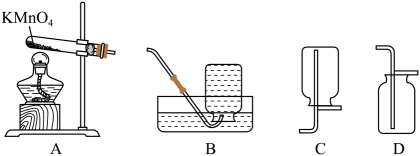 (1)、用A装置制取氧化,反应的化学方程式为 , 基本反应类型为。(2)、若要收集一瓶较为纯净的氧气,应选择的收集装置是(填序号)。
(1)、用A装置制取氧化,反应的化学方程式为 , 基本反应类型为。(2)、若要收集一瓶较为纯净的氧气,应选择的收集装置是(填序号)。Ⅱ、工业制氧气
(3)、利用分离液态空气法制氧气。在低温下加压,使空气转变为液态,当液态空气升温时,由于液氮沸点比液氧沸点 , 液氮先汽化,剩下的主要是液氧。(4)、利用膜分离法制氧气。如下图所示,利用氧分子的体积(填“大于”“小于”或“等于”)氮分子的体积实现分离,从而获得高浓度的氧气。 (5)、Ⅲ、空间站内的氧气再生空间站内电解产生的供航天员呼吸,产生的与航天员呼出的通过“萨巴蒂尔反应”系统转化为和 , 生成的再进行电解,实现的再生。示意图如下。
(5)、Ⅲ、空间站内的氧气再生空间站内电解产生的供航天员呼吸,产生的与航天员呼出的通过“萨巴蒂尔反应”系统转化为和 , 生成的再进行电解,实现的再生。示意图如下。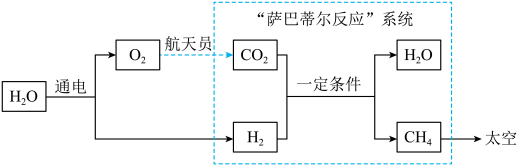
“萨巴蒂尔反应”系统中发生反应的化学方程式为。(6)、电解水的质量为 , “萨巴蒂尔反应”系统中生成水的质量为的原因是。(忽略非反应损耗)12. 实验小组取一定量的稀盐酸于烧杯中,向其中逐滴加入氢氧化钠溶液,通过数字传感器测得烧杯中溶液的pH和温度变化曲线如图所示。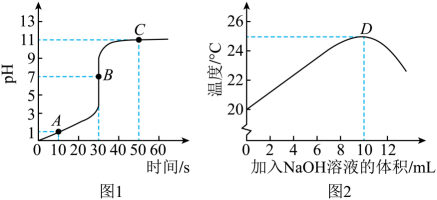 (1)、分析图1的曲线,当反应进行至点时,溶液呈性;若用酚酞溶液作该反应的指示剂,溶液在点时呈色。(2)、分析图1和图2的曲线,可知该反应属于(填“吸热”或“放热”)反应,点对应的时间:第s。(3)、若烧杯中盛放10g溶质质量分数为的稀盐酸,计算恰好完全反应时,消耗氢氧化钠的质量。(写出计算过程)
(1)、分析图1的曲线,当反应进行至点时,溶液呈性;若用酚酞溶液作该反应的指示剂,溶液在点时呈色。(2)、分析图1和图2的曲线,可知该反应属于(填“吸热”或“放热”)反应,点对应的时间:第s。(3)、若烧杯中盛放10g溶质质量分数为的稀盐酸,计算恰好完全反应时,消耗氢氧化钠的质量。(写出计算过程)