广东省大湾区万阅联盟2025年中考模拟化学试卷(二)
试卷更新日期:2025-06-10 类型:中考模拟
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 我国很多珍贵文物都记载着中华文明的灿烂成就。下列文物用到金属材料的是


A.瓷罐
B.铜奔马


C.玉如意
D.山水画卷
A、A B、B C、C D、D2. “垃圾是放错位置的资源”,废旧书籍应投入的垃圾箱是A、 B、
B、 C、
C、 D、
D、 3. “化学史给人以智慧”,下列化学史不符合事实的是A、门捷列夫编制出元素周期表 B、侯德榜最早发现并使用石蕊 C、张青莲主持测定铟元素的相对原子质量新值 D、徐光宪提出稀土分离技术4. 化学用语是学习和研究化学的基础。下列化学用语表达正确的是A、两个硫酸根离子: B、三个氧原子: C、四个二氧化氮分子: D、五个水分子:5. “珍爱生命,保障安全,守护健康”是人类永恒的主题。下列做法正确的是A、为延长食品的保质期,生产中添加过量的防腐剂 B、为避免浪费,发霉的大米经高温煮熟后再食用 C、发现厨房内天然气泄漏,立即打开抽油烟机排气 D、发生轻度煤气中毒,立即将患者转移到通风的地方6. 阅读以下材料,完成下面小题。
3. “化学史给人以智慧”,下列化学史不符合事实的是A、门捷列夫编制出元素周期表 B、侯德榜最早发现并使用石蕊 C、张青莲主持测定铟元素的相对原子质量新值 D、徐光宪提出稀土分离技术4. 化学用语是学习和研究化学的基础。下列化学用语表达正确的是A、两个硫酸根离子: B、三个氧原子: C、四个二氧化氮分子: D、五个水分子:5. “珍爱生命,保障安全,守护健康”是人类永恒的主题。下列做法正确的是A、为延长食品的保质期,生产中添加过量的防腐剂 B、为避免浪费,发霉的大米经高温煮熟后再食用 C、发现厨房内天然气泄漏,立即打开抽油烟机排气 D、发生轻度煤气中毒,立即将患者转移到通风的地方6. 阅读以下材料,完成下面小题。我国神舟十八号航天员吃到了自己在“太空菜园”种的太空蔬菜,无土栽培技术是太空种菜的主要方式。
(1)、无土栽培需要将浓的营养液稀释数倍后再施用,稀释操作过程中不需要用到的仪器是A、烧杯 B、量筒 C、酒精灯 D、玻璃棒(2)、下列关于营养液中硝酸铵(NH4NO3)的说法正确的是A、可以促进蔬菜茎叶生长 B、可以增强蔬菜的抗寒抗旱能力 C、可以增强蔬菜的抗病虫害能力 D、属于复合肥(3)、下列关于太空蔬菜的说法正确的是A、太空蔬菜可以为航天员补充维生素 B、太空蔬菜生长只需营养液 C、太空蔬菜有辐射,不能食用 D、太空蔬菜光合作用属于物理变化7. 下列关于实验室制取CO2的操作、试剂和装置选择不合理的是

A.选择试剂
B.取用固体试剂

C.检查装置的气密性
D.取用液体试剂
A、A B、B C、C D、D8. 我国科研工作者开发出一种全新的高活性产氢催化剂“铂——氮化钼”。钼在元素周期表中的信息如图所示,下列说法不正确的是 A、钼的原子序数为42 B、钼的相对原子质量为95.95 C、MoN中钼的化合价为-3 D、钼原子核内质子数为429. 《神农本草经》中记载荷叶有清暑化湿的功效。荷叶中含有荷叶碱 , 下列关于荷叶碱的说法正确的是A、氢元素的质量分数最小 B、含有43个原子 C、碳、氧原子的个数比为19:1 D、由四种元素组成10. 热爱劳动是中华民族的传统美德。下列劳动项目与所述化学知识没有直接关联的是
A、钼的原子序数为42 B、钼的相对原子质量为95.95 C、MoN中钼的化合价为-3 D、钼原子核内质子数为429. 《神农本草经》中记载荷叶有清暑化湿的功效。荷叶中含有荷叶碱 , 下列关于荷叶碱的说法正确的是A、氢元素的质量分数最小 B、含有43个原子 C、碳、氧原子的个数比为19:1 D、由四种元素组成10. 热爱劳动是中华民族的传统美德。下列劳动项目与所述化学知识没有直接关联的是选项
劳动项目
化学知识
A
帮厨活动:炖汤时用网袋装着汤料
利用了过滤原理
B
学校清洁:用酒精对桌椅进行消毒
酒精可燃烧
C
家务劳动:用白醋清洗壶中的水垢
白醋可与水垢反应
D
学农活动:在酸性土壤中撒熟石灰
酸碱中和
A、A B、B C、C D、D11. 我国芯片蚀刻技术国际领先。利用NF3蚀刻硅芯片时的产物均为气体,在蚀刻物表面不留任何残留物,该反应的微观示意图如图所示,下列说法正确的是 A、丁为N2 , 空气中丁的质量分数约为78% B、丙分子中的Si、F原子质量比为1:4 C、参加反应的甲和乙的微观粒子个数比为1:1 D、反应前后原子种类不变12. NaCl和Na2CO3的溶解度曲线如图所示。下列有关说法错误的是
A、丁为N2 , 空气中丁的质量分数约为78% B、丙分子中的Si、F原子质量比为1:4 C、参加反应的甲和乙的微观粒子个数比为1:1 D、反应前后原子种类不变12. NaCl和Na2CO3的溶解度曲线如图所示。下列有关说法错误的是 A、t3℃时,甲的饱和溶液含溶质48g B、将甲和乙的饱和溶液从t2℃升温至t3℃,溶质的质量分数不变 C、根据“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”可知,曲线甲是Na2CO3的溶解度曲线 D、t1℃时,NaCl的溶解度比Na2CO3的大13. 根据下列实验方案进行实验,能达到相应实验目的的是
A、t3℃时,甲的饱和溶液含溶质48g B、将甲和乙的饱和溶液从t2℃升温至t3℃,溶质的质量分数不变 C、根据“夏天晒盐(NaCl),冬天捞碱(Na2CO3)”可知,曲线甲是Na2CO3的溶解度曲线 D、t1℃时,NaCl的溶解度比Na2CO3的大13. 根据下列实验方案进行实验,能达到相应实验目的的是

A.测定甲管中生成气体的体积
B.比较Zn和Fe的金属活动性强弱


C.稀释浓硫酸
D.比较红磷和白磷的着火点
A、A B、B C、C D、D二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
-
14. 《天工开物》有关炼铁的记载:凡铁一炉载土二千余斤,或用硬木柴,或用煤炭,或用木炭,南北各从利便。扇炉风箱必用四人、六人带拽。土化成铁之后,从炉腰孔流出。炼铁的简易流程如图所示。
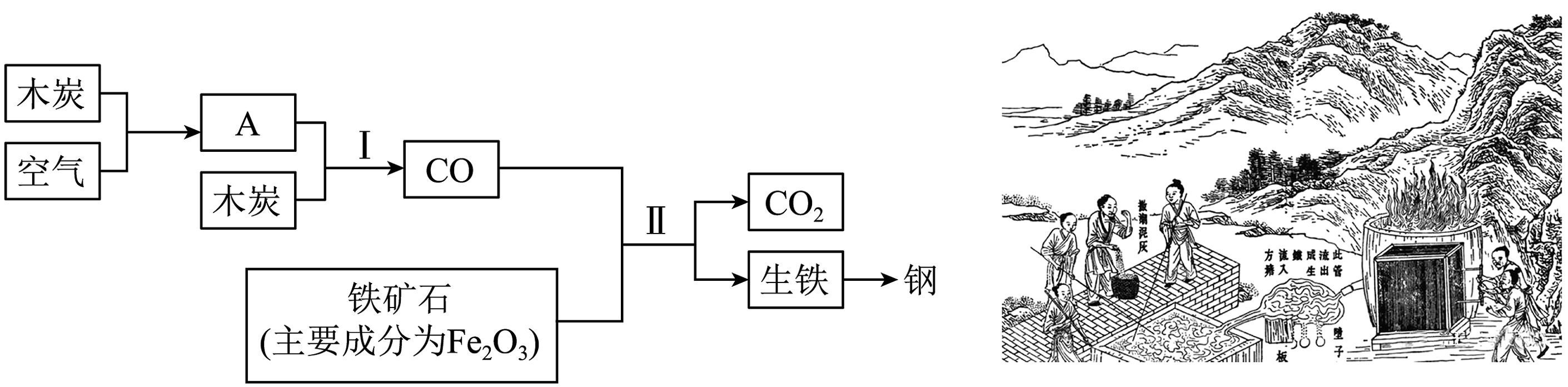 (1)、上述炼铁流程中用到的原料有:铁矿石、木炭、。(2)、物质A的化学式为 , 反应Ⅰ属于(填基本反应类型)。(3)、写出反应Ⅱ的化学方程式:。(4)、生铁和钢在组成上最主要的区别是 , 写出一种防止铁制品锈蚀的方法:。
(1)、上述炼铁流程中用到的原料有:铁矿石、木炭、。(2)、物质A的化学式为 , 反应Ⅰ属于(填基本反应类型)。(3)、写出反应Ⅱ的化学方程式:。(4)、生铁和钢在组成上最主要的区别是 , 写出一种防止铁制品锈蚀的方法:。三、【科普阅读】
-
15. 苯甲酸钠(C6H5COONa)又叫作安息香酸钠,常温下是白色颗粒或晶体粉末,味道微甜,在空气中能稳定存在,可溶于水和多种有机溶剂,是一种应用广泛、低毒性的防腐保鲜剂,在国家规定的用量范围内允许使用,市场需求量大。例如:酱油中一般会加入苯甲酸钠,否则很容易滋生微生物。除此之外,苯甲酸钠还应用于多种食品中,如食醋(某品牌食醋的配料表见下表)、饮料等。苯甲酸钠的杀菌抑菌作用依赖于食品的pH值,其杀菌抑菌作用随酸度的增大而增强,在碱性条件下则失效,苯甲酸钠作为防腐剂的最适宜的pH范围为2.5~4.0。苯甲酸钠与酸反应会析出苯甲酸(C6H5COOH),苯甲酸与碳酸盐反应会有气泡生成。
品名:××香醋
配料:水、糯米、麸皮、大米、大曲(小麦、大麦、豌豆)、白砂糖、食用盐、苯甲酸钠
……
总酸:≥4.50g/100mL
保质期:24个月
储存方法:阴凉、干燥、通风
依据上文,回答问题。
(1)、苯甲酸钠也称作。(2)、苯甲酸中氧元素的质量分数为(计算结果保留一位小数)。苯甲酸与碳酸钠反应会生成苯甲酸钠,该反应的化学方程式为。(3)、苯甲酸钠抗菌、防腐的最适宜的pH范围为 , 此时溶液呈(填“酸”“碱”或“中”)性。(4)、配料表中含有各类营养物质,其中含糖类的有麸皮、大米、大曲、白砂糖、。四、【基础实验与跨学科实践】
-
16. 化学是一门以实验为基础的科学,请回答下列实验的有关问题。
 (1)、实验室常用实验Ⅰ中的装置制取氧气,该反应的化学方程式为。(2)、用制得的氧气做实验Ⅱ时,需在集气瓶内放少量水,其作用是。(3)、做实验Ⅲ时,若测量结果偏小,则原因可能是(答一点)。(4)、做实验Ⅳ时,根据试管(填字母)中的现象,可得出铁生锈的条件之一是与氧气接触;比较试管AC中的现象,可得出铁生锈的另一条件是与接触。(5)、海洋资源的综合利用。
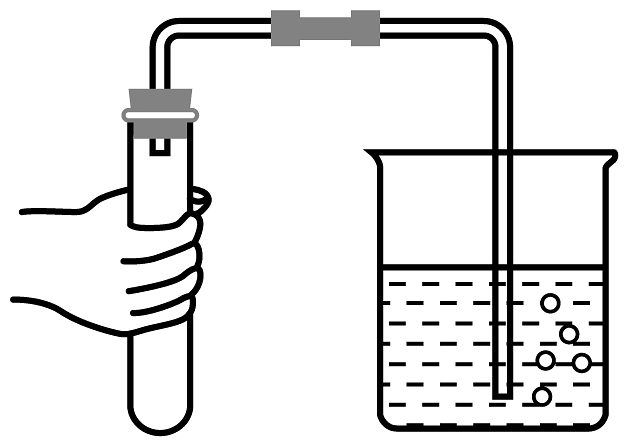
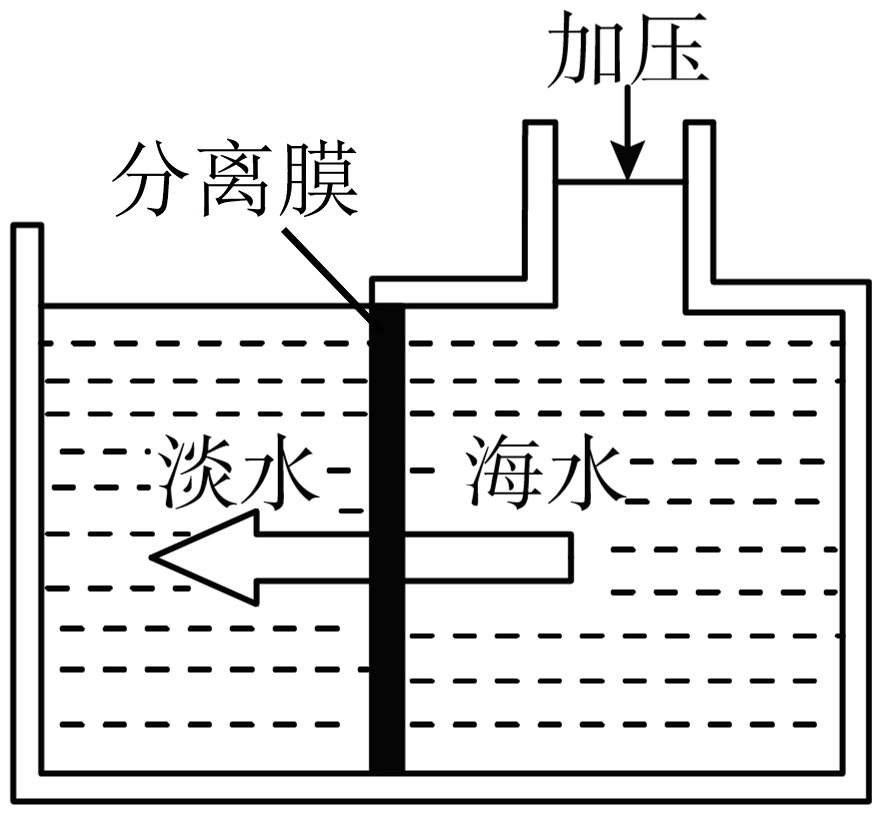
(1)、实验室常用实验Ⅰ中的装置制取氧气,该反应的化学方程式为。(2)、用制得的氧气做实验Ⅱ时,需在集气瓶内放少量水,其作用是。(3)、做实验Ⅲ时,若测量结果偏小,则原因可能是(答一点)。(4)、做实验Ⅳ时,根据试管(填字母)中的现象,可得出铁生锈的条件之一是与氧气接触;比较试管AC中的现象,可得出铁生锈的另一条件是与接触。(5)、海洋资源的综合利用。i.制淡水。膜分离技术能使海水淡化:分离膜能使水分子通过,而海水中各种离子不能通过。下图中,给右侧海水加压的目的是。
ii.制盐。由粗盐到精盐需要经过的步骤之一是过滤(如下图所示)。

a.使用的实验用品(试剂除外)有:铁架台(带铁圈)、漏斗、烧杯、玻璃棒、。
b.如果实验中发现滤液仍浑浊,那么还需进行的操作是。
iii.封存CO2.将捕集到的CO2封存于海底深处,可有效缓解问题。
17.兴趣小组收集了某盐碱地表面的白色晶体,并对其进行成分分析。
【查阅资料】
盐地主要含NaCl和Na2SO4 , 碱地主要含Na2CO3;BaCO3为白色固体,难溶于水;BaSO4为白色固体,难溶于水和稀盐酸;AgCl为白色固体,难溶于水和稀硝酸;Ag2SO4为白色固体,微溶于水。
【方案研讨】
(1)填写下列表格。方案
方案设计
预期现象与结论及评价交流
1
取样,滴加稀盐酸,观察是否产生气泡
若有气泡产生,则含有
2
取样,溶解,滴加适量BaCl2溶液,观察是否产生沉淀
若产生沉淀,则含有Na2SO4.老师指出该方案不严谨,原因是
3
取样,溶解,滴加过量BaCl2溶液,过滤,取少量滤液,滴加AgNO3溶液,观察是否产生沉淀
若产生沉淀,则含有NaCl。NaCl反应后生成AgCl沉淀的化学方程式为 , 有同学提出该方案也不严谨,原因是
【方案优化】
(2)有同学针对方案2提出:过滤反应后的液体,然后向滤渣中加入少量稀盐酸,若滤渣部分溶解,则证明样品中含有Na2SO4.老师指出该方案还是不严谨,理由是。你的改进建议是。(3)将方案3中的BaCl2溶液换成(填字母)。A.CaCl2溶液 B.Ba(NO3)2溶液 C.稀硫酸
【实验及结果】实施最终优化的方案,结果表明该白色晶体中含有NaCl、Na2CO3、Na2SO4。
18. 以钛石膏为主要原料制备碳酸钙粉体和硫酸铵,为钛石膏的综合利用提供了一条新途径,生产工艺流程简图如图所示。钛石膏浆液的主要成分为CaSO4、氨水(NH3·H2O)。 (1)、操作Ⅰ的名称是。(2)、在钛石膏浆液中加入碳酸氢铵,主要发生了下面两个反应,请补充完整化学方程式并回答问题:
(1)、操作Ⅰ的名称是。(2)、在钛石膏浆液中加入碳酸氢铵,主要发生了下面两个反应,请补充完整化学方程式并回答问题:a.
b. , 此反应属于(填基本反应类型)。
(3)、根据流程图可判断硫酸铵的溶解度随温度的升高而(填“增大”或“减小”),请写出硫酸铵的一种用途:。(4)、根据实验可得碳酸钙和硫酸铵的产率随反应温度、反应时间的变化如图所示,则制备碳酸钙和硫酸铵的最佳条件是。 19. 铜被广泛应用于电子、通讯和新能源等行业。往酸性废液[主要含Fe2(SO4)3、FeSO4和CuSO4]中加入铁粉可以实现铜的再生利用。(1)、将铁粉加入酸性废液中,为了反应能充分进行,可进行操作。(2)、某种酸性废液中铜含量为0.56g/L,现处理1000L该种酸性废液,理论上至少需要g铁粉用于置换酸性废液中的铜(写出计算过程)。(3)、用铁回收酸性废液中铜的过程可能发生的反应如下:
19. 铜被广泛应用于电子、通讯和新能源等行业。往酸性废液[主要含Fe2(SO4)3、FeSO4和CuSO4]中加入铁粉可以实现铜的再生利用。(1)、将铁粉加入酸性废液中,为了反应能充分进行,可进行操作。(2)、某种酸性废液中铜含量为0.56g/L,现处理1000L该种酸性废液,理论上至少需要g铁粉用于置换酸性废液中的铜(写出计算过程)。(3)、用铁回收酸性废液中铜的过程可能发生的反应如下:i̇.Fe+CuSO4=Cu+FeSO4
ii.Fe+Fe2(SO4)3=3FeSO4
iii.Fe+H2SO4=FeSO4+H2↑
iv.Cu+Fe2(SO4)3=2FeSO4+CuSO4
下列有关说法正确的是_______(多选,填字母)。
A、从发生的反应可知铁粉的消耗量较大 B、Fe2(SO4)3的存在可能会影响到铜的回收 C、酸性废液中的酸会消耗铁粉,可以加入过量NaOH中和 D、产生的大量FeSO4可回收利用
-
-