广东省深圳市红岭中学2025年6月九年级物理化学模拟试卷-初中化学
试卷更新日期:2025-06-14 类型:中考模拟
一、选择题(共15分,每题1.5分。在每小题给出的四个选项中,只有一项符合题目要求。)
-
1. 智能机器人在生活中发挥着重要作用,以下应用过程中涉及化学变化的是A、导览讲解
 B、送餐服务
B、送餐服务 C、消防灭火
C、消防灭火 D、清扫灰尘
D、清扫灰尘 2. 推动绿色发展,促进人与自然和谐共生,下列做法与该理念不相符的是A、分类回收生活垃圾 B、推广使用煤炭燃料 C、工业废水处理后排放 D、使用新型可降解塑料
2. 推动绿色发展,促进人与自然和谐共生,下列做法与该理念不相符的是A、分类回收生活垃圾 B、推广使用煤炭燃料 C、工业废水处理后排放 D、使用新型可降解塑料二、中国科学家对近现代化学发展贡献卓著:徐寿规范化学用语奠定学科基础;张青莲测定相对原子质量制定国际标准;侯德榜创立“侯氏制碱法”打破技术垄断;屠呦呦革新抗疟药物挽救宝贵生命;闵恩泽研发石油催化剂实现能源自主。请完成下列小题。
-
3. 中国近代化学先驱徐寿翻译西方化学著作、规范化学用语,下列书写正确的是A、NaCO3:碳酸钠 B、N2:2个氮原子 C、二氧化硫中硫元素的化合价: D、3H:3个氢元素4. 张青莲院士精确测定了铟、锌等9种化学元素的相对原子质量。下图1为元素周期表中铟元素的信息,图2为实验室制取氢气的装置。下列说法正确的是
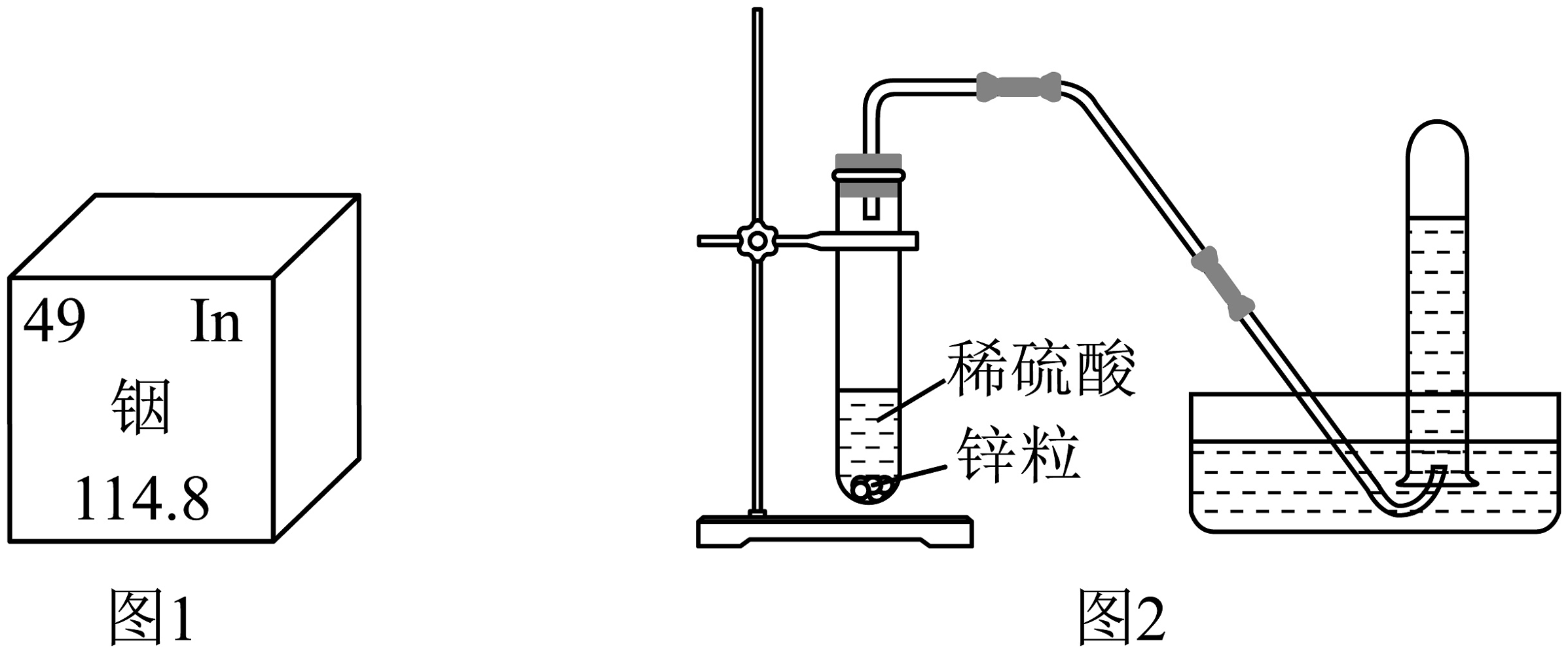 A、铟元素是金属元素 B、铟的相对原子质量为114.8g C、铟原子的中子数为49 D、用排水法收集氢气,点燃前不用验纯5. 侯德榜发明联合制碱法,打破了国外对制碱技术的封锁。二氧化碳和氨气是两种重要的制碱原料。下列关于这两种气体相关实验的说法正确的是
A、铟元素是金属元素 B、铟的相对原子质量为114.8g C、铟原子的中子数为49 D、用排水法收集氢气,点燃前不用验纯5. 侯德榜发明联合制碱法,打破了国外对制碱技术的封锁。二氧化碳和氨气是两种重要的制碱原料。下列关于这两种气体相关实验的说法正确的是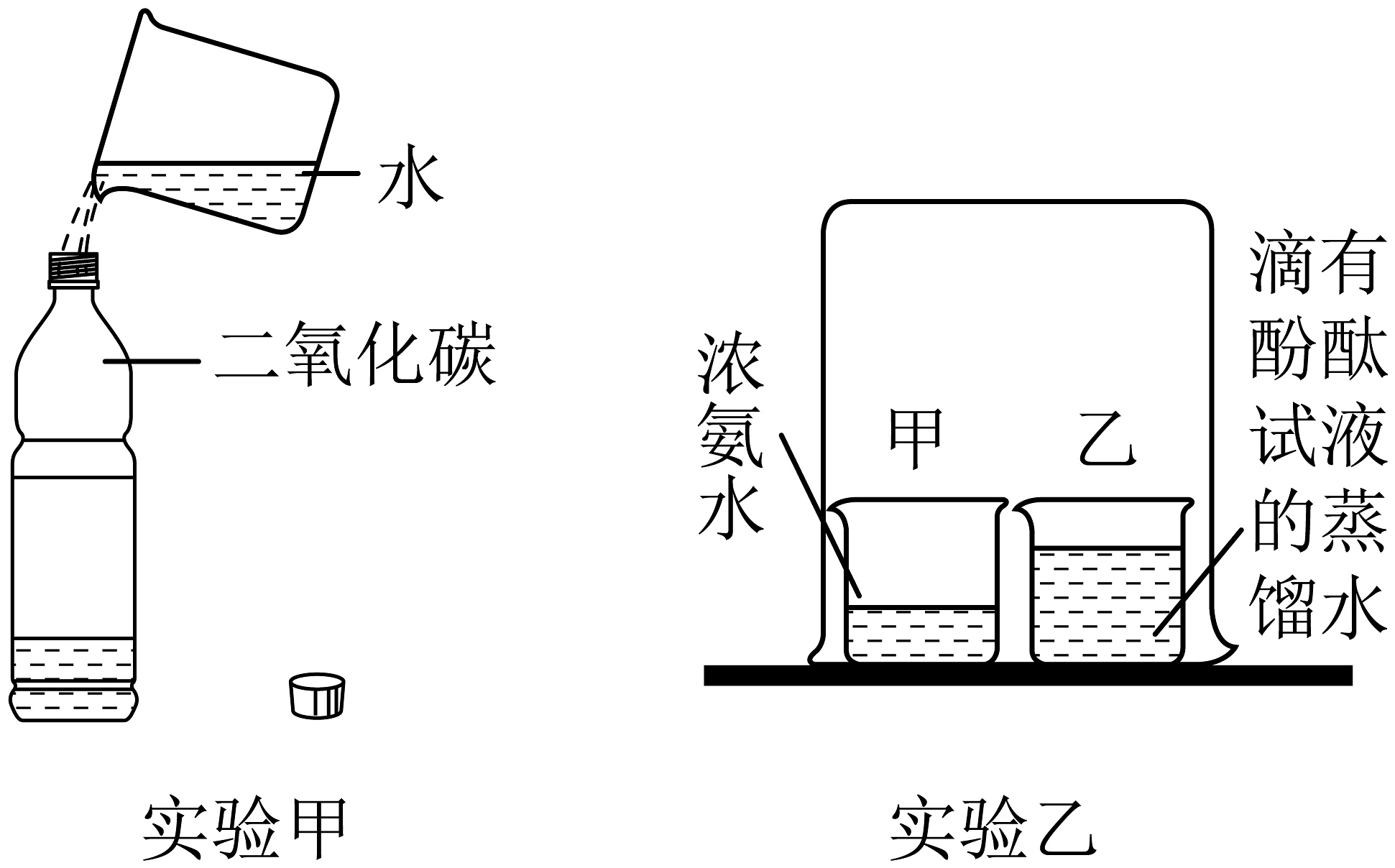 A、实验甲中只发生了物理变化 B、实验甲证明二氧化碳能溶于水 C、实验乙中可以观察到烧杯甲变为红色 D、实验乙中酚酞分子没有运动6. 屠呦呦团队从青蒿中提取青蒿素(C15H22O5),挽救了上亿人的生命。下列有关青蒿素的说法正确的是A、属于氧化物 B、碳、氢元素质量比为15:22 C、含有42个原子 D、青蒿素中氢元素质量分数最小7. 闵恩泽推动中国石油化工技术自主创新,被誉为“中国催化剂之父”。某催化剂使甲烷(CH4)和水在常温下产生H2的微观示意图如下,下列说法正确的是
A、实验甲中只发生了物理变化 B、实验甲证明二氧化碳能溶于水 C、实验乙中可以观察到烧杯甲变为红色 D、实验乙中酚酞分子没有运动6. 屠呦呦团队从青蒿中提取青蒿素(C15H22O5),挽救了上亿人的生命。下列有关青蒿素的说法正确的是A、属于氧化物 B、碳、氢元素质量比为15:22 C、含有42个原子 D、青蒿素中氢元素质量分数最小7. 闵恩泽推动中国石油化工技术自主创新,被誉为“中国催化剂之父”。某催化剂使甲烷(CH4)和水在常温下产生H2的微观示意图如下,下列说法正确的是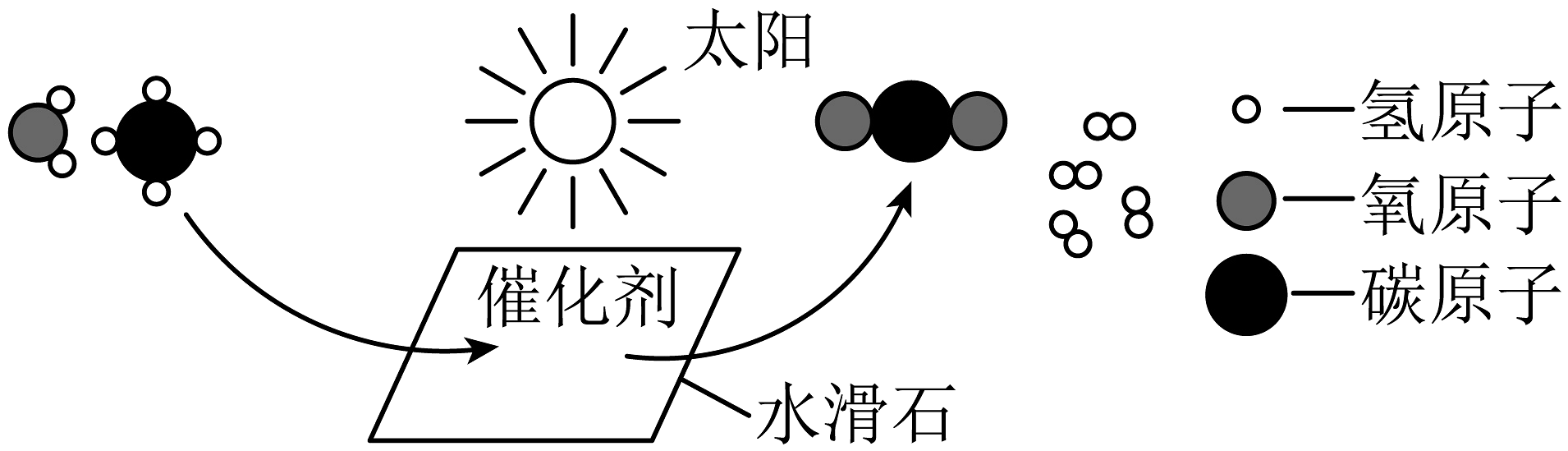 A、该反应生成的两种分子的个数比为1:4 B、反应前后元素的化合价均不变 C、反应后氢原子的个数减少 D、反应前后催化剂的性质不变8. 鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是
A、该反应生成的两种分子的个数比为1:4 B、反应前后元素的化合价均不变 C、反应后氢原子的个数减少 D、反应前后催化剂的性质不变8. 鉴别、除杂是重要的实验技能。下列实验设计能达到实验目的的是选项
实验目的
实验设计
A
鉴别MnO2和Fe3O4
观察颜色
B
除去CO气体中混有的CO2
依次通过足量的氢氧化钠溶液和浓硫酸
C
鉴别N2和CO2
分别向集气瓶中伸入燃着的木条
D
除去FeCl2溶液中混有的少量稀盐酸
加入适量的氧化铁粉末,充分反应后过滤
A、A B、B C、C D、D三、《齐民要术》记载,古代酿醋匠人通过调节溶液酸碱度提升食醋品质:先以谷物发酵生成醋酸(CH3COOH),再加入小苏打(NaHCO3)反应捭过量酸性物质。请完成下列小题。
-
9. 下图为工业制取小苏打时涉及三种溶质的溶解度曲线。有关说法正确的是
 A、NH4Cl的溶解度比NaCl的溶解度大 B、60℃时,在100g水中加入55.2gNaCl,形成155.2g溶液 C、t℃时,NH4Cl和NaCl溶液的溶质质量分数相等 D、从NaCl和NaHCO3混合溶液中得到NaHCO3固体,可用降温结晶10. 小苏打能与盐酸反应(NaHCO3+HCl=NaCl+H2O+CO2↑)用于治疗胃酸过多,是常见的止酸剂。为探究不同止酸剂的药效,分别在三颈烧瓶和气球中装入等量稀盐酸和止酸剂,实验时将止酸剂倒入瓶中,测定压强和pH的变化。有关说法错误的是
A、NH4Cl的溶解度比NaCl的溶解度大 B、60℃时,在100g水中加入55.2gNaCl,形成155.2g溶液 C、t℃时,NH4Cl和NaCl溶液的溶质质量分数相等 D、从NaCl和NaHCO3混合溶液中得到NaHCO3固体,可用降温结晶10. 小苏打能与盐酸反应(NaHCO3+HCl=NaCl+H2O+CO2↑)用于治疗胃酸过多,是常见的止酸剂。为探究不同止酸剂的药效,分别在三颈烧瓶和气球中装入等量稀盐酸和止酸剂,实验时将止酸剂倒入瓶中,测定压强和pH的变化。有关说法错误的是 A、气球的作用是缓冲气压 B、曲线①对应的物质是氧化镁 C、服用碳酸氢钠有可能会造成胃胀气 D、氢氧化铝和稀盐酸的反应最慢
A、气球的作用是缓冲气压 B、曲线①对应的物质是氧化镁 C、服用碳酸氢钠有可能会造成胃胀气 D、氢氧化铝和稀盐酸的反应最慢四、【科普阅读】
-
11. 化石燃料的燃烧、森林砍伐和工业发展等造成CO2过度排放已成为全球性问题。将CO2转化为高附加值燃料或化学品已被认为是缓解能源短缺和温室效应等问题最有前景的方法。
上海科研团队成功开发出一种用锌修饰的氮化家(Zn-GaN)纳米线催化剂,实现了人工光合作用下CO2高效转化为甲烷,原理与反应部分路径图如图1,助力实现碳中和。团队通过大量实验证明,产生甲烷速率的影响因素如图2。

依据上文,回答问题:
(1)、化石燃料属于(填“再生”或“不可再生”)能源。(2)、造成CO2过度排放的原因。(3)、CO2经人工光合作用生成的燃料属于(填“有机”或“无机”)物。(4)、图1发生的化学反应中涉及的氧化物有种。(5)、由图2推测,光照越强,催化作用越(填“强”或“弱”),提高甲烷产生速率的方法有(写一条)。(6)、实现上述转化的意义是(写一条)。12.化学药品的合理存放是实验顺利进行的前提。学校兴趣小组发现实验台上摆放的药品中,有一瓶溶液的试剂瓶塞未盖且标签破损,其残缺的标签中只剩下“Na”和“10%”字样(如图)。已知它是无色液体,是初中化学常用的试剂。于是对这瓶溶液进行探究:
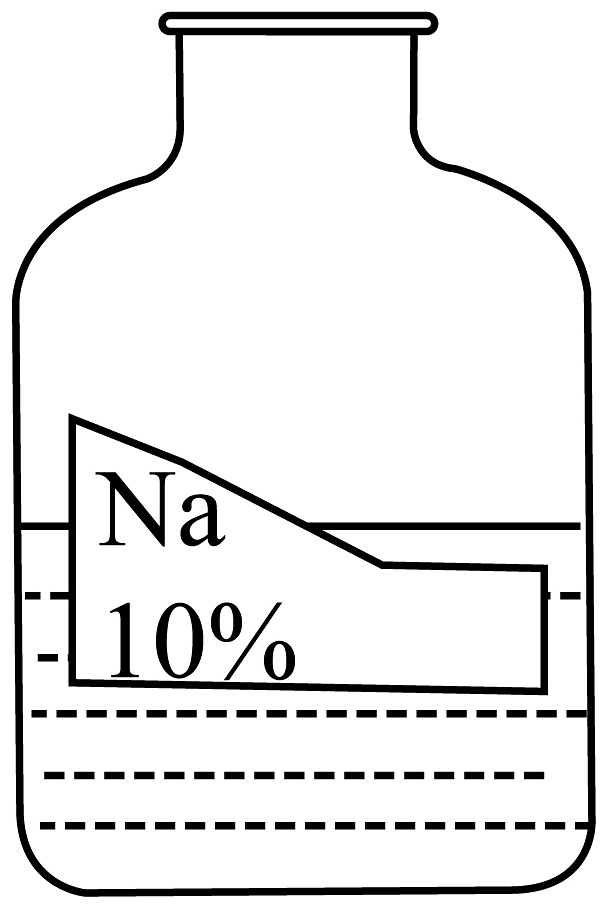
【提出问题】该溶液的溶质是什么?
【查阅资料】Ⅰ.常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3.
Ⅰ.室温(20℃)时,四种物质的溶解度的数据如表。
物质
NaCl
NaOH
Na2CO3
NaHCO3
溶解度/g
36
109
215
9.6
【初步分析】
(1)甲同学根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是NaHCO3溶液,理由是。
【进行实验】
(2)同学们设计实验方案,并完成如下实验:
实验报告
实验目的
确定该溶液的溶质
实验用品
试管,烧杯,胶头滴管,稀盐酸,稀硫酸,氢氧化钡溶液
实验步骤
实验现象
实验结论
乙同学:取一小片pH试纸放在白瓷板上,用玻璃棒蘸取待测液点到pH试纸上,将试纸显示的颜色与标准比色卡比较。
pH>7
该溶液不是溶液(填名称)
丙同学:取少量待测液于一支洁净的试管中,用胶头滴管向其中加入1-2毫升稀盐酸,观察实验现象。
有气体生成,实验中发生的化学反应方程式:。
该溶液是Na2CO3溶液
丁同学:。
有白色沉淀生成
【拓展实验】如下图1,向氢氧化钠溶液中不断通入HCl气体,用传感器测定溶液导电能力的变化,结果如下图2(溶液体积、温度变化可忽略,离子浓度越大,导电能力越强)。
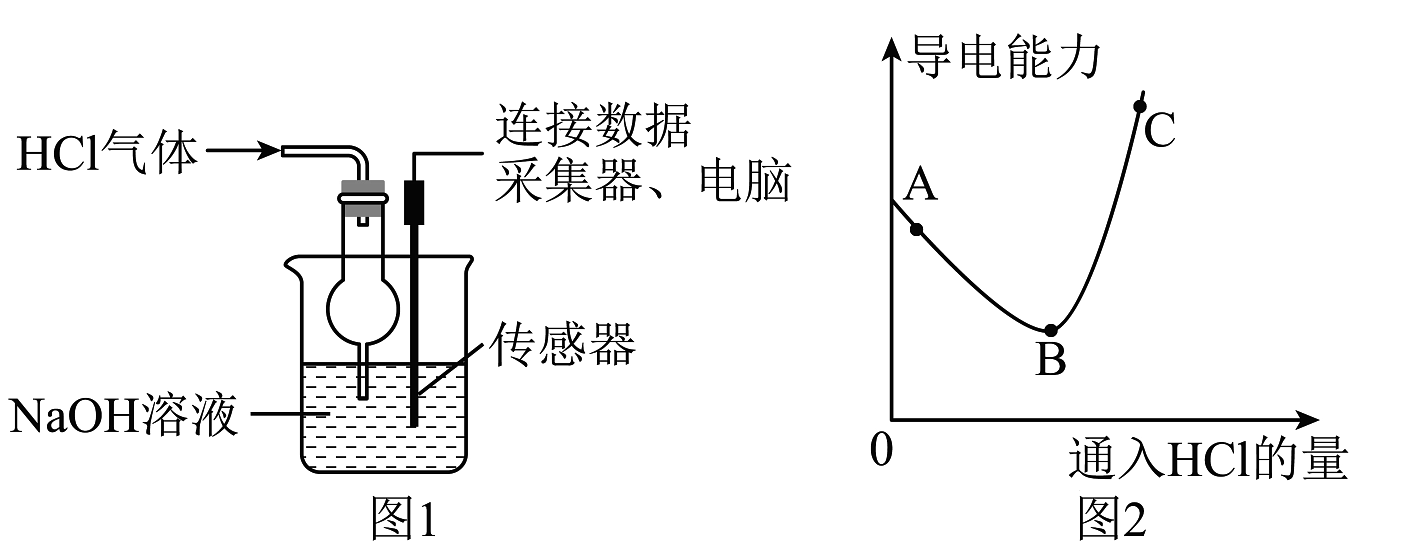
(3)写出图1中发生反应的化学方程式为。
(4)已知溶液的导电能力还和离子种类有关。分析图2可知,当其他条件相同时,导电能力:OH-Cl-(填“>”“<”或“=”)。
13.我国每年约有4亿部手机被淘汰,其中的零部件中含黄金约4吨,以下是从中提取金的两种方案。
方案一:乳清蛋白海绵吸附法(图1)
 (1)“酸浸”前需粉碎零部件的目的是。(2)乳清蛋白海绵类似活性炭,具有的结构能吸附金离子,该过程属于变化(填“物理”或“化学”)。(3)Au+在高温下“解吸”,通过(填“得”或“失”)电子变成Au粉。
(1)“酸浸”前需粉碎零部件的目的是。(2)乳清蛋白海绵类似活性炭,具有的结构能吸附金离子,该过程属于变化(填“物理”或“化学”)。(3)Au+在高温下“解吸”,通过(填“得”或“失”)电子变成Au粉。方案二:硫脲浸取法(部分工艺如图2)
 (4)“过程Ⅱ”发生的化学方程式;(5)“过程Ⅰ”浸取的影响因素如图3,浸取的最佳条件为。
(4)“过程Ⅱ”发生的化学方程式;(5)“过程Ⅰ”浸取的影响因素如图3,浸取的最佳条件为。 (6)回收淘汰手机中黄金的重要意义(写一条)。14.
(6)回收淘汰手机中黄金的重要意义(写一条)。14.空气中含有大量的氮气,用途广泛。
Ⅰ.N2的获取
工业获取N2的一种原理示意图如图。
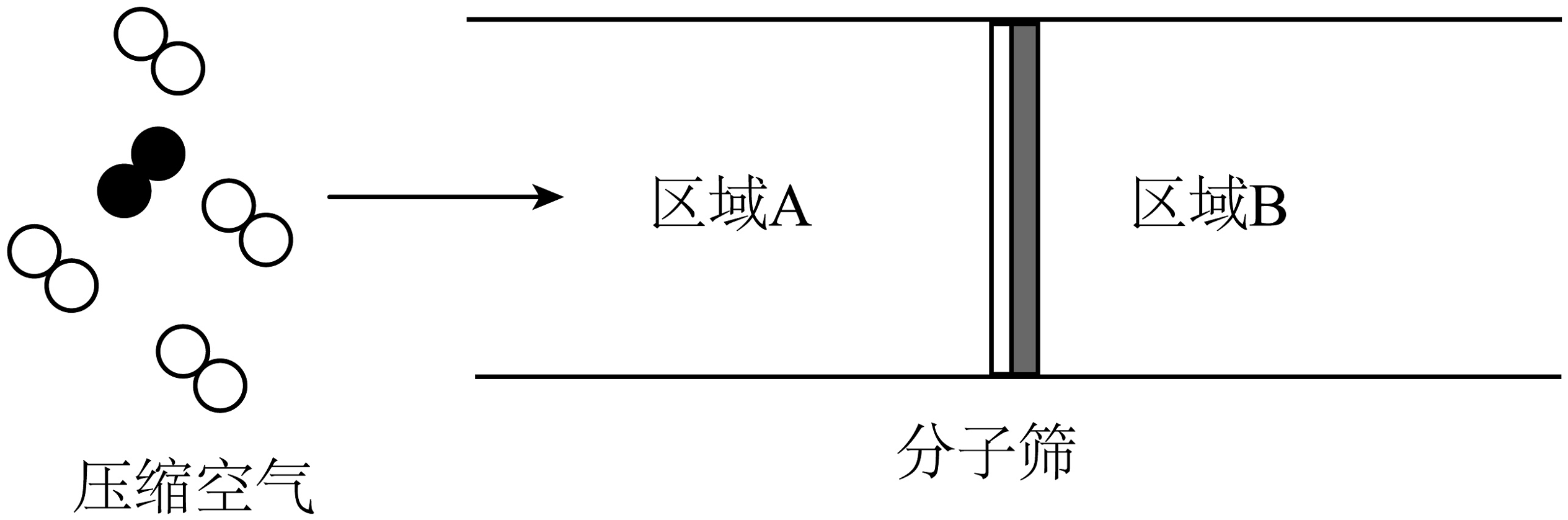
(1)分子的直径:N2>O2 , 压缩后获取氮气,应选择区域________(填“A”或“B”)的气体。
Ⅱ.N2转化为尿素[CO(NH2)2]
工业合成氨及尿素的流程示意图如图。
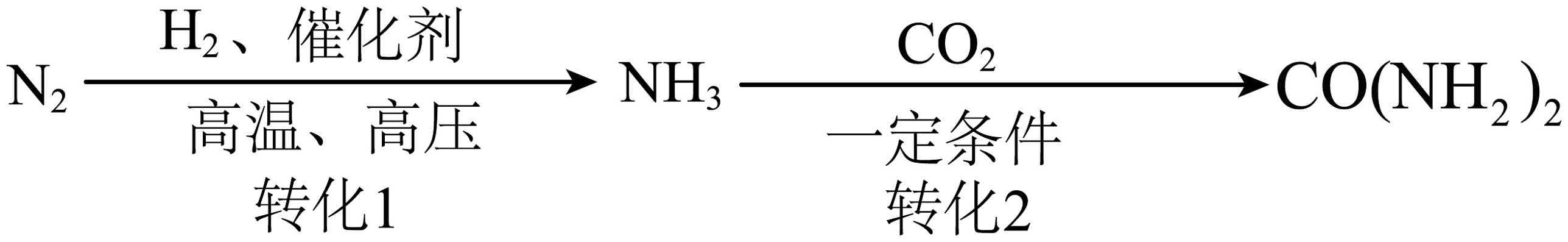
(2)转化1发生的反应所属的基本反应类型为________,转化时需隔绝空气进行,目的是________。
Ⅲ.N2转化为金属氮化物
用高温氮气吹氧化铝粉和碳粉混合物,制得新型半导体材料氮化铝(AlN)装置示意图如图。
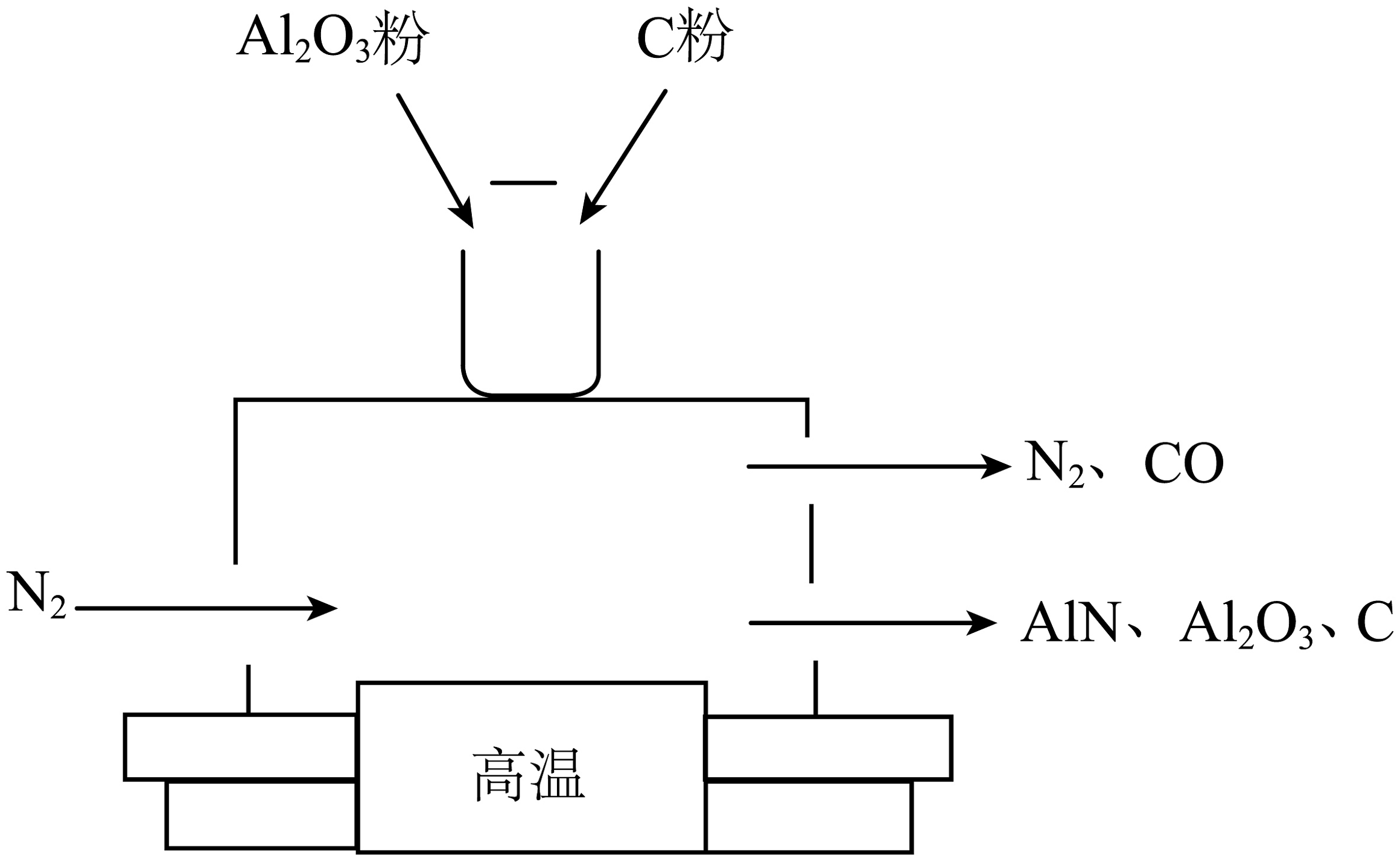
(3)氮化铝和Al2O3中铝元素化合价相同,则氮化铝中氮元素的化合价为________。
(4)氮化铝能与盐酸反应:AlN+3HCl=AlCl3+NH3↑,计算生成1.7g氨气(NH3)需要氮化铝的质量。(写出计算过程)