物质的溶解和溶液-2025年中考科学考前20天冲刺专题
试卷更新日期:2025-06-05 类型:三轮冲刺
一、选择题
-
1. 图中圆A表示浓溶液, 圆B表示饱和溶液。20℃时,下列物质溶于水形成的饱和溶液,属于图中阴影部分的是
 A、氢氧化钙 B、硝酸钾 C、氯化钠 D、氢氧化钠2. 某兴趣小组按如图操作配制一定溶质质量分数的氯化钠溶液。下列说法正确的是( )
A、氢氧化钙 B、硝酸钾 C、氯化钠 D、氢氧化钠2. 某兴趣小组按如图操作配制一定溶质质量分数的氯化钠溶液。下列说法正确的是( ) A、③中玻璃棒的作用是使溶液更加均匀 B、⑥读数时视线与凹液面最低点保持水平 C、①~⑥项实验操作均正确 D、实验操作顺序为④②①⑤⑥③3. 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。下列有关所得溶液的说法,错误的是( )A、该溶液是饱和溶液 B、溶液中 Na+和Cl-个数一定相等 C、溶液的质量为100克 D、溶质与溶剂的质量比为9:254. 某化学兴趣小组的同学进行蔗糖的溶解实验,过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A、③中玻璃棒的作用是使溶液更加均匀 B、⑥读数时视线与凹液面最低点保持水平 C、①~⑥项实验操作均正确 D、实验操作顺序为④②①⑤⑥③3. 20℃时,把36克氯化钠放入64克水中,使其充分溶解(20℃时氯化钠的溶解度为36克)。下列有关所得溶液的说法,错误的是( )A、该溶液是饱和溶液 B、溶液中 Na+和Cl-个数一定相等 C、溶液的质量为100克 D、溶质与溶剂的质量比为9:254. 某化学兴趣小组的同学进行蔗糖的溶解实验,过程如图所示,不考虑水分蒸发,下列判断正确的是( ) A、②与③中溶液一定是饱和溶液 B、②与③中蔗糖溶解度相同 C、②与③溶液的溶质质量不同 D、②与③溶液中的溶质质量分数相同5. 稳定与变化是跨学科概念,它表示自然界中的一切事物具有相对稳定性,但又时刻变化着。下列叙述不正确的是 ( )A、给静止的杠杆一个新的作用力,杠杆可能保持静止 B、人体不断地产热与散热,使体温始终维持在一定的范围 C、燃料的燃烧不断消耗氧气,大气中氧气的含量却保持稳定 D、降低饱和硝酸钾溶液的温度,溶液的溶质质量分数保持不变6. 室温下,将生石灰固体加入盛有水的烧杯中,搅拌后静置一段时间,实验过程和现象如图所示。下列分析判断不符合事实的是( )
A、②与③中溶液一定是饱和溶液 B、②与③中蔗糖溶解度相同 C、②与③溶液的溶质质量不同 D、②与③溶液中的溶质质量分数相同5. 稳定与变化是跨学科概念,它表示自然界中的一切事物具有相对稳定性,但又时刻变化着。下列叙述不正确的是 ( )A、给静止的杠杆一个新的作用力,杠杆可能保持静止 B、人体不断地产热与散热,使体温始终维持在一定的范围 C、燃料的燃烧不断消耗氧气,大气中氧气的含量却保持稳定 D、降低饱和硝酸钾溶液的温度,溶液的溶质质量分数保持不变6. 室温下,将生石灰固体加入盛有水的烧杯中,搅拌后静置一段时间,实验过程和现象如图所示。下列分析判断不符合事实的是( ) A、①中生石灰和水发生了化合反应 B、②中烧杯内物质温度高于室温 C、③中澄清溶液是氢氧化钙的饱和溶液 D、④中白色膜状物是氢氧化钙7. 用恒温蒸发氯化钠溶液来模拟海水晒盐的过程(如图),下列说法正确的是( )
A、①中生石灰和水发生了化合反应 B、②中烧杯内物质温度高于室温 C、③中澄清溶液是氢氧化钙的饱和溶液 D、④中白色膜状物是氢氧化钙7. 用恒温蒸发氯化钠溶液来模拟海水晒盐的过程(如图),下列说法正确的是( ) A、①一定是饱和溶液 B、②一定是不饱和溶液 C、②→③,溶质质量分数减小 D、③→④,溶质质量分数不变8. 锡不易与酒中的成分发生反应,能较好保持酒的风味。舟山部分地区常用锡壶盛酒,但酒在存放过程中,酒味还是会逐渐变淡,这是因为()
A、①一定是饱和溶液 B、②一定是不饱和溶液 C、②→③,溶质质量分数减小 D、③→④,溶质质量分数不变8. 锡不易与酒中的成分发生反应,能较好保持酒的风味。舟山部分地区常用锡壶盛酒,但酒在存放过程中,酒味还是会逐渐变淡,这是因为() A、溶质质量减小使溶液浓度变小 B、溶剂质量减小使溶液浓度变小 C、溶剂质量增加使溶液浓度变大 D、溶质质量增加使溶液浓度变大9. 如图为小明自制“棒棒糖”的流程,则下列烧杯内溶液一定为饱和溶液的是( )
A、溶质质量减小使溶液浓度变小 B、溶剂质量减小使溶液浓度变小 C、溶剂质量增加使溶液浓度变大 D、溶质质量增加使溶液浓度变大9. 如图为小明自制“棒棒糖”的流程,则下列烧杯内溶液一定为饱和溶液的是( ) A、甲、丁 B、乙、丙 C、甲、丙 D、乙、丁10. NH4Cl、KNO3是两种盐。已知30℃时,NH4Cl的溶解度为41.4g,KNO3的溶解度为45.8g。取这两种盐各22g,按图示进行实验。下列说法错误的是( )
A、甲、丁 B、乙、丙 C、甲、丙 D、乙、丁10. NH4Cl、KNO3是两种盐。已知30℃时,NH4Cl的溶解度为41.4g,KNO3的溶解度为45.8g。取这两种盐各22g,按图示进行实验。下列说法错误的是( ) A、盐A是NH4Cl B、①中加入5g水,搅拌并恢复至30℃,就可使未溶的盐A全部溶解 C、②中溶液一定是不饱和溶液 D、②中22g溶质全部溶解在50g水中,其溶质质量分数为44%11. 为拓展能量来源,我国推广种植一种“生物柴油”树——麻疯树,其果实内含有果仁油。果仁油常用有机溶剂通过浸取法提取,主要过程如图。下列有关说法错误的是 ( )
A、盐A是NH4Cl B、①中加入5g水,搅拌并恢复至30℃,就可使未溶的盐A全部溶解 C、②中溶液一定是不饱和溶液 D、②中22g溶质全部溶解在50g水中,其溶质质量分数为44%11. 为拓展能量来源,我国推广种植一种“生物柴油”树——麻疯树,其果实内含有果仁油。果仁油常用有机溶剂通过浸取法提取,主要过程如图。下列有关说法错误的是 ( ) A、粉碎果仁能加快果仁油的溶解速度 B、加热溶解时温度升高果仁油溶解度变大 C、过滤利用了果仁油与滤渣的溶解性不同 D、蒸发过程中果仁油的溶质质量分数变小12. 在一定温度下,一定量的饱和溶液中,加入少量的CaO并维持温度不变,则下列说法中正确的是( )A、溶液中质量分数增大 B、溶液中质量分数减小 C、溶液中的总数减少 D、溶液中的总数增加
A、粉碎果仁能加快果仁油的溶解速度 B、加热溶解时温度升高果仁油溶解度变大 C、过滤利用了果仁油与滤渣的溶解性不同 D、蒸发过程中果仁油的溶质质量分数变小12. 在一定温度下,一定量的饱和溶液中,加入少量的CaO并维持温度不变,则下列说法中正确的是( )A、溶液中质量分数增大 B、溶液中质量分数减小 C、溶液中的总数减少 D、溶液中的总数增加二、填空题
-
13. “天气瓶”和“彩球温度计”是两款不同的现代居家饰品,都可以获知天气冷暖变化。
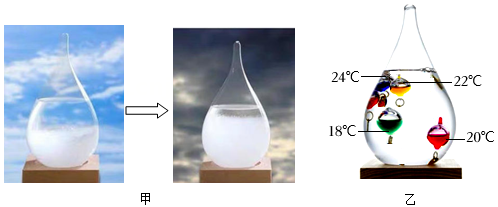 (1)、图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而。(2)、图乙为“彩球温度计”,当温度降低到小球所标注的温度值时该小球会浮起。某时,只有“20℃”、“18℃"的小球沉底,则此时的气温范围为。(3)、图乙中漂浮的“24℃"小球质量为5 克,则其所受浮力为 牛。14. 我国某盐湖属于氯化钠型内陆湖泊,在唐朝初年即通过“人工垦畦,天日浇晒”等工艺进行开发,主要流程如图所示。完成下列问题:
(1)、图甲为“天气瓶”,当外界温度降低时,瓶中晶体增多。由此推测瓶中晶体的溶解度随温度降低而。(2)、图乙为“彩球温度计”,当温度降低到小球所标注的温度值时该小球会浮起。某时,只有“20℃”、“18℃"的小球沉底,则此时的气温范围为。(3)、图乙中漂浮的“24℃"小球质量为5 克,则其所受浮力为 牛。14. 我国某盐湖属于氯化钠型内陆湖泊,在唐朝初年即通过“人工垦畦,天日浇晒”等工艺进行开发,主要流程如图所示。完成下列问题: (1)、从物质组成角度看,盐碱湖水属于; (选填“纯净物”或“混合物”)(2)、“集卤蒸发”中,随着水分不断蒸发,卤水中氯化钠的质量分数会;(3)、“过‘箩’调配”时, “箩”与过滤操作中(填一实验用品)的作用相同。15. 解放战争时期,为红军运送食盐的老百姓将“土盐”全部溶解成盐水,再将浸有盐水的棉袄带到根据地,以此躲过敌人的盘查。
(1)、从物质组成角度看,盐碱湖水属于; (选填“纯净物”或“混合物”)(2)、“集卤蒸发”中,随着水分不断蒸发,卤水中氯化钠的质量分数会;(3)、“过‘箩’调配”时, “箩”与过滤操作中(填一实验用品)的作用相同。15. 解放战争时期,为红军运送食盐的老百姓将“土盐”全部溶解成盐水,再将浸有盐水的棉袄带到根据地,以此躲过敌人的盘查。 (1)、为了将“土盐”快速溶于水中,可采用的方法是(写出一种即可)。(2)、老百姓将棉袄中的液体挤出,再将液体置于铁锅中煎煮得盐,“煎煮”类似于下图中的操作(填字母)。(3)、“土盐”因含有较多的MgCl2而口感苦涩,若要除去“土盐”中的MgCl2 , 可使用适量的试剂。16. 硝酸钾(KNO3)是一种常见的化肥,在农业生产中常需配制成不同浓度的溶液后再使用,其溶解度随温度变化如下表:
(1)、为了将“土盐”快速溶于水中,可采用的方法是(写出一种即可)。(2)、老百姓将棉袄中的液体挤出,再将液体置于铁锅中煎煮得盐,“煎煮”类似于下图中的操作(填字母)。(3)、“土盐”因含有较多的MgCl2而口感苦涩,若要除去“土盐”中的MgCl2 , 可使用适量的试剂。16. 硝酸钾(KNO3)是一种常见的化肥,在农业生产中常需配制成不同浓度的溶液后再使用,其溶解度随温度变化如下表:温度/℃
10
20
30
40
硝酸钾溶解度/g
20.9
31.6
45.8
63.9
(1)、硝酸钾中除钾元素外,元素也对植物的生长至关重要,属于复合肥。(2)、某农户在40℃时将30g硝酸钾加入100g水中,充分搅拌后得到溶液。若将此溶液降温至20℃,得到的是(填“饱和”或“不饱和”)溶液。(3)、上述40℃时所得溶液需稀释为5%的硝酸钾溶液用于育苗,需再加水g。17. 北宋沈括在《梦溪笔谈》中记载了用“苦泉水”(硫酸铜溶液)制取铜的方法,其主要生产流程如图所示。请回答下列问题: (1)、由硫酸铜热饱和溶液制得硫酸铜晶体的结晶方法是(2)、方法一:炼铜原理利用铁的金属活动性(选填“>” “=”或“<”)铜。(3)、方法二:②中反应的化学反应方程式为:
(1)、由硫酸铜热饱和溶液制得硫酸铜晶体的结晶方法是(2)、方法一:炼铜原理利用铁的金属活动性(选填“>” “=”或“<”)铜。(3)、方法二:②中反应的化学反应方程式为:三、综合题
-
18. 实验室常用浓硫酸来配制需要用的较稀的硫酸溶液。如图所示为实验室里的一瓶浓硫酸及其标签上的部分信息。请根据图示信息计算:
 (1)、该瓶浓硫酸中水的质量。(2)、现要配制500 毫升溶质质量分数为20%(密度为1.14克/立方厘米)的稀硫酸溶液,需要多少毫升这种浓硫酸?(结果保留一位小数)19. 海水淡化可采用膜分离技术(如图一),对淡化膜右侧的海水加压,在其左侧可得到淡水。其原理是海水中的水分子可以透过淡化膜,而其他各种微粒不能透过。
(1)、该瓶浓硫酸中水的质量。(2)、现要配制500 毫升溶质质量分数为20%(密度为1.14克/立方厘米)的稀硫酸溶液,需要多少毫升这种浓硫酸?(结果保留一位小数)19. 海水淡化可采用膜分离技术(如图一),对淡化膜右侧的海水加压,在其左侧可得到淡水。其原理是海水中的水分子可以透过淡化膜,而其他各种微粒不能透过。 (1)、采用膜分离技术淡化海水的过程,与化学实验中常见的操作相似。(2)、当加压一段时间后,右侧剩余海水(无晶体析出)与加压前相比不变的是____(填字母)。A、溶液质量 B、溶剂质量 C、溶质质量 D、溶质质量分数(3)、海水中含有大量的氯化钠,如图二所示为氯化钠的溶解度曲线图,据此可知盐场从海水中得到食盐晶体利用的方法主要是(填“降温”或“蒸发”)结晶。20. 2024年是国家实行《“体重管理年”活动实施方案》的起始年,减盐、减糖、保持健康体重以及通过适量的有氧运动(如:慢跑、游泳等)等是实现体重管理的重要方法。查阅活动实施方案可知:健康成年人食盐摄入量每天不超过5克;摄入碳水化合物过量会导致肥胖。(1)、从新陈代谢的角度解释肥胖形成的原因是。(2)、游泳有助于减脂。游泳时,手向后划水人就向前运动,这一现象蕴含的科学原理是。(3)、若某日摄入食盐(氯化钠)4.5克,请计算利用4.5克氯化钠可以配制成多少克的生理盐水。 (已知生理盐水的质量分数为0.9%)21. 某工厂生产的NaCl产品中含有杂质MgCl2 , 化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:
(1)、采用膜分离技术淡化海水的过程,与化学实验中常见的操作相似。(2)、当加压一段时间后,右侧剩余海水(无晶体析出)与加压前相比不变的是____(填字母)。A、溶液质量 B、溶剂质量 C、溶质质量 D、溶质质量分数(3)、海水中含有大量的氯化钠,如图二所示为氯化钠的溶解度曲线图,据此可知盐场从海水中得到食盐晶体利用的方法主要是(填“降温”或“蒸发”)结晶。20. 2024年是国家实行《“体重管理年”活动实施方案》的起始年,减盐、减糖、保持健康体重以及通过适量的有氧运动(如:慢跑、游泳等)等是实现体重管理的重要方法。查阅活动实施方案可知:健康成年人食盐摄入量每天不超过5克;摄入碳水化合物过量会导致肥胖。(1)、从新陈代谢的角度解释肥胖形成的原因是。(2)、游泳有助于减脂。游泳时,手向后划水人就向前运动,这一现象蕴含的科学原理是。(3)、若某日摄入食盐(氯化钠)4.5克,请计算利用4.5克氯化钠可以配制成多少克的生理盐水。 (已知生理盐水的质量分数为0.9%)21. 某工厂生产的NaCl产品中含有杂质MgCl2 , 化学兴趣小组取100g样品完全溶解于313.6g水中,向该溶液中分5次加入一定浓度的氢氧化钠溶液,每次30g,充分反应。测得实验数据如下表所示:次数
第1次
第2次
第3次
第4次
第5次
加入氢氧化钠溶液的质量/g
30
30
30
30
30
累计生成沉淀的质量/g
2.9
5.8
8.7
11.6
11.6
请完成下列各题:
(1)、第次恰好完全反应。(2)、样品中MgCl2的质量是g。(3)、计算恰好完全反应时所得溶液的溶质质量分数(写出规范的计算过程)22. 某实验小组为测定食盐样品(含氯化钙杂质)中氯化钠的质量分数,进行如下实验:将80克食盐样品平均分成4份,分别加入4个烧杯中,各加入80克水溶解后,向每组中加入不同质量的相同浓度的碳酸钠溶液,充分反应后过滤、洗涤、干燥,称量生成的沉淀质量。实验数据如下表所示:实验组数
二
三
四
加入碳酸钠溶液的质量/克
10
20
30
40
产生的沉淀质量/克
0.8
1.6
2.0
2.0
(1)、由表格数据可知,实验中氯化钙被完全反应的组有。(2)、计算该食盐样品中氯化钠的质量分数。(3)、计算第三组反应后所得溶液中氯化钠的质量分数。(精确到0.1%)