专题六 分子、原子、离子、元素--【高效复习】2023-2024学年八年级科学期中复习(浙教版)
试卷更新日期:2024-04-17 类型:复习试卷
一、选择题
-
1. 2023年10月我国科学家发现了一种新矿物——铌(ní)包头矿,富含的铌元素在我国核工业系统等领域具有重要用途。铌在元素周期表中的相关信息如图所示,下列关于铌的说法不正确的是( )
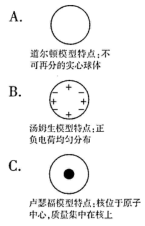
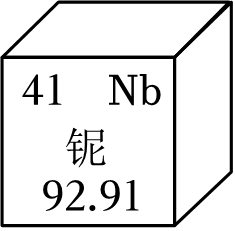 A、铌的元素符号为Nb B、铌原子的质子数和中子数相同 C、铌原子的核外电子数为41 D、铌的相对原子质量为92.912. 下列有关元素和微粒的说法,错误的是( )A、分子、原子和离子都是构成物质的粒子 B、同种元素的原子核内质子数与中子数一定相等 C、周期表中元素的原子序数与该元素原子的核电荷数在数值上相同 D、当物质发生化学变化时,原子的种类不变,元素的种类也不会改变3. 分子和原子的主要区别是( )。A、分子能直接构成物质,原子不能 B、在化学反应中,分子可分,原子不可分 C、分子质量大,原子质量小 D、分子间有空隙,而原子间无空隙4. 卢瑟福用α粒子(带正电)轰击金箔的实验为建立现代原子理论打下了基础。如图所示,不可能是α粒子在该实验中的运动轨迹的是( )
A、铌的元素符号为Nb B、铌原子的质子数和中子数相同 C、铌原子的核外电子数为41 D、铌的相对原子质量为92.912. 下列有关元素和微粒的说法,错误的是( )A、分子、原子和离子都是构成物质的粒子 B、同种元素的原子核内质子数与中子数一定相等 C、周期表中元素的原子序数与该元素原子的核电荷数在数值上相同 D、当物质发生化学变化时,原子的种类不变,元素的种类也不会改变3. 分子和原子的主要区别是( )。A、分子能直接构成物质,原子不能 B、在化学反应中,分子可分,原子不可分 C、分子质量大,原子质量小 D、分子间有空隙,而原子间无空隙4. 卢瑟福用α粒子(带正电)轰击金箔的实验为建立现代原子理论打下了基础。如图所示,不可能是α粒子在该实验中的运动轨迹的是( )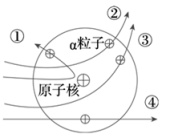 A、① B、② C、③ D、④5. 如图所示为四种原子的结构模型(“●”“
A、① B、② C、③ D、④5. 如图所示为四种原子的结构模型(“●”“ ”和“
”和“ ”分别表示电子、中子和质子),下列说法正确的是( )
”分别表示电子、中子和质子),下列说法正确的是( )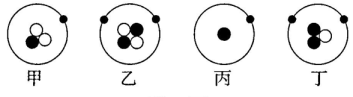 A、甲、丙的核电荷数不同 B、乙、丁不属于同一种元素 C、甲、丁的相对原子质量相同 D、甲、乙互为同位素原子6. 如图所示为元素周期表的一部分,下列说法中错误的是( )
A、甲、丙的核电荷数不同 B、乙、丁不属于同一种元素 C、甲、丁的相对原子质量相同 D、甲、乙互为同位素原子6. 如图所示为元素周期表的一部分,下列说法中错误的是( )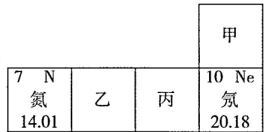 A、氮元素位于元素周期表第二周期 B、氖原子的相对原子质量为20.18克 C、氮元素和乙元素组成的物质是空气污染物 D、与丙化学性质相似的元素的原子,最外层有7个电子7. 分析下列各组微粒结构示意图,其中与表示的意义一致的是( )A、
A、氮元素位于元素周期表第二周期 B、氖原子的相对原子质量为20.18克 C、氮元素和乙元素组成的物质是空气污染物 D、与丙化学性质相似的元素的原子,最外层有7个电子7. 分析下列各组微粒结构示意图,其中与表示的意义一致的是( )A、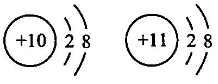 都属于阳离子
B、
都属于阳离子
B、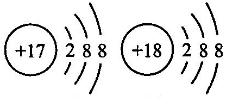 都属于阴离子
C、
都属于阴离子
C、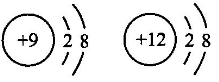 属于一种原子
D、
属于一种原子
D、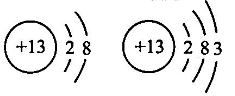 属于一种元素
8. 质子和中子都是由u夸克和d夸克组成的,u夸克带电量为e,d夸克带电量为为为基础电荷。下列论断可能正确的是( )A、质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 B、质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 C、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 D、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成9. 小科同学在学习了原子和元素的知识后,对相关知识作了如下总结:
属于一种元素
8. 质子和中子都是由u夸克和d夸克组成的,u夸克带电量为e,d夸克带电量为为为基础电荷。下列论断可能正确的是( )A、质子由1个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 B、质子由1个u夸克和2个d夸克组成,中子由2个u夸克和1个d夸克组成 C、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和2个d夸克组成 D、质子由2个u夸克和1个d夸克组成,中子由1个u夸克和1个d夸克组成9. 小科同学在学习了原子和元素的知识后,对相关知识作了如下总结:①原子都是由质子、中子和电子构成的;
②在原子中,核电荷数=质子数=核外电子数=原子序数;
③不同元素的最本质区别是质子数不同;
④一个原子的质量就是相对原子质量,它没有单位;
⑤原子的最外层电子数决定了元素的化学性质;
⑥原子核外的电子是分层运动的;
⑦具有相同核电荷数的粒子一定属于同种元素。其中正确的有( )
A、①④⑦ B、①④⑥ C、⑤⑥⑦ D、②③⑤⑥10. 化学上用符号“”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。 已知:和的电子层排布完全相同,则下列关系正确的是( )A、b=a=d-c B、a+n=c-m C、b-n=d+n D、a-n=c+m11. 下列关于Na、Na+两种粒子的判断正确的是( )①核电荷数相同②核外电子数相等
③Na+比Na稳定④质量几乎相等
⑤质子数相等
A、①②⑤ B、②④ C、①③④⑤ D、①②③④⑤12. 氯化钠晶体是由钠离子和氯离子构成,每个.Na+同时吸引6个 Cl- , 每个 Cl-同时吸引6个Na+ , 结构向空间拓展形成晶体,所以晶体中 Na+数目与 Cl-数目之比为1:1,晶体结构单元如图所示。则在氯化钠的晶体中,每个 Na+周围与它最近的且距离相等的 Na+个数为()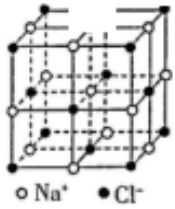 A、6 B、4 C、12 D、813. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S14. 经实验测得某一溶液由Na+、Mg2+、Cl-、 四种离子组成,其中含有4.6克Na+、14.4克 、14.2克Cl- , 则Mg2+质量为( )
A、6 B、4 C、12 D、813. 有三种元素X、Y、Z,已知X和Y原子核外电子层数相同,Y和Z原子最外层电子数相同,又知三种元素原子最外层电子总数之和为14,而质子数之和为28,则三种元素有可能是( )A、C、N、P B、N、O、S C、N、P、F D、Na、O、S14. 经实验测得某一溶液由Na+、Mg2+、Cl-、 四种离子组成,其中含有4.6克Na+、14.4克 、14.2克Cl- , 则Mg2+质量为( )
A、2.4克 B、5克 C、6克 D、4.8克15. 元素R在化合物中只有一种化合价,下列化学式有一个是错误的,它是()A、R(OH)2 B、RCl3 C、R2(SO4)3 D、R2O3二、填空题
-
16. 元素周期表是学习和研究的重要工具,请根据如图所示回答相应问题。
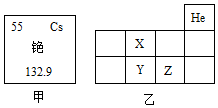 (1)、图甲是铯元素在元素周期表中的信息,则铯属于 (选填“金属”或“非金属”)元素,该元素原子的核外电子数为 。(2)、图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 ____。A、原子序数:Y>Z B、Y、Z位于同一周期 C、X、Y的核外电子数相同 D、从图中可推得X表示氮元素17. 建立宏观、微观和符号之间的联系是化学学科的特点。
(1)、图甲是铯元素在元素周期表中的信息,则铯属于 (选填“金属”或“非金属”)元素,该元素原子的核外电子数为 。(2)、图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下判断正确的是 ____。A、原子序数:Y>Z B、Y、Z位于同一周期 C、X、Y的核外电子数相同 D、从图中可推得X表示氮元素17. 建立宏观、微观和符号之间的联系是化学学科的特点。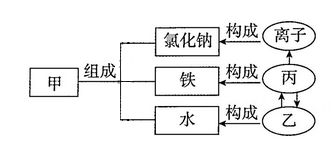
请根据图中信息回答下列问题:
(1)、从宏观角度看,物质是由各种(甲)组成的,如氯化钠是由组成的。(2)、从微观角度看,物质又是由(乙)、(丙)、离子等基本粒子构成的。18. 离子符号的写法⑴只带一个单位电荷(正、负电荷),则把个数“1”省去,直接在元素符号右上角写“+”或“-”号,如 Na+、Cl-等。
⑵带多个单位电荷(正、负电荷),则在元素符号右上角先写电荷数,再写“+”或“-”.号,如 Mg²+、Al³+、O²-等。
⑶较为复杂的离子:有些离子的组成不止一种元素,如OH-和SO4²-等,这种离子称为某某根离子,这些离子是带电的原子团。常见的带电原子团有:
离子名称
离子符号
离子所带电荷
硫酸根离子
SO42-
碳酸根离子
CO32-
-2
碳酸氢根离子
HCO3-
硝酸根离子
NO32-
-1
氢氧根离子
OH-
-1
铵根离子
NH4+
+1
磷酸根离子
PO43-
-3
说明原子团右上角的数字表示的是整个原子团所带的电荷,而不是某个原子所带的电荷。
19. 常见离子名称
符号
名称
符号
铝离子
Mg²+
钠离子
钙离子
氢离子
K+
Fe³+
Fe²+
铜离子
钡离子
氧离子
F-
Cl-
硫离子
20. 如图为元素周期表的部分结构,请按要求回答下列问题。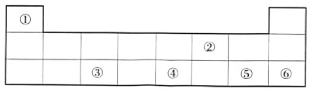 (1)、在①~⑥六种元素中,化学性质最不活泼的是 , 属于地壳中含量最高的金属元素是。(均填序号)(2)、元素①和元素⑤形成的化合物的化学式为。
(1)、在①~⑥六种元素中,化学性质最不活泼的是 , 属于地壳中含量最高的金属元素是。(均填序号)(2)、元素①和元素⑤形成的化合物的化学式为。三、解答题
-
21. 元素周期表是学习科学的重要工具。如图所示为元素周期表的一部分;
H
He
Li
Be
B
C
N
①
F
Ne
Na
Mg
②
Si
P
S
Cl
Ar
(1)、晶体硅是制造计算机芯片的材料,硅元素位于第周期 。(2)、X-、Y2+和Ne原子具有相同的核外电子数,X-、Y2+的离子符号分别是。(3)、①和②两种元素组成的化合物的化学式为。22. 钠及其化合物是生产和生活中重要的物质,请回答下列问题:(1)、自然界中钠元素以(填“单质”或“化合物”)的形式存在。(2)、将钠保存在煤油中,是为了防止钠因与空气中的和水反应而变质。(3)、过氧化钠(Na2O2)中的阴离子为O 1个O-含有的电子数为。 (4)、钠钾合金常用作快中子反应堆的热交换剂 ,这是利用了钠钾合金良好的____。(填字母)A、导电性 B、导热性 C、延展性(5)、利用钠的强还原性,在一定条件下可以将钛(Ti)从其氯化物中置换出来。请写出高温下钠与四氯化钛(TiCl4)反应的化学方程式:。23. “原子—分子”学说的建立经历了曲折的过程。
1个O-含有的电子数为。 (4)、钠钾合金常用作快中子反应堆的热交换剂 ,这是利用了钠钾合金良好的____。(填字母)A、导电性 B、导热性 C、延展性(5)、利用钠的强还原性,在一定条件下可以将钛(Ti)从其氯化物中置换出来。请写出高温下钠与四氯化钛(TiCl4)反应的化学方程式:。23. “原子—分子”学说的建立经历了曲折的过程。材料一:1803年,道尔顿在原子论中提出:元素由微小的不可分的原子组成;不同元素的原子以简单数目比例形成不可再分的原子——“复杂原子”。
材料二:1809年,盖·吕萨克认同道尔顿的原子论,并提出自己的假说:在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。道尔顿反对盖·吕萨克的假说,他认为若该假说成立,解释化学反应时,有些反应会推导出“半个原子”,与原子论矛盾。
材料三:1811年,阿伏加德罗提出分子学说,解决了道尔顿和盖·吕萨克的矛盾。随后科学家们确立并逐步完善了“原子—分子”学说。
(1)、1897年,汤姆生发现原子内有带负电的 , 否定了“原子不可再分”的观点。(2)、道尔顿原子论中“复杂原子”构成的物质,按现在物质的组成分类,属于纯净物中的。(3)、依据道尔顿的原子论和盖·吕萨克的假说,下列反应能推导出“半个原子”的是____(多选,填字母)。A、1升氢气和1升氯气化合成2升氯化氢气体 B、2升氢气和1升氧气化合成2升水蒸气 C、木炭与1升氧气化合成1升二氧化碳 D、木炭与1升二氧化碳化合成2升一氧化碳 E、硫与1升氢气化合成1升硫化氢气体24. 元素周期表是我们学习和研究化学的重要工具。下表是元素周期表中1~18号元素的原子核外电子排布,我们对它进行研究: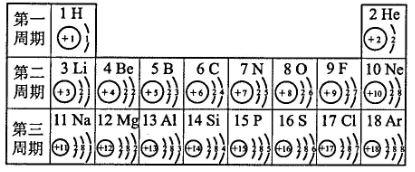 (1)、第17号元素的名称是 , 它属于(填“金属”或“非金属”)元素,它在化学反应中容易(填“得”或“失”)电子,它的离子符号为。(2)、从上表中还可以探究出以下规律:原子核外电子数=原子序数==(3)、研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,对核外电子的引力逐渐增大,故原子半径逐渐减小。我们分析第三周期11~17号元素的原子半径的变化规律是。25. 探究原子结构的奥秘。
(1)、第17号元素的名称是 , 它属于(填“金属”或“非金属”)元素,它在化学反应中容易(填“得”或“失”)电子,它的离子符号为。(2)、从上表中还可以探究出以下规律:原子核外电子数=原子序数==(3)、研究表明:第二周期3~9号元素的原子电子层数相同,核电荷数逐渐增大,对核外电子的引力逐渐增大,故原子半径逐渐减小。我们分析第三周期11~17号元素的原子半径的变化规律是。25. 探究原子结构的奥秘。【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1911 年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图所示:
⑴放射源————放射性物质放出α粒子(带正电荷),质量是电子质量的 7000倍。
⑵金箔———作为靶子,厚度 1μm,重叠了3000层左右的原子。
⑶荧光屏————α粒子打在上面发出闪光。
⑷显微镜————通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
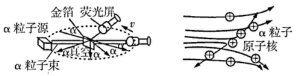
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)、 若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。(2)、1μm金箔包含了 3000 层金原子,绝大多数α粒子穿过后方向不变,说明 ____。A、原子的质量是均匀分布的 B、原子内部绝大部分空间是空的(3)、科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的 ( )