河南省南阳市六校2023-2024学年高二上学期期末联考化学试题
试卷更新日期:2024-04-11 类型:期末考试
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
-
1. 化学与生活息息相关。下列叙述错误的是( )A、杭州第19届亚运会主火炬采用甲醇作主火炬塔燃料,甲醇是可再生能源 B、节日燃放的焰火与原子核外电子跃迁释放能量有关 C、我国目前使用的主要能源是煤、水能、核能、风能和太阳能 D、手机电池放电时,化学能转化成电能、热能等2. 室内空气中甲醛的去除原理如图所示:
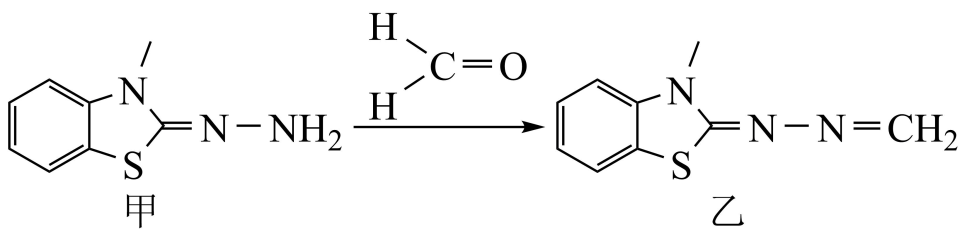
上述物质所涉及的元素中,电负性最大的是( )
A、碳 B、氧 C、氮 D、硫3. 在时,已知:①
②
③
下列叙述正确的是( )
A、乙炔的摩尔燃烧焓为 B、 C、反应②放出的热量为 D、4. 最近,我国科学家开发一种钠离子电池,放电时其工作原理如图所示(放电时,沉积在电极上)。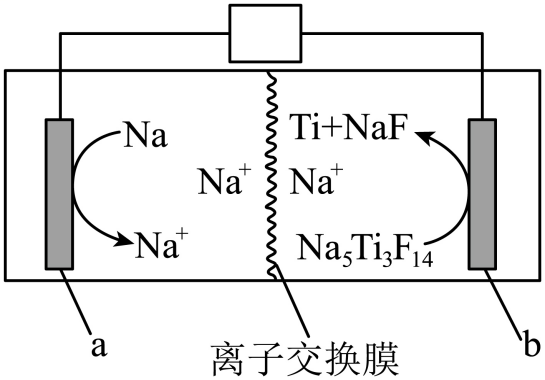
下列叙述错误的是( )
A、放电时,电子通过离子交换膜由极流向极 B、放电时,极反应式为 C、充电时,极与电源的负极连接 D、充电时,外电路中转移电子时,理论上极质量净减5. 元素的某性质递变规律如图所示: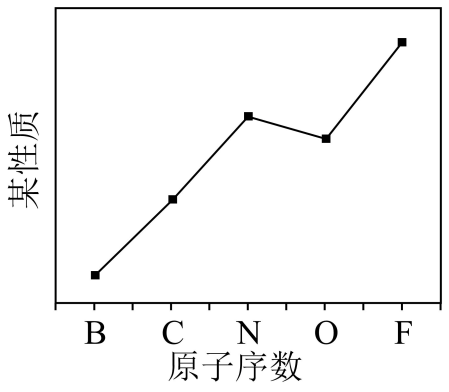
某性质代表( )
A、原子半径 B、元素的第一电离能 C、元素的电负性 D、简单氢化物的稳定性6. 一定温度下,在恒容密闭容器中充入乙烯和环丙烷,发生反应: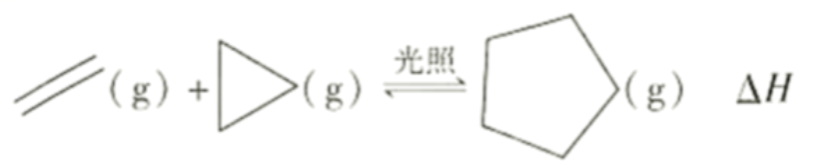
下列叙述错误的是( )
A、其他条件不变,增大乙烯浓度,能提高正反应速率 B、当压强不变时,反应达到平衡状态 C、其他条件不变,增大光照强度,会增大 D、平衡后加入催化剂,平衡不移动7. 常温下,分别加水稀释的盐酸、一氯乙酸溶液至 , 溶液的与的关系如图所示。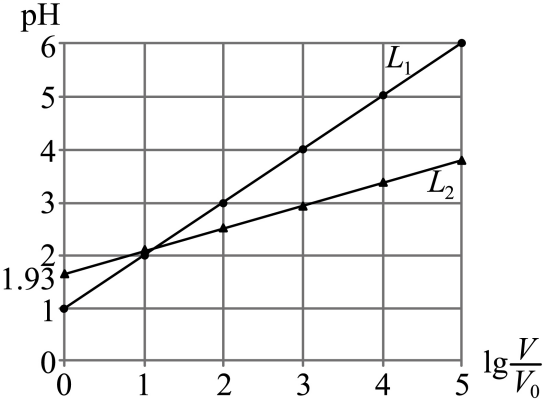
下列叙述正确的是( )
A、代表盐酸的与的关系 B、时,加热两种溶液,不变 C、加水稀释过程中,水的电离程度都减小 D、常温下,的电离常数为8. 元素周期表前四周期元素中,下列各区中元素种类最多的是( )A、s区 B、区 C、区 D、区9. 常温下,几种硫化物的溶度积如表所示。硫化物
下列叙述错误的是( )
A、溶解度: B、饱和溶液中 C、向含等浓度和的废水中通入气体,先生成沉淀 D、的平衡常数为10. 以石墨为电极,电解足量下列溶液,产生两种气体,且气体的体积比为(同温同压)的是( )A、溶液 B、溶液 C、溶液 D、溶液11. 根据下列实验操作及现象得出的结论正确的是( )选项
实验操作及现象
结论
A
常温下,用计测得溶液的
为弱酸
B
在含酚酞的溶液中加入 , 溶液颜色变浅
氧化了酚酞
C
将溶液和溶液混合产生白色沉淀和气体
白色沉淀是
D
常温下,向溶液中先滴加溶液,再滴加溶液,先生成白色沉淀,后生成黄色沉淀
A、A B、B C、C D、D12. 短周期主族元素在周期表中的相对位置如图所示,其中基态Y原子的价层电子排布式为nsnnp2n。下列叙述正确的是( ) A、基态Z原子核外电子占据5个原子轨道 B、简单氢化物的稳定性:X>Y C、基态X原子核外有3个未成对电子 D、R的氧化物对应的水化物一定是强酸13. 容器甲、乙的起始体积相同,分别充入和的混合气体,发生反应:。
A、基态Z原子核外电子占据5个原子轨道 B、简单氢化物的稳定性:X>Y C、基态X原子核外有3个未成对电子 D、R的氧化物对应的水化物一定是强酸13. 容器甲、乙的起始体积相同,分别充入和的混合气体,发生反应:。容器
甲
乙
条件
恒温恒容
绝热恒容
平衡时气体的物质的量
甲
乙
平衡常数
甲
乙
平衡时正反应速率
甲
乙
的平衡转化率
甲
乙
下列比较错误的是( )
A、(甲)(乙) B、甲乙 C、(甲)(乙) D、(甲)(乙)14. 已知亚磷酸是二元弱酸。常温下,向溶液中滴加溶液,溶液的与的关系如图所示。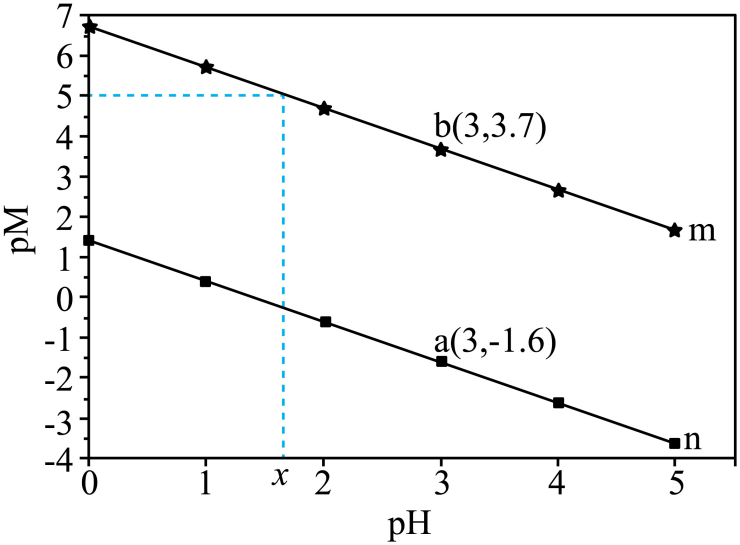
下列叙述错误的是( )
A、时溶液中 B、 C、的平衡常数为 D、图中二、非选择题:本题共4小题,共58分。
-
15. 磷酸铁常用作制备电极材料的原料。一种制备磷酸铁的流程如图所示:
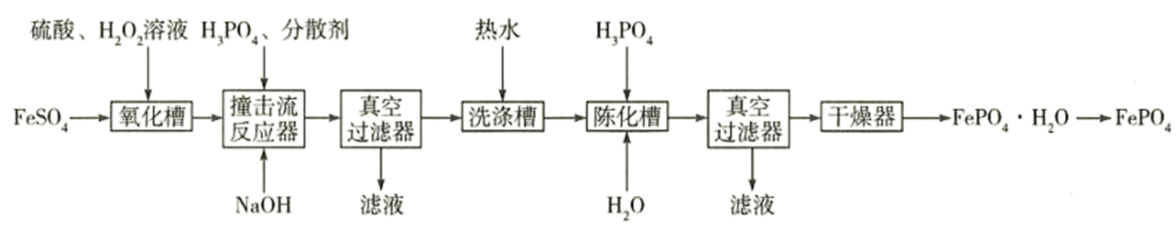
回答下列问题:
(1)、的价层电子排布式是 , 其中未成对电子数为。中含有化学键的类型有。(2)、实验室保存溶液时常加少量稀硫酸,其作用是。还加少量铁粉,其作用是。(3)、为了提高“氧化槽”中的反应速率,宜采取的措施有(填一条)。(4)、“真空过滤”与抽滤原理相同,采用“真空过滤器”的优点有。(5)、“撞击流反应器”、“陈化槽”都使用了磷酸,该酸在水中第二步电离的离子方程式为。(6)、已知常温下,。的电离常数 , , 当时,已完全沉淀。“撞击流反应器”中,若保持溶液中含浓度为 , 当其时,(用含的代数式表示)。16. 六种元素在元素周期表中的位置如图所示。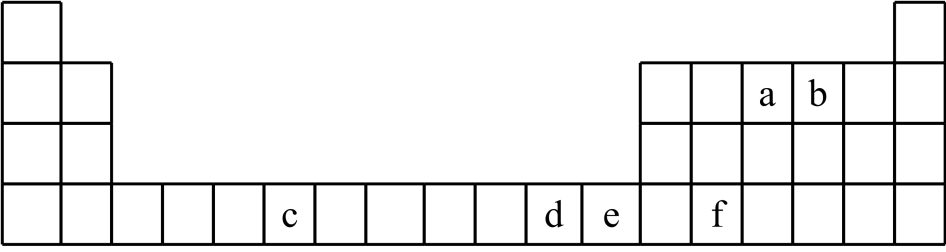
回答下列问题:
(1)、基态元素原子核外有种不同运动状态的电子。(2)、上述6种元素中,第一电离能最大的是(填元素符号)。(3)、基态元素的原子有个未成对电子,元素位于区。基态元素原子的价电子轨道表示式为。(4)、基态元素原子的电子排布简式为 , 其能量最高能层的符号是。(5)、在元素中,第二电离能与第一电离能相差较大的是(填元素符号),判断依据是。17. 二氯六氨合铜是一种重要的化工产品。某小组拟制备并测定其纯度。制备原理是强冷条件下:。(1)、(一)制备产品,实验装置如图所示
装置B中添加四氯化碳的目的是。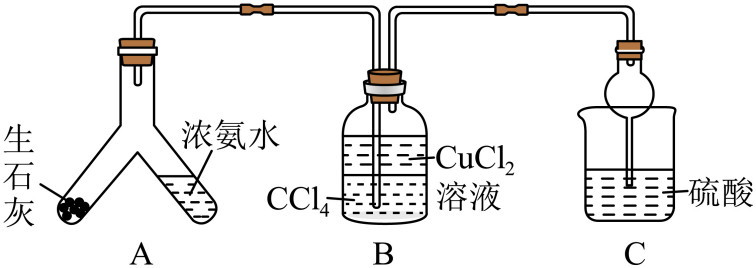 (2)、启动装置A中反应的操作是;用平衡移动原理解释制备氨气的原理:。(3)、实验完毕后,向装置B中加入适量乙醇,析出蓝色晶体,经过、洗涤、晾干得到产品(4)、(二)测定产品纯度,实验装置如图所示。
(2)、启动装置A中反应的操作是;用平衡移动原理解释制备氨气的原理:。(3)、实验完毕后,向装置B中加入适量乙醇,析出蓝色晶体,经过、洗涤、晾干得到产品(4)、(二)测定产品纯度,实验装置如图所示。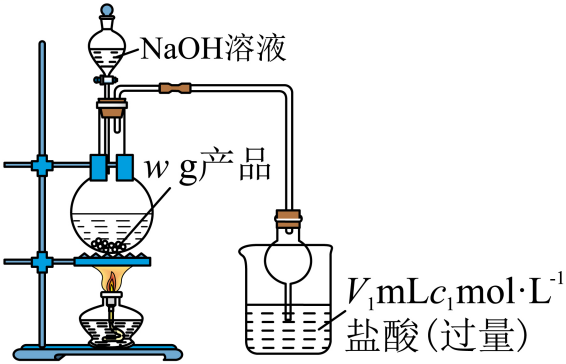
向烧瓶中加入足量溶液,产生蓝色沉淀,逸出的氨气被过量的盐酸吸收;完全反应后,取下烧杯并用蒸馏水冲洗干燥管,将洗涤液和烧杯中的溶液合并。稀释溶液至 , 准确量取该溶液于锥形瓶中,滴几滴指示剂 , 用标准溶液滴定至终点,消耗滴定液(假设杂质不参与反应)。
指示剂X应选择。
(5)、该产品的纯度为(用含的代数式表示)。如果碱式滴定管没有润洗,测得的结果(填“偏高”“偏低”或“无影响”)。18. 工业上采用多种还原剂NH3、CO、H2等还原NO气体。(1)、Ⅰ.NH3还原法。已知:①
②
的逆反应活化能与正反应活化能之差等于kJ/mol。(2)、在密闭容器中充入4 mol NH3和6 mol NO,发生反应:。平衡时NO的体积分数与温度、压强的关系如图所示。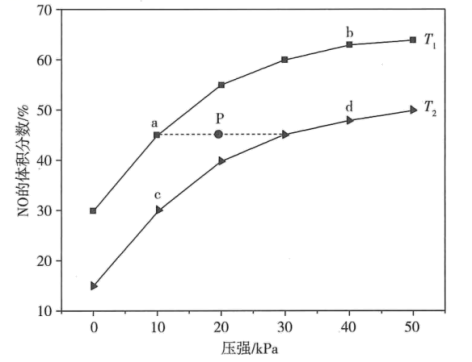
若P点对应的反应容器降温的同时扩大容器体积,重新达到平衡时可能是图中点a、b、c、d中的点。
(3)、Ⅱ.还原法。汽车尾气中的处理原理如图所示: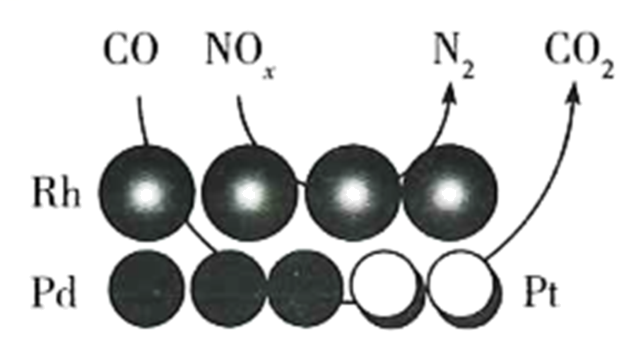
当x=1时,CO和NOx反应中N2与NOx的速率之比为。其他条件相同,增大催化剂比表面积,反应速率(填“增大”“减小”或“不变”)。
(4)、Ⅲ.H2还原法。在某催化剂作用下,的速率方程为(k为速率常数,只与温度、催化剂有关,m、n为反应级数)。为了测定反应级数,测得实验数据如下:
实验
反应速率
a
0.1
0.1
v
b
0.2
0.1
2v
c
0.2
0.2
8v
由此推知,m= , n=。
(5)、研究发现H2和NO反应分两步进行:第一步:2NO+H2=N2+H2O2 (很慢);第二步:(补充反应式)(很快),其中,第步反应控制总反应速率。(6)、一定温度下,向恒容密闭反应器中充入0.4 mol NO和0.8 mol H2 , 发生反应:。体系的总压强与时间的关系如图所示。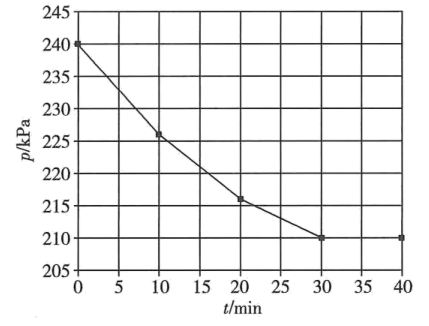
①0~30 min内用H2的分压表示的平均反应速率v(H2)为kPa·min-1。
②该温度下,平衡常数Kp=kPa-1 (Kp为用平衡分压计算的平衡常数,分压=总压×物质的量分数)。